发热伴血小板减少综合征病毒中和抗体酶联免疫吸附试验方法的建立及应用
刘丹丹,焦永军,章倩云,李志锋,祁贤,宋勇春
1. 南京大学生命科学学院,南京 210093; 2. 江苏省疾病预防控制中心,南京 210009
·论著·
发热伴血小板减少综合征病毒中和抗体酶联免疫吸附试验方法的建立及应用
刘丹丹1,焦永军2,章倩云1,李志锋2,祁贤2,宋勇春1
1. 南京大学生命科学学院,南京 210093; 2. 江苏省疾病预防控制中心,南京 210009
摘要:本文旨在对发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome,SFTS)患者中和抗体进行定性和效价评估,建立中和抗体酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)。用96孔微量培养板培养非洲绿猴肾细胞(Vero-E6)并接种发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,SFTSV),以抗核衣壳蛋白(nucleocapsid protein,NP)单克隆抗体为一抗,使用间接ELISA检测SFTSV NP,根据光密度(optical density,OD)判断阳性孔数,采用Reed-Muench方法计算病毒半数组织培养感染剂量(50% tissue culture infective dose,TCID50),以反映SFTSV在Vero-E6细胞中的复制水平。ELISA检测中和抗体作用后的病毒残余量,可间接反映中和抗体的作用效果并进行定量。应用以上建立的微量中和-ELISA对10例SFTS患者的双份血清进行中和抗体效价测定,8例患者恢复期血清效价较急性期增高4倍以上,7份患者恢复期血清效价达1∶1 280,急性期血清效价最高为1∶640。结果提示,本研究建立的ELISA操作简便,结果判定客观,所需时间短,可用于临床血清抗体诊断,也可用于血清流行病学调查和疫苗效果临床评价等。
关键词:发热伴血小板减少综合征病毒;酶联免疫吸附试验;中和抗体
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome,SFTS)[1]是我国近年来出现的一种新的病毒性传染病,已在多省市出现,多分布于山地或丘陵地区的农村。在日本、韩国、美国也发现了相似病例。该病可引起发热、白细胞和血小板减少、消化道症状等,严重者可致死亡[2-3]。其病原体为发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,SFTSV),分类上属于布尼亚病毒科白蛉病毒属。病毒颗粒呈球形,直径80~100 nm,外有脂膜包被,基因组包含大(large,L)、中(middle,M)、小(small,S)3个单股负链RNA片段。其中L片段编码RNA依赖的RNA聚合酶,M片段编码表面糖蛋白Gn和Gc,S片段以双向方式编码病毒核衣壳蛋白(nucleocapsid protein,NP)和非结构(nonstructural,NS)蛋白[4]。实验室诊断方法主要有病毒分离、核酸分子检测和血清抗体检测等[5-6]。血清抗体水平在流行病学研究、疫苗免疫效果评价、临床诊断等方面均有重要意义,但针对血清中和抗体的检测还缺乏快速、有效的方法。本研究利用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)的特异性及敏感性,建立了一种新布尼亚病毒中和抗体的间接检测方法。
1材料与方法
1.1血清样本
临床上诊断为SFTS的患者血清样本20份(恢复期、急性期各10份)来自江苏省疾病预防控制中心。
1.2病毒
SFTSV毒株JS-2010-014由江苏省疾病预防控制中心分离保存。
1.3细胞、主要试剂及仪器
非洲绿猴肾细胞系(Vero-E6)由江苏省疾病预防控制中心保存。胎牛血清(fetal bovine serum,FBS)、DMEM细胞培养基、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)-胰酶、双抗生素、磷酸盐缓冲液(phosphate buffered saline,PBS)均购自美国Gibco公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgG购自北京中杉金桥生物技术有限公司,脱脂奶粉购自美国Bio-Rad公司,TMB Substrate Kit购自美国Thermo公司,平底96孔、24孔微量细胞培养板购自美国Costar公司,自动洗板机购自瑞士TECAN公司,酶标仪购自安图绿科生物工程有限公司。
1.4NP单克隆抗体制备
设计引物,用反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)扩增SFTSV毒株JS-2010-014 NP编码基因,克隆至表达载体pET-28a(+)(Novagen公司)。将重组质粒pET-28a(+)-NP转化大肠埃希菌BL21细胞进行表达[7],纯化后的NP与免疫佐剂混合,按常规方法免疫Balb/c小鼠,筛选高效价的SFTSV NP特异性单克隆抗体。
1.5病毒增殖
将Vero-E6细胞传代至24孔细胞培养板,37 ℃、5% CO2静置培养,待其生长至单层且覆盖率为80%左右时,弃培养上清液;PBS洗2~3次,每孔加200~400 μL SFTSV液,37 ℃、5% CO2静置吸附1~2 h,每0.5 h轻轻摇晃一次;吸附完成后弃病毒液,每孔加1 mL含2% FBS的DMEM维持液,37 ℃、5% CO2静置培养,培养4~7 d;-70 ℃反复冻融2次,收集并分装至1.5 mL离心管中,-70 ℃保存。
1.6ELISA检测
将SFTSV于96孔微量细胞培养板A1~A10孔中进行10倍连续稀释,稀释度为10-1~10-10,A12孔加入等量细胞维持液作为空白对照;每孔加入密度为1.5×105个/mL的Vero-E6细胞悬液100 μL,每个稀释度及空白对照均设4个复孔,37 ℃、5% CO2静置培养;弃培养上清液,PBS洗2次,每孔加100 μL 80%冷丙酮(PBS配制)固定10 min,室温干燥后PBS洗3次,除去残余丙酮,加入封闭液(5%脱脂牛奶)稀释(1∶7 000)的鼠抗SFTSV NP单克隆抗体100 μL,37 ℃孵育1 h;用含吐温20的PBS(PBS with Tween 20,PBST)洗4次,室温干燥后加入封闭液稀释(1∶5 000)的HRP标记羊抗鼠IgG 100 μL,37 ℃孵育0.5 h;PBST洗6次,室温干燥后加入显色液50 μL,室温静置5~10 min,待其充分显色后加入终止液50 μL,酶标仪450 nm波长测光密度(optical density,OD)值。
1.7病毒增殖曲线检测
取7块96孔微量细胞培养板进行上述处理,37 ℃、5% CO2静置培养,分别于24、48、72、96、120、144、168、192、216、240、264、288 h停止培养,用上述ELISA方法进行检测。
1.8病毒半数组织培养感染剂量(50% tissue culture infective dose,TCID50)测定
取96孔微量细胞培养板进行上述处理,37 ℃、5% CO2静置培养,于168 h停止培养,用上述ELISA方法进行检测。
1.9中和抗体检测
用所建立的ELISA对10例SFTS患者急性期和恢复期双份血清标本进行微量中和抗体检测。于96孔板中将待检血清从1∶10开始进行2倍连续稀释至1∶1 280,每个稀释度加入50 μL 100 TCID50病毒液,同时设立血清阳性对照、血清阴性对照、细胞阳性对照(细胞与100 TCID50病毒液混合培养)和细胞阴性对照(细胞与细胞维持液混合培养)。将血清与病毒充分混匀后于37 ℃、5% CO2静置作用1 h,然后加入密度为1.5×105个/mL的Vero-E6细胞悬液100 μL,轻轻振荡,充分混匀后于细胞培养箱中静置培养96 h,用上述ELISA方法进行检测。血清阳性对照为SFTS患者恢复期血清,血清阴性对照为健康人血清,两份血清对照样本均经双抗原夹心ELISA检测[7],阳性血清对照抗体效价为1∶1 280,阴性血清对照的结果为阴性。
1.10统计学处理
以实验组平均OD值/空白对照平均OD值≥2.1判断为阳性[8],根据ELISA结果判断各稀释度的阳性孔数和阴性孔数,采用Reed-Muench方法计算病毒TCID50。用GraphPad Prism6.0软件作图,横坐标为病毒增殖时间,纵坐标为各时间点病毒TCID50。中和试验结果通过细胞半数感染阈值[9]判断:细胞半数感染阈值=(细胞阳性对照平均OD值-细胞阴性对照平均OD值)/2+细胞阴性对照平均OD值。每孔OD值低于阈值时,判定为中和试验反应阳性,中和反应阳性的血清最高稀释度即为血清的中和抗体效价。
2结果
2.1病毒增殖曲线及TCID50测定
ELISA结果显示(图1),SFTSV可在Vero-E6细胞内有效增殖,0~216 h内病毒TCID50呈总体上升趋势,病毒滴度不断增加。接种后24 h ELISA即可检出病毒,216 h病毒增殖进入平台期,TCID50达10-6。
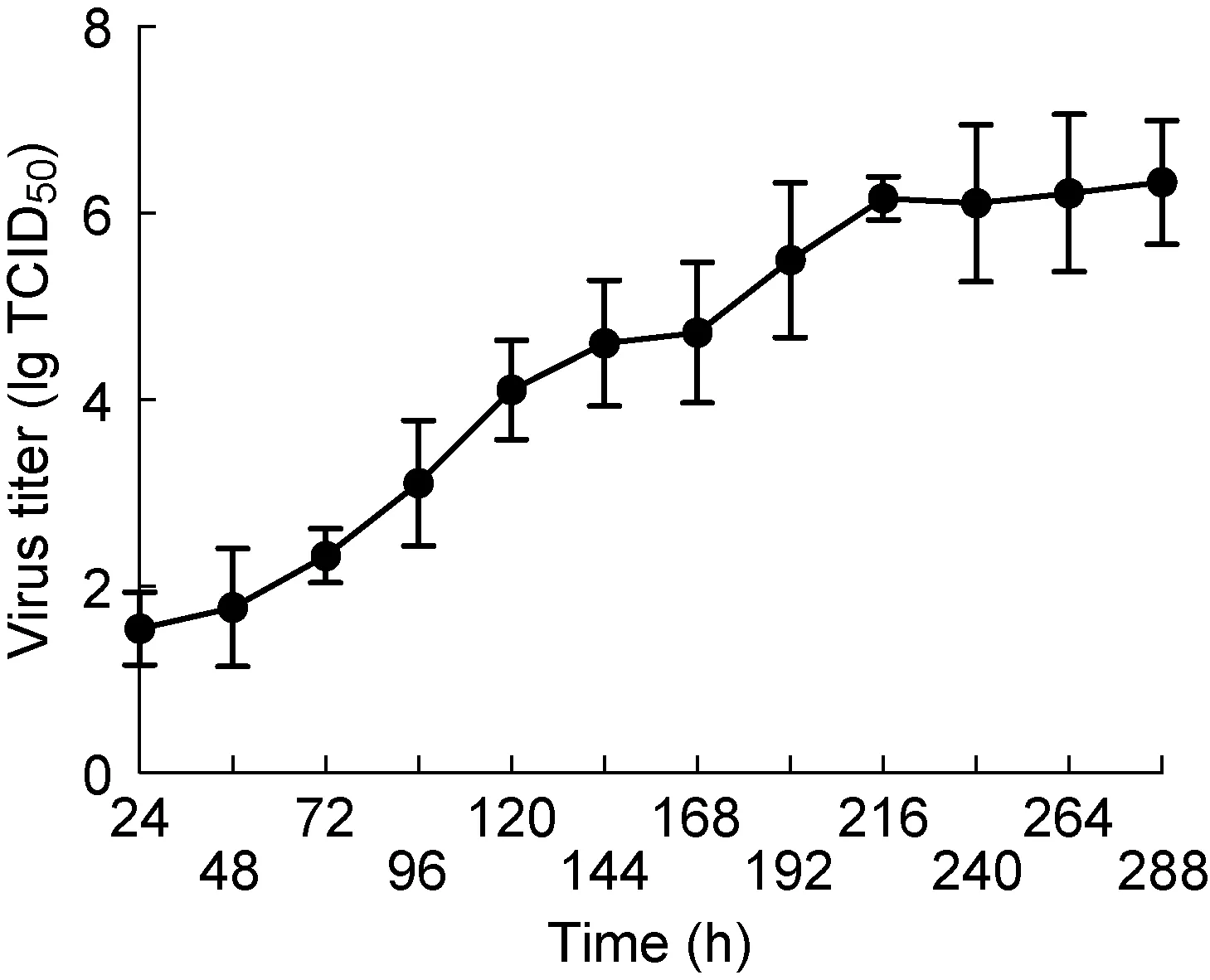
图1不同时间病毒TCID50
Fig.1The virus TCID50at different time points
2.2患者标本检测
应用建立的ELISA检测10例SFTS患者急性期和恢复期双份血清的中和抗体效价。结果显示,2例患者急性期中和抗体为阴性,但恢复期中和抗体效价显著增加,分别为1∶320、1∶640。另外8例患者急性期及恢复期血清中均可检测到中和抗体,急性期效价最低为1∶10,最高为1∶640;恢复期效价则显著增高,其中7份样本效价升高至1∶1 280,1份为1∶640。10份样本中有8份恢复期效价较急性期增高4倍以上,表示为新近感染者(表1)。
表1ELISA检测10例患者双份血清抗体效价
Tab.1Serum antibody titers detected with ELISA
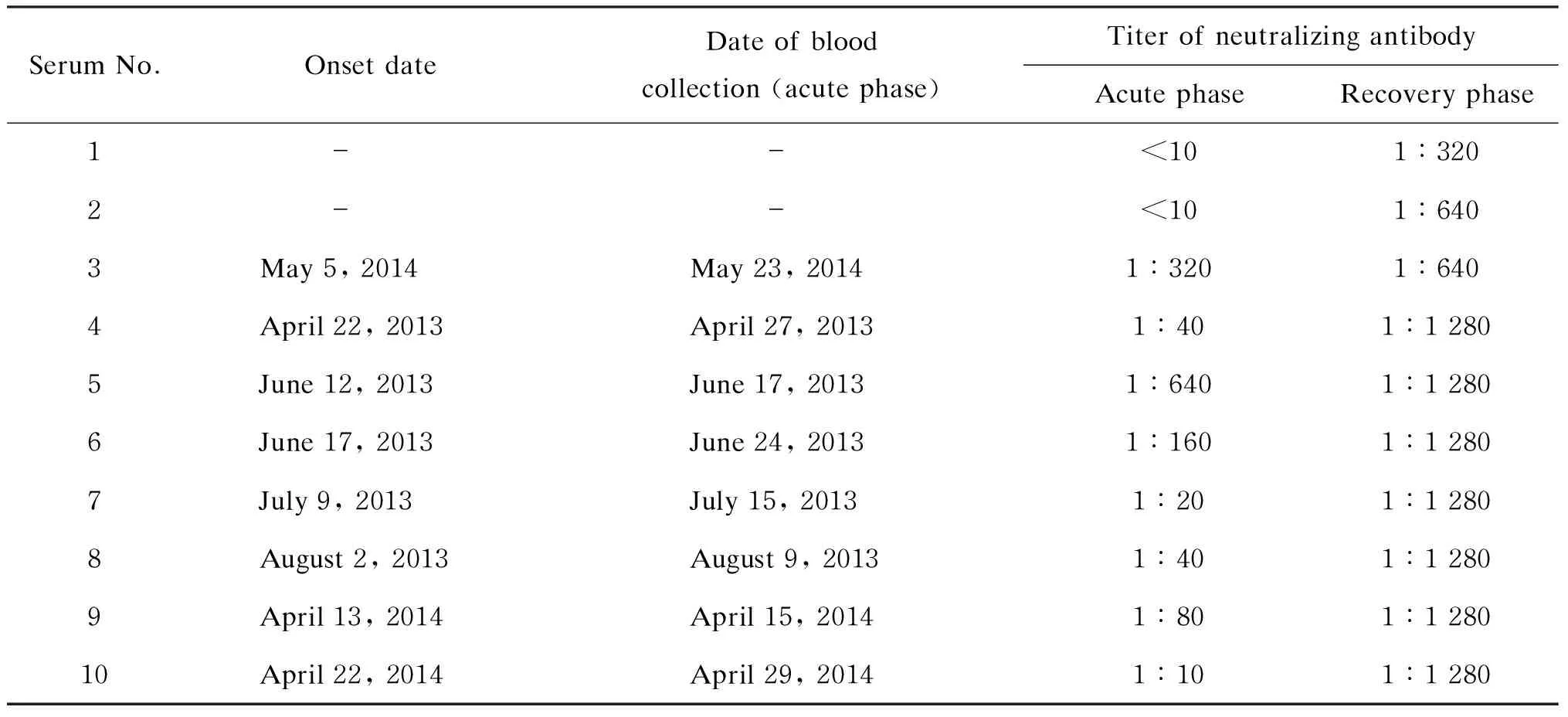
SerumNo.OnsetdateDateofbloodcollection(acutephase)TiterofneutralizingantibodyAcutephaseRecoveryphase1--<101∶3202--<101∶6403May5,2014May23,20141∶3201∶6404April22,2013April27,20131∶401∶12805June12,2013June17,20131∶6401∶12806June17,2013June24,20131∶1601∶12807July9,2013July15,20131∶201∶12808August2,2013August9,20131∶401∶12809April13,2014April15,20141∶801∶128010April22,2014April29,20141∶101∶1280
3讨论
SFTSV特异性血清抗体检测在实验室诊断、血清流行病学调查等方面均有重要作用,目前已建立多种血清抗体检测方法。NP是病毒颗粒中含量最丰富的结构蛋白,具有很强的免疫原性,感染早期即能刺激机体产生较强的抗体反应。Jiao等[7]通过体外表达NP建立了双抗原夹心ELISA,可对人和多种动物的NP总抗体进行检测。Yu等[10]建立了基于NP检测SFTSV特异性IgG和IgM抗体的间接ELISA。陈堃等[11]以基因重组表达的NP作为抗原,建立了检测SFTSV IgG抗体的ELISA。然而,NP主要参与病毒转录及复制过程,不能诱导机体产生中和抗体,因此上述方法不能用于中和抗体的检测[12]。此外,也有通过制备全病毒抗原片段建立间接免疫荧光法而对特异性IgG和IgM抗体进行检测的报道[13],能检测总抗体,但不能区分中和抗体,且结果主观性强,实验过程影响因素多。
一般认为,布尼亚病毒的中和抗体主要由糖蛋白(Gn和Gc)诱导产生。病毒感染过程中,糖蛋白通过受体识别介导病毒与细胞的吸附和融合过程[14]。微量中和试验是目前常用的病毒中和抗体检测方法。除DH28细胞外,SFTSV感染的多数宿主细胞(如Vero、Vero-E6、L929等)产生细胞病变效应(cytopathic effect,CPE)不明显,因此通过观察CPE判定病毒是否增殖有一定困难。目前主要通过间接免疫荧光测定病毒滴度和判定微量中和试验终点。Yu等[1]通过荧光抗体等建立了检测SFTSV中和抗体的微量中和试验,一般需在病毒培养至12 d时进行,耗时较长,且存在操作繁琐、观察困难、敏感性差、结果判定主观性较强、定量结果不理想、不适合大量标本检测等问题。本研究以抗NP鼠源单克隆抗体为一抗,建立间接ELISA,检测SFTSV NP,改进了病毒微量中和试验终点判定方法。该ELISA通过检测病毒NP的特异性抗体IgG,可直接反映病毒液中的病毒含量,特异度和灵敏度较高;检测结果通过OD值进行标准化的客观判定,可对病毒含量进行准确定量,从而消除了判定过程中的人为主观因素。此外,在病毒培养第6天就可进行中和抗体检测,大大缩短了时间,同时能对大量标本进行检测。
本研究通过建立的ELISA方法检测了SFTS患者血清与病毒作用后的增殖状况,间接反映患者血清抗体中和病毒的能力,可用于病毒中和抗体的定量检测,对临床上评估重症患者的病情发展有重要参考价值。该ELISA方法最早可在患者发病2 d内检出中和抗体,且恢复期中和抗体效价明显高于急性期,表明患者在恢复期已产生高效价中和抗体,在清除病毒和疾病康复过程中起了关键作用。但由于条件限制,本研究尚存在不足之处,如只对10例患者双份血清进行了检测,缺少多种方法比较和大量样本的验证,尚需进一步探讨。
参考文献
Yu XJ, Liang MF, Zhang SY, Liu Y, Li JD, Sun YL, Zhang L, Zhang QF, Popov VL, Li C, Qu J, Li Q, Zhang YP, Hai R, Wu W, Wang Q, Zhan FX, Wang XJ, Kan B, Wang SW, Wan KL, Jing HQ, Lu JX, Yin WW, Zhou H, Guan XH, Liu JF, Bi ZQ, Liu GH, Ren J, Wang H, Zhao Z, Song JD, He JR, Wan T, Zhang JS, Fu XP, Sun LN, Dong XP, Feng ZJ, Yang WZ, Hong T, Zhang Y, Walker DH, Wang Y, Li DX. Fever with thrombocytopenia associated with a novel bunyavirus in China [J]. N Engl J Med, 2011, 364(16): 1523-1532.
[2]Liang S, Bao C, Zhou M, Hu J, Tang F, Guo X, Jiao Y, Zhang W, Luo P, Li L, Zhu K, Tan W, Lu Q, Ge H, Chen A. Seroprevalence and risk factors for sever fever with thrombocytopenia syndrome virus infection in Jiangsu Province, China, 2011 [J]. Am J Trop Med Hyg, 2014, 90(2): 256-259.
[3]Zhao L, Zhai S, Wen H, Cui F, Chi Y, Wang L, Xue F, Wang Q, Wang Z, Zhang S, Song Y, Du J, Yu XJ. Sever fever with thrombocytopenia syndrome virus, Shandong Province, China [J]. Emerg Infect Dis, 2012, 18(6): 963-965.
[4]李德新.发热伴血小板减少综合征布尼亚病毒概述 [J].中华实验和临床病毒学杂志,2011,25(2):81-84.
[5]Sun Y, Liang M, Qu J, Jin C, Zhang Q, Li J, Jiang X, Wang Q, Lu J, Gu W, Zhang S, Li C, Wang X, Zhan F, Yao W, Bi Z, Wang S, Li D. Early diagnosis of novel SFTS bunyavirus infection by quantitative real-time RT-PCR assay [J]. J Clin Virol, 2012, 53(1): 48-53.
[6]Xu B, Liu L, Huang X, Ma H, Zhang Y, Du Y, Wang P, Tang X, Wang H, Kang K, Zhang S, Zhao G, Wu W, Yang Y, Chen H, Mu F, Chen W. Metagenomic analysis of fever, thrombocytopenia and leukopenia syndrome (FTLS) in Henan Province, China: discovery of a new bunyavirus [J]. PLoS Pathog, 2011, 7(11): e1002369.
[7]Jiao Y, Zeng X, Guo X, Qi X, Zhang X, Shi Z, Zhou M, Bao C, Zhang W, Xu Y, Wang H. Preparation and evaluation of recombinant severe fever with thrombocytopenia syndrome virus nucleocapsid protein for detection of total antibodies in human and animal sera by double-antigen sandwich enzyme-linked immunosorbent assay [J]. J Clin Microbiol, 2012, 50(2): 372-377.
[8]胡逢蛟,焦素黎,倪红霞,易波,李永东.间接免疫荧光法在健康人群新布尼亚病毒抗体检测中的应用 [J].国际流行病学传染病学杂志,2014,41(4):233-236.
[9]Rowe T, Abernathy RA, Hu-Primmer J, Thompson WW, Lu X, Lim W, Fukuda K, Cox NJ, Katz JM. Detection of antibody to avian influenza A (H5N1) virus in human serum by using a combination of serologic assays [J]. J Clin Microbiol, 1999, 37(4): 937-943.
[10]Yu F, Du Y, Huang X, Ma H, Xu B, Adungo F, Hayasaka D, Buerano CC, Morita K. Application of recombinant severe fever with thrombocytopenia syndrome virus nucleocapsid protein for the detection of SFTSV-specific human IgG and IgM antibodies by indirect ELISA [J/OL]. Virol J, 2015. http://virologyj.biomedcentral.com/articles/10.1186/s12985-015-0350-0.
[11]陈堃,何竞,修冰水,王国华,宋晓国,朱翠侠,杨锡琴,冯晓燕,张贺秋.新型布尼亚病毒抗体检测方法的建立及初步应用 [J].生物技术通讯,2014,25(1):100-101.
[12]Jiao L, Ouyang S, Liang M, Niu F, Shaw N, Wu W, Ding W, Jin C, Peng Y, Zhu Y, Zhang F, Wang T, Li C, Zuo X, Luan CH, Li D, Liu ZJ. Structure of severe fever with thrombocytopenia syndrome virus nucleocapsid protein in complex with suramin reveals therapeutic potential [J]. J Virol, 2013, 87(12): 6829-6839.
[13]黄学勇,杜燕华,李幸乐,马宏,满瑞琴,康锴,唐晓燕,陈豪敏,刘国华,许汴利.新布尼亚病毒IgG抗体间接免疫荧光检测方法的建立 [J].中华预防医学杂志,2012,46(2):165-168.
[14]Hofmann H, Li X, Zhang X, Liu W, Kühl A, Kaup F, Soldan SS, González-Scarano F, Weber F, He Y, Pöhlmann S. Severe fever with thrombocytopenia virus glycoproteins are targeted by neutralizing antibodies and can use DC-SIGN as a receptor for pH-dependent entry into human and animal cell lines [J]. J Virol, 2013, 87(8): 4384-4394.
Detection of neutralizing antibodies against severe fever with thrombocytopenia syndrome virus with enzyme-linked immunosorbent assay-based endpoint assessment
LIU Dandan1, JIAO Yongjun2, ZHANG Qianyun1, LI Zhifeng2, QI Xian2, SONG Yongchun1
1. School of Life Science, Nanjing University, Nanjing 210093, China; 2. Jiangsu Provincial Center for Disease Prevention and Control, Nanjing 210009, China
Abstract:An enzyme-linked immunosorbent assay (ELISA) method was developed for the detection of neutralizing antibodies against severe fever with thrombocytopenia syndrome virus (SFTSV). Vero-E6 cells in a 96-well micro-plates were challenged with SFTSV first, and then subjected to the treatment with an anti-nucleocapsid protein (SFTSV-NP) monoclonal antibody at different concentrations. The 50% tissue culture infective dose (TCID50) was calculated with Reed-Muench method. 10 double serum samples collected at two different stages of infection were subjected to the assay. 8 specimens demonstrated higher (>4 times) antibody levels in the recovery phase than that in the acute phase. In conclusion, the established ELISA method is specific, operation friendly and with an application potential for clinical research.
Key words:Severe fever with thrombocytopenia syndrome virus; Enzyme-linked immunosorbent assay; Neutralizing antibody
基金项目:国家自然科学基金(31570926),江苏省自然科学基金(BK20131450),江苏省医学重点人才基金(RC2011084)
通信作者:祁贤,宋勇春
Corresponding authors. QI Xian, E-mail: qixiansyc@hotmail.com; SONG Yongchun, E-mail: songych@nju.edu.cn
(收稿日期:2015-12-17)

