2,4-二氨基喹唑啉衍生物的抑菌活性研究
鄯科明,李天一,濮吉,3
1. 中国兵器工业规划研究院, 北京 100053; 2. 中国疾病预防控制中心传染病预防控制所传染病预防控制国家重点实验室,北京 102206; 3. 感染性疾病诊治协同创新中心,杭州 310003
·论著·
2,4-二氨基喹唑啉衍生物的抑菌活性研究
鄯科明1,李天一2,濮吉2,3
1. 中国兵器工业规划研究院, 北京 100053; 2. 中国疾病预防控制中心传染病预防控制所传染病预防控制国家重点实验室,北京 102206; 3. 感染性疾病诊治协同创新中心,杭州 310003
摘要:喹唑啉衍生物具有广泛的生物活性,包括抗菌活性。为发现此类化合物中具有潜在抑菌活性的化合物,本研究考察了15种带有哌嗪二硫代甲酸酯侧链的2,4-二氨基喹唑啉衍生物7a~7o的抑菌活性。首先采用分子对接方法对底物与酶的结合能进行预测,并用标准2倍稀释法测定这15种化合物对多重耐药大肠埃希菌的最小抑菌浓度(minimum inhibitory concentration,MIC)。结果表明,15种化合物与阳性对照相比均具有较好的抑菌活性。化合物7a、7g和7k具有明显的抑菌活性,其MIC均≤1 mg/mL。进一步采用高效毛细管电泳筛选模型对7a、7g和7k进行分子水平抑菌实验,分别测定其抑制率与半数抑制浓度(half inhibitory concentration,IC50),发现化合物7k具有最佳抑制活性(IC50为4.97×10-2mg/mL)。此外,对15种化合物抑菌活性构效关系的研究表明,苯环上连有吸电子基团的哌嗪二硫代甲酸酯侧链对抑菌活性有贡献。这一研究有望为抑菌药物的研发提供有效的先导化合物。
关键词:2,4-二氨基喹唑啉;哌嗪基-1-二硫代氨基甲酸酯;抑菌活性;抗叶酸剂;毛细管电泳
二氢叶酸还原酶(dihydrofolate reductase,DHFR)是叶酸代谢中的关键酶[1]。其在胸苷酸合成中以还原型NADPH为辅因子,将二氢叶酸(dihydrofolate,DHF)还原为四氢叶酸(tetrahydrofolate,THF)[2];THF亚甲基化后形成N5,N10-亚甲基四氢叶酸(5,10-CH2-THF),作为一碳单位供体参与胸苷酸合成酶(thymidylate synthase,TS)催化的反应[3]。TS是一种叶酸依赖酶,在菌体内以5,10-CH2-THF为辅因子催化dUMP还原甲基化生成dTMP[4]。dTMP进一步在菌体内代谢为dTTP,为DNA合成所必需的前体物质(图1A)。抑制DHFR的活性可破坏细菌的叶酸代谢及胸苷酸循环,使细菌DNA合成受阻而发挥抑菌作用。
在抗生素滥用造成细菌耐药性肆虐的今天,不断开发新的抑菌药物始终是药物及微生物领域研究的热点。此外,不同物种间DHFR的氨基酸序列存在显著差异[5],使其成为抗叶酸剂开发的潜在重要靶标[6]。因此,DHFR抑制剂筛选有重要的现实意义。DHFR抑制剂筛选的传统途径有紫外分光光度法[7]、荧光光度法[8]、同位素示踪法[9]及高效液相色谱法[10-11]等。高效毛细管电泳(high performance capillary electrophoresis,HPCE)是近年飞速发展的一种新型高效分离分析技术,主要优势是样本用量极少、分离分析模式灵活多变,在化学、环境、生命科学领域中有极广阔的应用前景[12]。目前,采用HPCE建立的DHFR抑制剂筛选模型已成功建立[13]。
作为抗叶酸剂,喹唑啉类化合物对细菌生长有良好的抑制作用[14-20]。这是因为喹唑啉类化合物与DHFR的生理底物DHF有类似的母环结构,可竞争性地结合靶蛋白。例如,2,4-二氨基-5-氯-6-取代苄氨基喹唑啉类化合物(图1B所示化合物1~3)对肺炎双球菌(Diplococcuspneumoniae,D.pneumoniae)具有较好的抑制活性[21];又如6-甲基-2-芳基/仲胺基-4-芳基喹唑啉类化合物(图1B所示化合物4和5)对金黄色葡萄球菌(Staphylococcusaureus,S.aureus)、粪肠球菌(Enterococcusfaecalis,E.faecalis)和肺炎克雷伯菌(Klebsiellapneumoniae,K.pneumoniae)的抑制活性优于对照组[22]。此外,在先前研究中发现结合于2-甲基-4-氧代喹唑啉C6位的二硫代氨基甲酸酯是药效基团[23-25],其中又以带有哌嗪二硫代甲酸酯侧链的喹唑啉衍生物(图1B所示化合物6)活性最佳。
综合上述研究结果不难发现,喹唑啉母环及喹唑啉C6位的哌嗪基二硫代甲酸酯侧链都可能提升抗叶酸剂的抑菌活性。因此,本研究拟对15种具有上述结构特征的2,4-二氨基喹唑啉衍生物(图1C所示化合物7a~7o)进行抑菌活性考察,从分子对接理论计算入手,预测待测化合物作为底物与DHFR靶蛋白的结合能力,再测定最小抑菌浓度(minimum inhibitory concentration,MIC)作为初步验证,对其中抑制效果较为明显的化合物采用已建立的HPCE模型进一步考察,以期发现具有更好抑菌活性的化合物。
1材料与方法
1.1材料
化合物7a~7o由首都师范大学化学系曹胜利教授馈赠[26]。多重耐药大肠埃希菌ST171(已证实对阿莫克拉、氨曲南、氯霉素、头孢吡肟、氨苄西林、头孢噻肟、环丙沙星、卡那霉素、呋喃妥因、哌拉西林、链霉素、四环素、萘啶酸、头孢曲松、诺氟沙星、舒巴坦、复方新诺明、头孢噻吩、头孢呋辛具有耐药性)和质控菌株大肠埃希菌ATCC 25922由中国疾病预防控制中心传染病预防控制所熊衍文研究员惠赠。大肠埃希菌源DHFR由上海医药工业研究院提供。高效毛细管电泳仪P/ACE MDQ购自美国Beckman公司,二极管阵列检测器、熔融石英毛细管柱(60 cm×75 μm)购自锐沣色谱器件有限公司,紫外分光光度计UV-250购自日本岛津公司。Mueller-Hinton(MH)培养基、MH肉汤购自北京陆桥技术股份有限公司,DHF (≥90%)、THF(≥65%)、NADPH(≥90%)、NADP(≥90%)、2-巯基乙醇、二甲基亚砜(dimethyl sulfoxide,DMSO)、Brij-35购自美国Sigma-Aldrich公司,甲氧苄啶(trimethoprim,TMP)、磺胺甲唑(sulfamethoxazole,SMX)购自中国药品生物制品检定所,其余分析纯试剂均购自国药集团化学试剂北京有限公司。蛋白浓度检测试剂盒(#500-0204)购自Bio-Rad公司,细菌培养用超纯水由美国Millipore纯水系统制得,分离分析用纯水购自杭州娃哈哈集团有限公司,96孔板购自美国Costar公司。
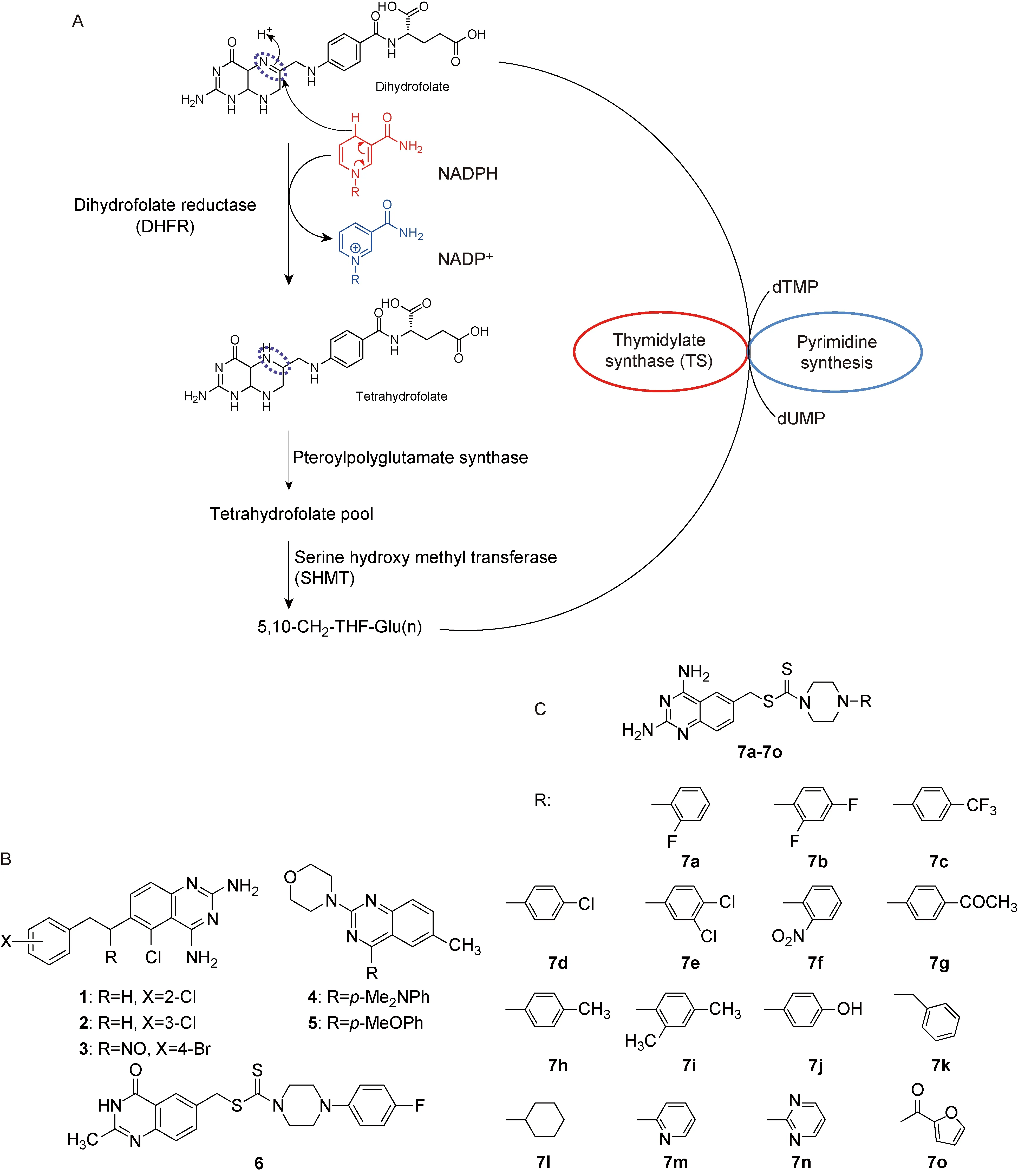
A: Schematic diagram of folic acid metabolic pathway. B: Structures of compounds 1-6. C: Structures of compounds 7a-7o.
图1叶酸代谢通路示意图以及化合物1~6和7a~7o的化学结构
Fig.1Schematic diagram of folic acid metabolic pathway and structures of compounds 1-6 and compounds 7a-7o
1.2方法
1.2.1分子对接模拟对接软件AutoDock、Vina、ADT和PyMOL获自The Scripps Institute;大肠埃希菌DHFR晶体结构(PDB ID: 4NX6)下载于蛋白质结构数据库(http://www.rcsb.org/pdb);用于对接计算的化合物7a~7o三维结构由化学软件ChemDraw和Chem3D绘制。
1.2.2MIC的测定待测化合物7a~7o对大肠埃希菌ST171的MIC参考美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)的标准2倍稀释法[27]进行,实验平行3次。以大肠埃希菌ATCC 25922为质控菌株,复方新诺明的主要成分TMP-SMX为药物阳性对照(TMP和SMX的浓度分别为16和80 mg/mL)[28],相同条件下不加入药物的菌液为阴性对照。
1.2.3酶活力的测定采用紫外分光光度法在20 ℃测定DHFR酶活力,比色池光径为1 cm,监测波长为340 nm,摩尔吸光系数为12 300 L/(mol·cm)[29]。测活体系包括含0.02% 2-巯基乙醇的50 mmol/L 磷酸盐缓冲液(phosphate buffered saline, PBS)(pH 7.0)、0.1 mmol/L DHF、0.1 mmol/L NADPH和0.7 μg/mL DHFR,总体积1.2 mL。以不加DHFR的体系为空白对照。一个单位的酶活力定义为:在该检测条件下,1 min还原1 μmol/L DHF所需的酶质量。
1.2.4抑制率及半数抑制浓度的测定抑制率及半数抑制浓度(half inhibitory concentration,IC50)的测定采用HPCE,分离条件参照文献[30]。将待测化合物7a、7g和7k精确称量0.5 mg(赛多利斯精密天平,CPA225D),先溶于25 μL DMSO中(不易溶的化合物采取加热助溶后再冷却至室温),再用20%乙醇稀释至500 μL,即配成1 mg/mL标准溶液。另取Eppendorf管,依次加入 25 μL 50 mmol/L PBS (pH 6.0)、10 μL 25 μg/mL DHF溶液(精确称取1 mg DHF溶于含0.02% 2-巯基乙醇的50 mmol/L PBS,pH 7.0)、10 μL 0.25 u/mg DHFR溶液、5 μL 0.5 mg/mL NADPH溶液(精确称取1 mg NADPH溶于1 mL 40 mmol/L NaOH溶液),涡旋振荡混匀后于室温反应30 min。以5 μL 50 mmol/L PBS (pH 6.0)代替抑制剂进行对照实验,以不加DHFR的体系进行空白实验。混合后的待测样本用HPCE分离[10],以THF和DHF峰面积的差值计算抑制率及IC50。
2结果
2.1分子对接模拟
待测化合物7a~7o三维结构及DHFR晶体结构采用ADT处理并转换成pdbqt格式,建立处理后的化合物数据库。运行AutoGrid,GridBox中心选择晶体结合区域30.0×30.0×30.0,1.0 Å。Vina计算输出的待测化合物7a~7o对DHFR的结合能预测结果见表1。采用PyMOL进一步分析底物与酶的相互作用。图2以化合物7k为例显示了分子对接模拟底物与酶的结合。
表1分子对接结合能预测和最小抑菌浓度(n=5)
Tab.1Binding energy calculated by docking and MIC (n=5)
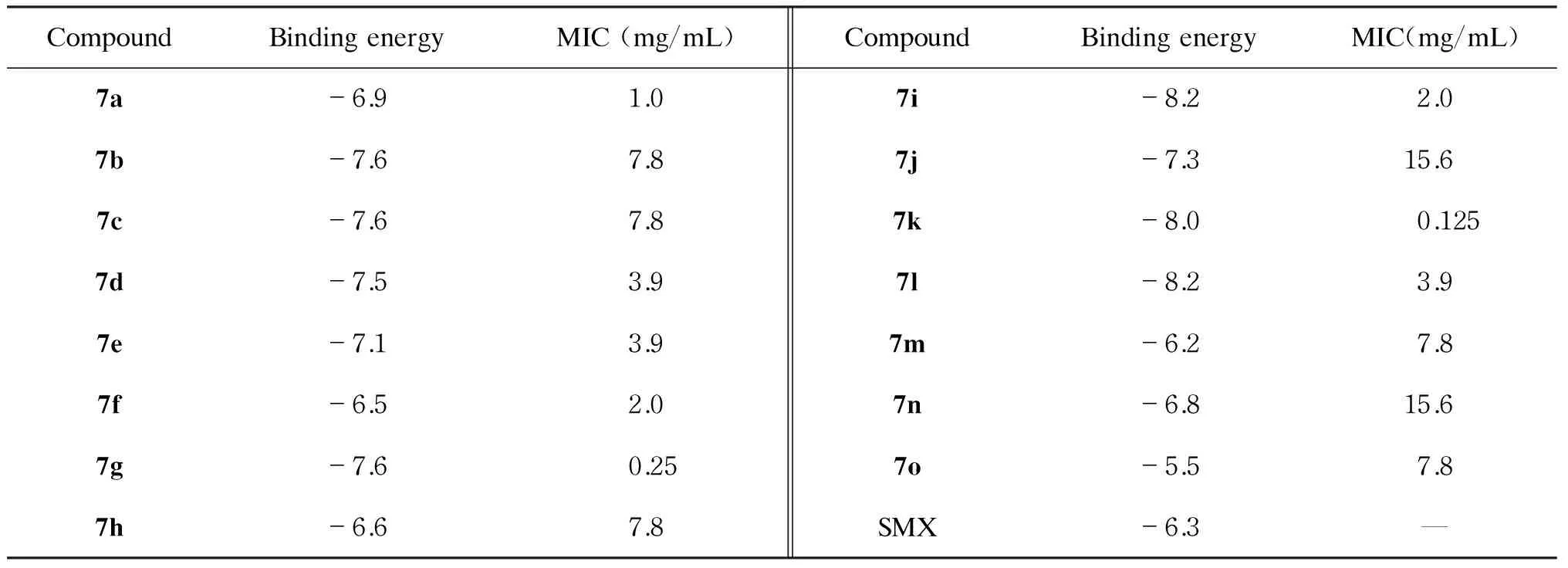
CompoundBindingenergyMIC(mg/mL)CompoundBindingenergyMIC(mg/mL)7a-6.91.07i-8.22.07b-7.67.87j-7.315.67c-7.67.87k-8.00.1257d-7.53.97l-8.23.97e-7.13.97m-6.27.87f-6.52.07n-6.815.67g-7.60.257o-5.57.87h-6.67.8SMX-6.3—
—, no antibacterial effect from the first well at half original concentration.
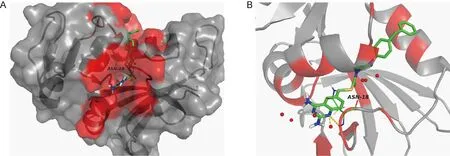
A: Surface representation of DHFR crystal structure and active site cleft (colored in red). B: Crystal structure of compound 7k bound to DHFR (hydrogen bonds are highlighted with yellow dotted lines, and water molecular is presented as red ball).
图2化合物7k与DHFR的对接模拟
Fig.2Docking simulation of compound 7k and DHFR
2.2MIC的测定
以MIC测定结果作为初步判断依据。该值越低表明药物具有越强的潜在抑菌活性。由表1可知,化合物7a、7g和7k具有明显的抑菌活性,MIC均≤1.0 mg/mL。
2.3酶活力、抑制率及IC50的测定
为确保后续抑制实验的可靠性,首先对DHFR的酶活力进行验证。测得DHFR的比活达5.8 μmol/(mg·min),与文献报道相符[31]。根据MIC的初步筛选结果,发现7a~7o系列化合物中有3种化合物(7a、7g和7k)具有较好的抑制活性(MIC≤1.0 mg/mL),进一步考察这3种带有哌嗪基-1-二硫代氨基甲酸酯侧链的2,4-二氨基喹唑啉类化合物对大肠埃希菌DHFR的抑菌率和IC50。
首先对化合物7a、7g和7k纯品进行HPCE,其迁移谱图如图3所示。然后,将化合物7a、7g和7k作为DHFR抑制剂分别加入DHFR酶反应体系中,通过对比加入前后电泳图谱中DHF与THF的峰面积考察抑制效果。图4以化合物7k为例,显示了酶反应体系加入抑制剂7k前后的电泳迁移谱图。

A: Compound 7g. B: Compound 7a. C: Compound 7k.
图3化合物7g、7a、7k纯品的HPCE迁移谱图
Fig.3HPCE spectra of pure compounds 7g, 7a and 7k
化合物7a、7g和7k对DHFR的IC50见表2。抑制剂的抑制率用以下公式计算:
其中:R为抑制剂对DHFR的抑制率;A为对照组扣除空白后DHF与THF峰面积的差值;B为加入抑制剂扣除空白后DHF与THF峰面积的差值。将化合物7a、7g和7k的标准溶液稀释为不同浓度,在酶反应体系中进行HPCE,以抑制率R对抑制剂浓度作标准曲线,从所得线性方程中可求得IC50。
表2化合物7a、7g、7k对DHFR的抑制效果(n=5)
Tab.2Inhibitory effects of compounds 7a, 7g and 7k (n=5)
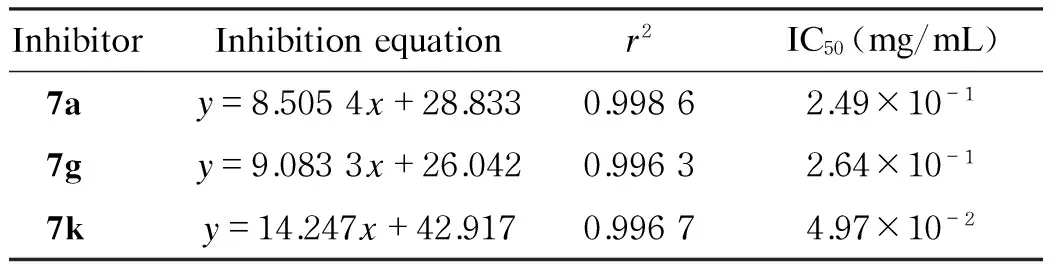
InhibitorInhibitionequationr2IC50(mg/mL) 7ay=8.5054x+28.8330.99862.49×10-1 7gy=9.0833x+26.0420.99632.64×10-1 7ky=14.247x+42.9170.99674.97×10-2
x, inhibitor concentration;y, inhibition rate (%).
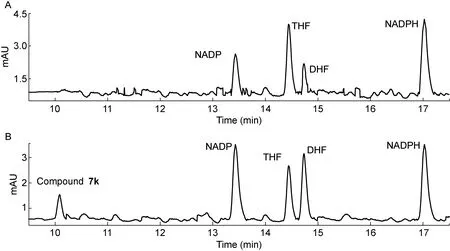
A: Before addition of compound 7k as DHFR inhibitor. B: After addition of compound 7k as DHFR inhibitor.
图4DHFR酶反应体系的HPCE迁移谱图
Fig.4HPCE spectra of DHFR reaction system
3讨论
在分子对接理论预测中,为简便起见,仅以SMX为阳性对照,因为在TMP-SMX中SMX是DHFR底物。计算结果显示,15种有哌嗪二硫代甲酸酯侧链的喹唑啉衍生物7a~7o与DHFR的结合能均优于阳性对照,化合物7i和7l的结合能为-8.2,效果最佳;化合物7k的结合能为-8.0,仅次于化合物7i和7l。图2以化合物7k为例显示了底物与酶对接后的结合情况。需说明的是,计算过程涉及多个参数的选取,不能排除人为因素;且DHFR蛋白结构为晶体X-衍射(X-ray)数据,不能完全反映在体内体液环境中底物与酶的真实结合情况。因此,分子对接作为理论预测仅可作为参考,实际抑菌活性仍需通过实验进行考察。
大肠埃希菌ST171为多重耐药菌,对包括复方新诺明在内的多种抗生素具有耐药性,在本研究的MIC值测定中得以显现。15种带有哌嗪二硫代甲酸酯侧链的喹唑啉衍生物7a~7o对大肠埃希菌ST171均具有抑菌作用,MIC为0.125~15.6 mg/mL。其中,化合物7k的MIC值最佳,达到0.125 mg/mL,表明其具有较明显的抑菌活性,有望成为新型喹唑啉类抑菌药物的先导化合物。这一结果还较好印证了以前的分子对接预测结果,具有一定的相关性。综合分子对接预测与MIC值的测定结果,可对该系列化合物抑菌活性的构效关系进行简单探讨。结果发现,哌嗪4位苯基上2位连有吸电子基团的化合物,如化合物7a和7f具有较强的活性;而哌嗪4位连有苄基的7k有非常好的抑菌活性,可能与底物与酶的结合臂长度(键长)及是否可在空间上灵活旋转有关。
MIC检测为在细菌细胞水平进行的抑菌活性筛选实验,是基于化合物与细菌菌体之间的作用进行药物筛选的方法,能反映药物对细菌生长等过程的综合作用,但不能反映药物作用的具体途径和靶点。因此,为证实该系列化合物通过抑制DHFR活性从而抑制细菌生长,选择3种MIC值最佳的化合物(7a、7g和7k)在分子水平进一步考察对DHFR的抑制率和IC50。由于DHF不稳定,在试剂存放过程中不可避免有一定量的DHF转化为THF,为避免扣除空白等繁琐的计算环节,以THF与DHF峰面积的差值来探讨抑制效果,5次平行实验的相对标准偏差为3.4%。由测定结果可知,化合物7a、7g和7k均可有效抑制DHFR的还原活性,3种化合物的IC50分别为2.49×10-1、2.64×10-1和4.97×10-2mg/mL。
综上所述,本研究考察了一系列连有哌嗪二硫代甲酸酯侧链的喹唑啉衍生物的抑菌活性。通过分子对接模拟及该系列15种化合物对多重耐药大肠埃希菌MIC的检测,发现理论预测值与实际MIC值在一定程度上吻合。初步筛选实验结果表明,该系列所有化合物与阳性对照相比均具有较好的抑菌活性,其中化合物7a、7g和7k表现出较强的抑菌活性。进一步采用HPCE筛选模型对化合物7a、7g和7k进行分子水平抑菌实验,分别测定这3种化合物的抑制率与IC50,结果显示抑制效果均较好。这一研究结果有望为抑菌药物的研究和开发提供活性更强、选择性更佳的先导化合物。
参考文献
Wolfenden R, Snider MJ. The depth of chemical time and the power of enzymes as catalysts [J]. Acc Chem Res, 2001, 34(12): 938-945.
[2]Fierke CA, Johnson KA, Benkovic SJ. Construction and evaluation of the kinetic scheme associated with dihydrofolate reductase from Escherichia coli [J]. Biochemistry, 1987, 26(13): 4085-4092.
[3]Ulrich CM, Neuhouser M, Liu AY, Boynton A, Gregory JF 3rd, Shane B, James SJ, Reed MC, Nijhout HF. Mathematical modeling of folate metabolism: predicted effects of genetic polymorphisms on mechanisms and biomarkers relevant to carcinogenesis [J]. Cancer Epidemiol Biomarkers Prev, 2008, 17(7): 1822-1831.
[4]Anderson DD, Quintero CM, Stover PJ. Identification of a de novo thymidylate biosynthesis pathway in mammalian mitochondria [J]. Proc Natl Acad Sci USA, 2011, 108(37): 15163-15168.
[5]Liu CT, Hanoian P, French JB, Pringle TH, Hammes-Schiffer S, Benkovic SJ. Functional significance of evolving protein sequence in dihydrofolate reductase from bacteria to humans [J]. Proc Natl Acad Sci USA, 2013, 110(25): 10159-10164.
[6]Reeve SM, Gainza P, Frey KM, Georgiev I, Donald BR, Anderson AC. Protein design algorithms predict viable resistance to an experimental antifolate [J]. Proc Natl Acad Sci USA, 2015, 112(3): 749-754.
[7]胡鹏程.二氢叶酸还原酶抑制剂选择与酶固定化[D].长春:吉林农业大学,2014.
[8]安会梅,朱若华.荧光光度法二氢叶酸还原酶抑制剂筛选模型的建立和应用 [J].分析科学学报,2007,23(1):79-81.
[9]Hashimoto Y, Shiotani T, Weber G. Simple separation of tritiated water and [3H]deoxyuridine from [5-3H]deoxyuridine 5′-monophosphate in the thymidylate synthase assay [J]. Anal Biochem, 1987, 167(2): 340-346.
[10]栗娜,张馨月,朱若华.毛细管电泳测定鸡肝二氢叶酸还原酶活力及其抑制剂的抑制率 [J].分析科学学报,2008,24(6):631-635.
[11]Poe M, Greenfield NJ, Hirshfield JM, Williams MN, Hoogsteen K. Dihydrofolate reductase. Purification and characterization of the enzyme from an amethopterin-resistant mutant of Escherichia coli [J]. Biochemistry, 1972, 11(6): 1023-1030.
[12]王晓倩,赵新颖,屈锋,胡猷浩,龚芮,魏强.2014年毛细管电泳技术年度回顾 [J].色谱,2015,33(1):4-9.
[13]贾蕊,栗娜,朱若华.二氢叶酸还原酶抑制剂的高效毛细管电泳法筛选模型的建立与应用 [J].色谱,2007,25(2):189-192.
[14]Ghorab MM, Abdel-Gawad SM, El-Gaby MS. Synthesis and evaluation of some new fluorinated hydroquinazoline derivatives as antifungal agents [J]. IL Farmaco, 2000, 55(4): 249-255.
[15]Dawson WAJM, Bateman GL. Sensitivity of fungi from cereal roots to fluquinconazole and their suppressiveness towards take-all on plants with or without fluquinconazole seed treatment in a controlled environment [J]. Plant Pathol, 2000, 49(4): 477-486.
[16]Shalaby AA, El-Khamry AM, Shiba SA, Ahmed AA, Hanafi AA. Synthesis and antifungal activity of some new quinazoline and benzoxazinone derivatives [J]. Arch Pharm (Weinheim), 2000, 333(11): 365-372.
[17]黄君珉,陈茹玉.α-硫羰基膦酸衍生化喹唑啉酮含磷类似物的研究 [J].高等学校化学学报,2000,21(8):1216-1220.
[18]丁明武,杨尚君,陈云峰.2-烷氧基-3H-喹唑啉-4-酮的合成与杀菌活性 [J].有机化学,2004,24(8):923-926.
[19]刘刚,宋宝安,桑维钧,杨松,金林红,丁雄.N-取代芳环-4-氨基喹唑啉类化合物的合成及生物活性研究 [J].有机化学,2004,23(10):1296-1299.
[20]Ryu CK, Shim JY, Yi YJ, Choi IH, Chae MJ, Han JY, Jung OJ. Synthesis and antifungal activity of 5, 8-quinazolinedione derivatives modified at positions 6 and 7 [J]. Arch Pharm Res, 2004, 27(10): 990-996.
[21]刘进前,徐小岗,陈秀华,余爱珍,戴祖瑞,张秀平.2,4-二氨基-5-氯-6-取代苄氨基喹唑啉类化合物的合成及其抗疟、抗肿瘤和抗菌活性 [J].药学学报,1991,26(11):821-828.
[22]Bedi PM, Kumar V, Mahajan MP. Synthesis and biological activity of novel antibacterial quinazolines [J]. Bioorg Med Chem Lett, 2004, 14(20): 5211-5213.
[23]Cao SL, Feng YP, Jiang YY, Liu SY, Ding GY, Li RT. Synthesis and in vitro antitumor activity of 4(3H)-quinazolinone derivatives with dithiocarbamate side chains [J]. Bioorg Med Chem Lett, 2005, 15(7): 1915-1917.
[24]Cao SL, Feng YP, Zheng XL, Jiang YY, Zhang M, Wang Y, Xu M. Synthesis of substituted benzylamino- and heterocyclylmethylamino carbodithioate derivatives of 4-(3H)-quinazolinone and their cytotoxic activity [J]. Arch Pharm (Weinheim), 2006, 339(5): 250-254.
[25]Cao SL, Wang Y, Zhu L, Liao J, Guo YW, Chen LL, Liu HQ, Xu X. Synthesis and cytotoxic activity of N-((2-methyl-4(3H)-quinazolinon-6-yl)methyl)dithiocarbamates [J]. Eur J Med Chem, 2010, 45(9): 3850-3857.
[26]Cao SL, Han Y, Yuan CZ, Wang Y, Xiahou ZK, Liao J, Gao RT, Mao BB, Zhao BL, Li ZF, Xu X. Synthesis and antiproliferative activity of 4-substituted-piperazine-1-carbodithioate derivatives of 2,4-diaminoquinazoline [J]. Eur J Med Chem, 2013, 64(6): 401-409.
[27]Cockerill FR. Performance standards for antimicrobial susceptibility testing: twenty-third informational supplement [M]. Pennsylvania: Clinical and Laboratory Standards Institute, 2013.
[28]Jarosinski PF, Kennedy PE, Gallelli JF. Stability of concentrated trimethoprim-sulfamethoxazole admixtures [J]. Am J Hosp Pharm, 1989, 46(4): 732-737.[29]Hillcoat BL, Nixon PF, Blakley RL. Effect of substrate decomposition on the spectrophotometric assay of dihydrofolate reductase [J]. Anal Biochem, 1967, 21(2): 178-189.
[30]张馨月,朱若华.毛细管电泳法研究中草药有效成分对二氢叶酸还原酶的抑制作用 [J].分析试验室,2009,28(7):91-95.
[31]吴嘉炜,范映辛,静国忠,周筠梅. 中华仓鼠二氢叶酸还原酶的酶学性质研究 [J].生物物理学报,1997,13(1):11-18.
Antibacterial activity of piperazine-1-carbodithioate derivatives of 2,4-diaminoquinazoline
SHAN Keming1, LI Tianyi2, PU Ji2,3
1. Planning and Research Institute, China North Industries Group Corporation, Beijing 100053, China; 2. State Key Laboratory for Infectious Disease Prevention and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China; 3. Collaborative Innovation Center for Diagnosis and Treatment of Infectious Diseases, Hangzhou 310003, China
Abstract:Antibacterial activity of fifteen piperazine-1-carbodithioate derivatives of 2,4-diaminoquinazoline was investigated in order to search for compounds with efficient antibacterial activity. First, the binding energies of substrate-enzyme were predicted by molecular docking calculation. Second, minimum inhibitory concentration (MIC) values of the tested compounds were measured against the multidrug-resistant Escherichia coli (E. coli) with a standard method. The results showed that some compounds had better antibacterial activity than the control, and MIC of compounds 7a, 7g and 7k was below 1 mg/mL. The results were further confirmed by high performance capillary electrophoresis (HPCE) screening method, and the half inhibitory concentration (IC50) of 7k was 4.97×10-2mg/mL. In addition, structure-activity relationship analysis showed that the presence of an electron-withdrawing group at the C2-position of phenyl ring linked with piperazine moiety was favorable to the antibacterial activity. This study provided a new option for the development of antimicrobial agents.
Key words:2,4-Diaminoquinazoline; Piperazine-1-carbodithioate; Antibacterial activity; Antifolate; Capillary electrophoresis
基金项目:国家自然科学基金(81471919)
通信作者:濮吉
Corresponding author. PU Ji, E-mail: puji@icdc.cn
(收稿日期:2016-02-24)

