短期空气污染物暴露与代谢综合征患者内皮功能相关性分析
阮燕萍,张磊,廉慧,蔡天骐,赵肖奕,孙王乐贤,严健华,梁瑞娟,张元勋,刘啸乐,孔德慧,Qinghua Sun,Sanjay Rajagopalan,曹阳,程康安,范中杰
短期空气污染物暴露与代谢综合征患者内皮功能相关性分析
阮燕萍1,张磊2,廉慧1,蔡天骐3,赵肖奕1,孙王乐贤4,严健华5,梁瑞娟6,张元勋7,刘啸乐1,孔德慧1,Qinghua Sun8,Sanjay Rajagopalan8,曹阳9,程康安1,范中杰1
目的 评估代谢综合征患者空气污染与内皮功能的相关性。方法 纳入2013年1月~2013年7月在北京协和医院心血管内科门诊就诊的代谢综合征患者61例,平均年龄62.41±9.12岁,对所有受试者采用Endopat2000进行充血反应指数(RHI)的内皮功能测定。获取所有受试者居住详细地址信息及其经纬度和北京市同时期35个空气质量监测点的空气污染物数据,通过ArcGIS10.0软件将北京市网格化(分辨率为0.05°,≈5.5 km)获取受试者居住地址的污染物暴露水平作为个体化暴露水平。并从中国气象局获取同时期日平均温度、相对湿度和气压。结果 研究期间所有受试者个体化大气污染物,包括吸入直径<2.5μm或<10μm的颗粒物(PM2.5、PM10)、二氧化氮(NO2)、二氧化硫(SO2)、一氧化碳(CO)、臭氧(O3),日均浓度分别为78.2、129.6、52.9、25.0、1.2和59.1μg/m3。多元线性模型分析结果表明前15 d累积PM2.5和PM10每增加10 μg/m3,RHI分别下降0.87和0.72(P均<0.05),然而并未发现气体污染物与RHI的相关性(P>0.05)。结论 颗粒物污染与代谢综合征患者亚急性内皮功能受损相关,该机制可能部分解释空气污染所致心血管疾病发生和死亡风险的增加。
空气污染;PM2.5;代谢综合征;内皮功能
空气污染是全世界最严重的问题之一。在2012年全球疾病负担报告中指出包括空气污染、吸烟等10项危险因素导致40%以上的疾病负担,且这2项因素导致5百万的人群死亡[1]。在过去数十年中有大量证据表明短期或长期空气污染暴露与心血管死亡率增加相关[2-5]。而且,颗粒物污染也会导致心力衰竭(HF)和心肌梗死(MI)风险增加相关[6]。许多相关的病理机制亦被阐述,主要包括全身炎症反应、氧化应激、血栓形成和凝血、血压升高、异常心率变异性、内皮功能受损等[7]。
目前研究表明颗粒物污染与内皮功能受损相关,不管在健康人群还是糖尿病人群均有相似的结果[8,9]。然而,相关研究的结果存在异质性,如Brook[10]进行的研究发现不一致的结果。代谢综合征(MetS)代表一组症状,包括腹型肥胖、高血压、血脂异常和胰岛素抵抗。Mets发生在25%左右的成人[11],很大程度上增加全球疾病负担。也有研究表明Mets增加了空气污染短期暴露所致不利影响的敏感性[12,13]。本研究是一项横断面研究,旨在评估通过受试者具体地址经纬度及35个空气质量监测点数据估计相对个体化污染物暴露水平,包括直径小于2.5或10μm的颗粒物(PM2.5,PM10),二氧化氮(NO2),二氧化硫(SO2),一氧化碳(CO)和臭氧(O3),对代谢综合征患者内皮功能指标——反应性充血指数(RHI)的滞后和累积效应。
1 资料与方法
1.1 研究对象 入组2013年1月~2013年7月在北京协和医院心血管内科门诊就诊的非吸烟且居住在北京的MetS患者61例(35~75岁)。MetS患者符合国际糖尿病联盟(IDF)针对亚洲人群的诊断标准:腹型肥胖(男性腰围≥90 cm,女性腰围≥80 cm),并加上以下因素中的两项:三酰甘油(TG)≥ 150 mg/dL(1.7 mmol/L),高密度脂蛋白胆固醇(HDL-C)<40 mg/dL(1.03 mmol/ L)(男性),<50 mg/dL(1.29 mmol/L)(女性),或者接受降脂治疗中;收缩压(SBP)≥130或舒张压(DBP)≥ 85 mmHg(1 mm Hg=0.133 kPa),或接受降压治疗中;空腹血糖(FBG)≥100 mg/dL(5.6 mmol/L)或之前诊断2型糖尿病(T2DM),包括空腹血糖受损或糖耐量异常。排除标准包括:主动吸烟超过1年、每日被动吸烟超过1 h、职业暴露、使用可能改变内皮功能的药物(如抗氧化剂、维生素、叶酸、鱼油、L-精氨酸)。根据中国人群2002年吸烟和被动吸烟的现状调查,被动吸烟者定义为每周至少1 d内有15 min以上暴露于吸烟者呼出的烟雾中。所有入组患者均签署知情同意书,研究方案也经北京协和医院伦理委员会批准。
1.2 受试者资料获取 所有入组受试者均需完成调查问卷,包括居住具体地址、饮食摄入、运动锻炼、心血管疾病家族史、社会经济学地位(如工资水平、教育)。另外,记录基线人口测量学特征[体重、体质指数(BMI)、腰围]、血压和心率。留取空腹8 h静脉血测量以下生化指标:血糖、糖化血红蛋白(HbA1c)、总胆固醇(TC)、TG、HDL-C、低密度脂蛋白胆固醇(LDL-C)、尿素氮(BUN)和肌酐(Cr)。通过CKD-EPI公式计算估算肾小球滤过率(eGFR),小于60 ml/(min·1.73m2)定义为慢性肾脏病3期(CKD3)。所有患者使用EndoPat2000(Itamar Medical;38900, Caesarea,Israel;http://www.itamar-medical.com)测量RHI来评估内皮功能,RHI反映阻塞动脉5 min后血管反应性充血的程度,代表了微血管内皮功能受损的程度。RHI≤1.67代表血管功能障碍。
1.3 污染物和气象资料 北京市共有35个空气质量监测点(图1),主要分布在城六区,包括东城区、西城区、朝阳区、海淀区、丰台区和石景山区。从北京市环境监测中心获取2013年1月1日~2013年7月4日日均PM2.5,NO2,SO2,CO和PM10浓度、8 h平均O3浓度。根据患者居住地址在Google地图上获取相对应的经度和纬度。根据每位患者的具体地址经纬度和35个监测点污染物浓度使用ArcGIS10.1的克里金差值法以分辨率0.05°(≈5.5 km)获取网格化浓度作为个体暴露的水平。在空间水平上颗粒物浓度的预测已经使用以下两种方法尝试多次,包括地面水平以监测点为基础的估计,如土地利用回归模型(land use regression,LUR)[14],地质统计学插值法[15],另一类是卫星为基础(无地面监测点)的估计,如遥感技术[16]。Lee[17]发现对于美国大多数居住区域,对于100 km以内,地质统计学插值法比遥感技术能够产生更准确的估计值。因此我们采用克里金插值法来进行受试者居住地址大气污染物暴露水平预测,它是一种地质统计学插值技术,考虑到已知的数据点间的距离和差异的程度来估计未知区域的数值。网格化的估计值是根据已知数值的加权线性组合来评估的。另外,从中国气象局获得同期温度、相对湿度和气压日均数值。
1.4 统计学分析 统计分析采用R软件和易侕软件进行统计分析。对人口统计学资料、血压、内皮功能和环境测量指标进行描述性分析。连续变量采用平均数±标准差(±s)及中位数(第一四分位数Q1、第三四分位数Q3),组间比较采用t检验。非连续变量采用例数(百分比)表示,组间比较采用方差分析(ANOVA)。采用Pearson相关性分析评估不同污染物及气象变量之间的相关性。多元线性回归模型评估不同暴露模式网格化污染物对RHI的效应。网格化污染物浓度的效应评估分为滞后和累积效应,滞后效应评估模式为滞后0 d、滞后1 d,滞后2 d…滞后10 d(分别代表内皮功能测量当日、前1 d、前2 d…前10 d的污染物浓度),分别以lag0、lag1、lag2…lag10表示;累积效应评估模式为内皮功能测量前1 d、前2 d…前三个月的移动平均(MA)污染物浓度,需要有75%的数据才可以计算移动平均数。我们通过比较赤池信息量准则(AIC)评估多元线性模型的拟合情况。模型中调整年龄、性别、BMI、疾病状态、药物服用情况、活动情况、内皮功能测量当日的温度、相对湿度和气压。效应估计值表示为PM10、PM2.5、SO2、NO2、O3每增加10 μg/m3或CO每增加0.1 μg/m3,内皮功能变化情况。P<0.05表示差异有统计学意义。

图1 北京市35个空气质量监测点的分布图
2 结果
2.1 研究对象基线特征 入组的代谢综合征患者的基线特征如表1所述,85%的受试者分布在东城区、西城区、朝阳区、海淀区、丰台区。共有61名受试者入组,平均年龄62岁,约54%为女性,83.4%的受试者患有高血压,25.3%患有糖尿病,77.1%患有血脂异常。多于50%的受试者服用阿司匹林、他汀类药物或钙通道阻滞剂(CCB)。表2显示心脏代谢相关的结局变量,静息血压为124/77 mmHg。受试者中有6位eGFR<60 ml/ (min×1.73 m2),其中有2位存在尿蛋白阳性。
2.2 污染物与气象数据 网格化污染物浓度和气象数据信息见表3,所有受试者结局指标测量当日的网格化PM2.5、PM10、NO2、SO2、CO和O3平均浓度为78.2、129.6、 52.9、25.0、1.2和59.1 μg/m3。污染物与气象因素的Pearson相关性分析结果表明PM2.5和CO(r=0.62,P<0.01)、PM2.5和相对湿度(r=0.71,P<0.01)、NO2和CO(r=0.62,P<0.01)、CO和相对湿度(r=0.67,P<0.01)间存在明显的正相关;NO2和SO2(r=0.33,P<0.01)、SO2和O3(r=0.34,P<0.01)、O3和温度(r=0.42,P<0.01)正相关性较小;CO和O3(r=-0.50,P<0.01)、PM2.5和O3(r=-0.41,P<0.01)、SO2和温度(r=-0.33,P<0.01)呈负相关(表4)。
2.3 网格化污染物与RHI的多元线性回归分析 多元线性回归分析结果表明网格化PM10、PM2.5与RHI呈负相关,15-day移动平均的PM2.5浓度每增加10 μg/m3,RHI下降0.87(P=0.012)(图3A)。随着PM10暴露时间延长,RHI呈下降趋势,最大效应出现在15-day移动平均PM10暴露(β=-0.72,95%CI:-1.30~-0.15,P=0.018)(图3B)。然而,并未发现气体污染物与RHI间的相关性。
3 讨论
表1 研究对象基线特征(n=61,±s )

表1 研究对象基线特征(n=61,±s )
项目 数值年龄(岁) 62.41±9.12体质指数(kg/m2) 26.01±2.82女性(n,%) 33(54.1)高血压(n,%) 51(83.6)糖尿病(n,%) 15(24.6)血脂异常(n,%) 47(77.0)被动吸烟(n,%) -无30(49.2)有31(50.8)教育程度(n,%) -大学及以上 36(59.0)高中及以下 25(41.0)家庭年收入 -≤ 40,000元 26(42.6)> 40,000元 35(57.4)服药情况(n,%) -阿司匹林 42(68.9)他汀类药物 33(54.1)钙通道阻滞剂(CCB) 31(50.8)血管紧张素受体拮抗剂(ARB) 24(39.3)β-受体阻滞剂 23(37.7)利尿剂 12(19.7)血管紧张素转换酶抑制剂(ACEI) 4(6.6)
本研究入组从2013年2月~2013年7月居住在北京市的代谢综合征患者来评估空气污染与内皮功能的相关性,采用的是网格化的污染物浓度,即根据来源于35个空气质量监测点的实测污染物浓度和受试者居住地址的经纬度,通过ArcGIS中的克里金插值法获取网格化的污染物浓度。本研究结果表明短期暴露于PM10和PM2.5与微血管内皮功能受损相关,但并没有发现气体污染物与内皮功能的负相关性。目前国际上也有一些类似的研究,其研究结果不完全一致,原因可能包括评估内皮功能的方法不同、受试者的基线特征不同。例如2011年Pope[18]进行的一项研究,包括20例健康、非吸烟、年轻成人暴露于可控制的暴露装置中,评估污染物对RHI的影响,结果表明RHI下降与之前2 d环境暴露升高相关,尤其对于女性受试者。国外报道使用血流介导的血管舒张(FMD)和硝酸甘油介导的血管舒张(NMD)来评估内皮功能,分析大气污染对内皮功能的影响。Wauters等[19]报道了急性暴露于柴油尾气能够导致健康受试者一氧化氮介导的内皮舒张功能受损,促进内皮细胞产生活性氧(ROS)。动脉粥样硬化和空气污染的多民族研究(MESA Air)[20]是一项大的多城市队列研究中,以评估长期和短期PM2.5暴露与FMD的相关性,结果表明长期PM2.5暴露每增加一个四分位间距(IQR),FMD下降0.3%,但是并未发现短期PM2.5与内皮功能的相关性。另外,在健康儿童中也发现PM10与一氧化氮水平呈负相关[21]。本研究并未观察到气体污染物与内皮功能的相关性,这也与Briet[8]的研究结果一致,这项研究得出气体污染物影响大血管内皮功能,然而颗粒物夸大了小血管对缺血的舒张反应,但具体机制尚不明确。
表2 受试者结局变量描述(n=61,±s )

表2 受试者结局变量描述(n=61,±s )
注:SBP:收缩压;DBP:舒张压;RHI:反应性充血指数;Glucose:葡萄糖;HbA1c:糖化血红蛋白;TC:总胆固醇;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;eGFR:估计的肾小球滤过率
结局变量 数值血压指标 -静息SBP(mmHg) 124.2±12.1静息DBP(mmHg) 76.6±8.1静息HR(bpm) 62.6±8.3内皮功能 -RHI 1.95±0.60生化指标 -Glucose(mmol/l) 5.89±1.42 HbA1c(%) 6.20±0.96 TC(mmol/l) 4.53±1.03 TG(mmol/l) 1.59±0.87 HDL-C(mmol/l) 1.71±3.82 LDL-C(mmol/l) 2.65±0.81 BUN(mmol/l) 5.70±1.87 Cr(mmol/l) 77.9±26.1 eGFR(CKD-EPI)[ml/(min×1.73 m2)] 85.7±21.4 eGFR<60 ml/(min×1.73 m2)(n,%) 6(9.8)eGFR≥60 ml/(min×1.73 m2)(n,%) 55(90.2)蛋白尿 -阳性(n,%) 2(3.3)阴性(n,%) 59(96.7)

表3 所有受试者结局指标测量当日的网格化污染物和气象参数的描述
本研究入组的受试者为MetS患者,MetS很大程度上加重了全球疾病负担,发生在25%的成人中[11]。它促进心血管事件和2型糖尿病发生,并增加了短期空气污染物暴露所致不良影响的敏感性。与健康受试者相比,柴油机尾气暴露导致MetS患者血液粘稠度和血小板增加[12]。而且,MetS受试者暴露于极细颗粒物导致心血管症状的发生[22]。

表4 网格化污染物、气象参数相关性分析
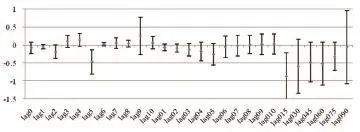
图3A PM2.5和RHI
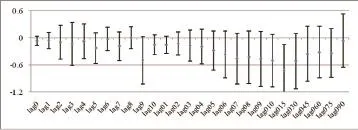
图3B PM10和RHI
在现有的研究中,污染物暴露的评估分为两组:来源于固定空气质量监测点的环境浓度和来源于便携装置记录的个体暴露浓度。前者适合大样本量的暴露评估,然而它并不能准确反映每位受试者的实际暴露浓度。后者是评估小样本人群个体暴露的一个很好选择,但是很昂贵。Brook[10]证实环境PM2.5水平与心血管终点并不相关,而个体暴露与1~2 d后血压和内皮功能的变化明显相关。究其原因可能为个体化暴露提供了相对准确的暴露评估或者较小的环境暴露的误差。当然,也可能有一些我们并不知晓的原因。在我们的研究中,根据北京35个地面实际测量的监测点和受试者所居住地址的经纬度,通过ArcGIS中的克里金插值法进行网格化,分辨率为5.5 km左右。这也是进行暴露评估相对好的一种选择,在其他研究中已有详述[17]。
本研究存在以下几个优势与局限性。首先,暴露评估的方法提供了相对合理和近似个体化的污染物暴露;其次,本研究受试者为空气污染的易感人群,代谢综合征患者,且长期居住在北京这一空气污染很严重的城市;第三,我们的研究不仅评估了短期暴露效应,还包括中期暴露效应,尽管后者并未发现相关性。本研究存在以下局限性:第一,尽管暴露方法的评估近似于个体暴露,但与便携式仪器实时监测个体所处环境的污染物评估仍有差别,还是会存在暴露评估的误差;第二,这是一项横断面研究,且没有对照组,因此本研究结果并不能解释空气污染与心血管结果之间的因果关系;第三,根据本研究的受试者为代谢综合征人群,因此无法将结论推广至其他人群。未来仍需大样本研究证实。
总之,本研究结果表明短期颗粒物暴露对MetS患者微血管内皮功能存在不利影响,该机制可能部分解释空气污染导致心血管发病和死亡增加的潜在机制。
[1] Lim SS,Vos T,Flaxman AD,et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet (London, England),2012,380(9859):2224-60.
[2] Shang Y,Sun Z,Cao J,et al. Systematic review of Chinese studies of short-term exposure to air pollution and daily mortality[J]. Environ Int, 2013,54:100-11.
[3] Beelen R,Stafoggia M,Raaschou-Nielsen O,et al. Long-term exposure to air pollution and cardiovascular mortality: an analysis of 22 European cohorts[J]. Epidemiology 2014,25(3):368-78.
[4] Lee H,Honda Y,Hashizume M,et al. Short-term exposure to fine and coarse particles and mortality: A multicity time-series study in East Asia[J]. Environ Pollut, 2015,207:43-51.
[5] Villeneuve PJ,Weichenthal SA,Crouse D,et al. Long-term Exposure to Fine Particulate Matter Air Pollution and Mortality Among Canadian Women[J]. Epidemiology,2015,26(4):536-45.
[6] Shah AS,Langrish JP,Nair H,et al. Global association of air pollution and heart failure: a systematic review and meta-analysis[J]. Lancet(London, England), 2013,382(9897):1039-48.
[7] Brook RD,Rajagopalan S,Pope CA, 3rd,et al. Particulate matter air pollution and cardiovascular disease: An update to the scientific statement from the American Heart Association[J]. Circulation 2010,121(21):2331-78.
[8] Briet M,Collin C,Laurent S,et al. Endothelial function and chronic exposure to air pollution in normal male subjects[J]. Hypertension,2007,50(5):970-6.
[9] Schneider A,Neas L,Herbst MC,et al. Endothelial dysfunction:associations with exposure to ambient fine particles in diabetic individuals[J]. Environmental health perspectives,2008,116(12):1666-74.
[10] Brook RD,Bard RL,Burnett RT,et al. Differences in blood pressure and vascular responses associated with ambient fine particulate matter exposures measured at the personal versus community level[J]. Occupational and environmental medicine, 2011,68(3):224-30.
[11] Alberti KG,Zimmet P,Shaw J. The metabolic syndrome--a new worldwide definition[J]. Lancet,2005,366(9491):1059-62.
[12] Krishnan RM,Sullivan JH,Carlsten C,et al. A randomized crossover study of inhalation of diesel exhaust, hematological indices,and endothelial markers in humans[J]. Particle and fibre toxicology,2013,10:7.
[13] Chen JC,Schwartz J. Metabolic syndrome and inflammatory responses to long-term particulate air pollutants[J]. Environmental health perspectives, 2008,116(5):612-7.
[14] Moore DK,Jerrett M,Mack WJ,et al. A land use regression model for predicting ambient fine particulate matter across Los Angeles, CA[J]. Journal of environmental monitoring, 2007,9(3):246-52.
[15] Liao D,Peuquet DJ,Duan Y,et al. GIS approaches for the estimation of residential-level ambient PM concentrations[J]. Environmental health perspectives,2006,114(9):1374-80.
[16] van Donkelaar A,Martin RV,Brauer M,et al. Global estimates of ambient fine particulate matter concentrations from satellite-based aerosol optical depth: development and application[J]. Environmental health perspectives, 2010,118(6):847-55.
[17] Lee SJ,Serre ML,van Donkelaar A,et al. Comparison of geostatistical interpolation and remote sensing techniques for estimating longterm exposure to ambient PM2.5 concentrations across the continental United States[J]. Environmental health perspectives,2012,120(12):1727-32.
[18] Pope CA,3rd, Hansen JC,Kuprov R,et al. Vascular function and shortterm exposure to fine particulate air pollution[J]. J Air Waste Manag Assoc, 2011,61(8):858-63.
[19] Wauters A,Dreyfuss C,Pochet S,et al. Acute exposure to diesel exhaust impairs nitric oxide-mediated endothelial vasomotor function by increasing endothelial oxidative stress[J]. Hypertension,2013,62(2):352-8.
[20] Krishnan RM,Adar SD,Szpiro AA,et al. Vascular responses to longand short-term exposure to fine particulate matter: MESA Air (Multi-Ethnic Study of Atherosclerosis and Air Pollution)[J]. J Am Coll Cardiol, 2012,60(21):2158-66.
[21] Kelishadi R,Hashemi M,Javanmard SH,et al. Effect of particulate air pollution and passive smoking on surrogate biomarkers of endothelial dysfunction in healthy children[J]. Paediatr Int Child Health,2014,34(3):165-9.
[22] Devlin RB,Smith CB,Schmitt MT,et al. Controlled exposure of humans with metabolic syndrome to concentrated ultrafine ambient particulate matter causes cardiovascular effects[J]. Toxicol Sci,2014,140(1):61-72.
本文编辑:张灵
Short-term exposure to individual air pollutants associated with endothelial function in patients with metabolic syndrome
RUAN Yan-ping*, ZHANG Lei, LIAN Hui, CAI Tian-qi, ZHAO Xiao-yi, SUN Li-xian, YAN Jian-hua, LIANG Rui-juan, ZHANG Yuan-xun, LIU Xiao-le, KONG De-hui, SUN Qing-hua, RAJAGOPALAN Sanjay, CAO Yang, CHENG Kang-an, FAN Zhong-jie.*Department of Cardiology, Peking Union Medical College Hospital, Peking Union Medical College and Chinese Academy of Medical Sciences, Beijing, 100730, China;
Corresponding authors: CHENG Kang-an, E-mail: chengkangan@hotmail.com
Co-Corresponding authors: FAN Zhong-jie,E-mail: Fan@pumch.cn
Objective The cross-sectional study was conducted to detect the relationship of air pollutants with endothelial function. Methods There were 61 patients aged 62 years with metabolic syndrome enrolled in the study during Jan 26, 2013 to Jul 4, 2013. Endothelial function was performed by Endopat 2000 for all subjects, expressed as reactive hyperemia index (RHI). The detailed residential addresses have been obtained, which were used to model the individual concentration of the air pollutants by ArcGIS10.1 software based on the data of air pollutants from 35 fixed monitoring sites in Beijing, China. In addition, we got meteorological data from the China Meteorological Administration for the whole study period. Results The mean of individual air pollutants for all subjects was 78.2 μg/ m3for PM2.5, 129.6 μg/m3for PM10, 52.9 μg/m3for nitrogen dioxide (NO2), 25.0 μg/m3for sulfur dioxide (SO2), 1.2 μg/m3 for nitric oxide (CO) and 59.1 μg/m3for ozone (O3) during Feb 2, 2013 to Jul 4, 2013. Multiple linear analysis has shown that decrease by 0.87 and 0.72 in RHI were associated with each 10μg/m3increase in PM2.5and PM10for 15-day moving average (all P<0.05). No significant association was found RHI and gaseous air pollutants (all P>0.05). Conclusion Particulate air pollutants were associated with sub-acute impaired endothelial function in patients with metabolic syndrome. The way could, in part, account for the increases in cardiovascular disease morbidity and mortality seen in prior studies.
Air pollution; PM2.5; Endothelial function; Metabolic syndrome
R589.2
A
1674-4055(2016)07-0792-05
北京市首都特色(Z131107002213176)、国家公益性行业基金(2015009062)、首都发展基金重点攻关项目(首发2014-1-4016)、国家自然科学基金(41450006)、美国国立卫生研究院NIH-R01(ES019616-01)
1100730 北京,中国医学科学院北京协和医学院北京协和医院心血管内科;2100043 北京,北京军区总医院京西医院保健科;3100049 北京,中国科学院大学资源与环境学院,中丹教育研究中心;4067000 承德,承德医学院附属医院心血管内科;5200092 上海,上海交通大学附属新华医院心血管内科;6518020 深圳,深圳市人民医院心血管内科;7100049 北京,中国科学院大学资源与环境学院;8Columbus,OH,USA,Davis Heart and Lung Research Institute, Ohio State University College of Medicine;9Unit of Biostatistics, Institute of Environmental Medicine, Karolinska Institutet, 17177 Stockholm, Sweden.
程康安,E-mail:chengkangan@hotmail.com
共同通讯作者:范中杰,E-mail:fan@pumch.cn
10.3969/j.issn.1674-4055.2016.07.06

