替米沙坦和氨氯地平对乳鼠心肌成纤维细胞增殖的影响
马香芹,张琨,赵娜,赵汴霞,李宁宁,卢泽恺,杨红梅
• 论著 •
替米沙坦和氨氯地平对乳鼠心肌成纤维细胞增殖的影响
马香芹1,张琨1,赵娜1,赵汴霞1,李宁宁1,卢泽恺1,杨红梅1
目的 探讨替米沙坦联合氨氯地平对血管紧张素Ⅱ(AngⅡ)诱导的乳鼠心肌成纤维细胞增殖及细胞中转化生长因子-β1(TGF-β1)及ROS的影响。方法 对Wistar乳鼠心肌成纤维细胞行体外原代及传代培养,将培养好的细胞分为5组:对照组(加入15%小牛血清DEME培养液)、AngⅡ组(15%小牛血清DEME培养液+1×10-6mol/L AngⅡ),替米沙坦组(TE组,在AngⅡ组基础上加入10μmol/L替米沙坦),氨氯地平组(AM组,AngⅡ组基础上加入1μmol/L氨氯地平)及替米沙坦+氨氯地平组(TE+AM组,在AngⅡ组基础上加入10μmol/L替米沙坦+1μmol/L氨氯地平)。倒置显微镜下观察各组细胞不同时期增殖情况及TGF-β1(免疫荧光法测定)、ROS(荧光探针DCFH-DA分析)情况。结果 与对照组相比,AngⅡ组心肌成纤维细胞在S期时增殖率较高,而在G0/G1期、G2/M期时增殖率下降(P<0.05),TGF-β1、ROS水平显著升高(P<0.05)。与AngⅡ组相比,TE组、AM组及TE+AM组心肌成纤维细胞在S期时增殖率显著下降,而在G0/G1期、G2/M期时增殖率升高(P<0.05),TGF-β1、ROS水平下降(P<0.05)。TE+AM组与TE组、AM组相比心肌成纤维细胞在S期时增殖率下降,在G0/G1期、G2/M期时增殖率升高更明显(P<0.05),心肌成纤维细胞中TGF-β1水平低于TE组、AM组(P <0.05)。结论 替米沙坦联合氨氯地平能有效抑制AngⅡ诱导心肌成纤维细胞增殖,其可能机制与抑制TGF-β1过度表达及ROS过度生成有关。
替米沙坦;氨氯地平;血管紧张素Ⅱ;乳鼠;心肌成纤维细胞
心肌成纤维是心肌功能衰退的重要表现,与心源性猝死、心力衰竭及心律失常等多种终末期心脏病发生有密切的关系[1]。成纤维细胞是构成心肌间质细胞重要的细胞,其活化是心肌纤维化发生的重要诱因,而在这过程中血管紧张素Ⅱ(Ang Ⅱ)起重要作用,Ang Ⅱ可刺激心肌胶原合成,促使成纤维细胞增殖,介导心肌纤维化[2]。近年有研究指出[3],转化生长因子-β1(TGF-β1)异常表达是引起心肌纤维化的重要作用通路,在心肌纤维化中起重要作用。替米沙坦属于Ang Ⅱ受体拮抗剂,能有效预防心肌纤维化,氨氯地平属于长效降压药,可有效舒张血管,改善心肌供血并抑制心肌纤维化[4]。本课题组在前期的研究中提出替米沙坦和氨氯地平均能有效的改善高血压左室重构,二者联用效果更明显,实现从整体动物水平掌握替米沙坦和氨氯地平联用能更有效的改善高血压左室重构的效果。因此,本项目从细胞的角度继续深入,围绕替米沙坦和氨氯地平单用与联用对乳鼠心肌成纤维细胞增殖影响的研究展开是可行的,现报道如下。
1 资料与方法
1.1 实验材料
1.1.1 实验动物 新生1~3 d Wistar 大鼠,雌雄不拘,由河南省实验动物中心提供。
1.1.2 实验试剂 新生胎牛血清(北京雅安达生物技术有限公司);DEME培养液(美国Sigma公司);AngⅡ试剂(北京方程生物科技有限公司);胰蛋白酶消化液(北京索莱宝科技有限公司);双抗(青霉素+链霉素);Ⅰ型胶原蛋白试剂盒(卡迈舒(上海)生物科技有限公司);Ⅲ型胶原蛋白试剂盒(卡迈舒(上海)生物科技有限公司);TGF-β1(美国 HyClone 公司);替米沙坦(生产日期:H201502036;北京万生药业有限责任公司);氨氯地平(批号:H201509123;苏州第壹制药有限公司)。
1.1.3 实验仪器 光学显微镜(型号:DMLPMP30;日本RICOH公司);微量移液器(20 μl、200 μl、1000 μl)购自DragonMed公司;台式微量离心机(型号H1650-W;美国Sigma公司);高速冷冻离心机(型号:A1330103;美国Beckman公司);台式低温高速离心机(型号:TD-35M/TD35;德国Hettich公司);CO2培养箱(型号:MCO-20AIC;德国Heraeus公司);电子天平(BP211D型;Sartorius公司);酶联免疫检测仪(型号:DG-3022型,国营华东电子管厂产品);流式细胞仪(规格型号:1401-X-20R;贝克曼库尔特有限公司)。
1.2 方法
1.2.1 心肌成纤维细胞的培养 在无菌操作条件下取30只Wistar乳鼠,将其左心室取出并剪碎成1 mm3大小,应用PBS缓冲液反复冲洗3次,依次加入0.01% Ⅱ型胶原酶、0.08%胰蛋白酶消化10 min,反复消化直至组织块消失。收集悬浮液离心过滤后留取沉淀物,并置于37℃ CO2培养箱中恒温培养。由于成纤维细胞与心肌细胞生长时间不同,采用差速贴壁2 h获得心肌成纤维细胞,待细胞生长至满瓶后应用0.25%胰酶消化传代培养,培养2~3代后收集成纤维细胞。
1.2.2 心肌成纤维细胞鉴定 将传代成纤维细胞接种至玻片中,待细胞爬满玻片后,将玻片取出,采用PBS缓冲液冲洗3遍,室温下加入4%多聚甲醛固定,于恒温水浴箱中孵育30 min,采用三羊血清封闭,室温下以1:50加入鼠抗波形蛋白抗体工作液恒温孵育3 h,依次加入经生物素标记山羊抗小鼠白免疫球蛋及辣根酶标记链酶卵白素工作液于室温孵育。应用二氨基联苯胺(DAB)显色剂显色,PBS缓冲液冲洗,经苏木素复染,酒精梯度脱水,中性树脂封固,并于倒置显微镜下观察心肌成纤维细胞形态。
1.2.3 样本分组及处理 对照组(加入15%小牛血清DEME培养液)、AngⅡ组(15%小牛血清DEME培养液+1×10-6mol/L AngⅡ),替米沙坦组(TE组,在AngⅡ组基础上加入10 μmol/L替米沙坦),氨氯地平组(AM组,AngⅡ组基础上加入1 μmol/L氨氯地平)及替米沙坦+氨氯地平组(TE+AM组),在AngⅡ组基础上加入10 μmol/L替米沙坦+1 μmol/L氨氯地平),每组3份。
1.2.4 心肌成纤维细胞增长率测定 预处理各组细胞,应用流式细胞仪测定各组在G0/G1期、S期、G2/M期细胞悬浮液,测定前以70%酒精固定细胞,加入500 μl碘化丙啶综合染色,加蒸馏水至100 ml,放置30 min后上机检测,重复操作3次。
1.2.5 免疫荧光法测定TGF-β1 蛋白 每组随机抽取3张已制备好的心肌组织石蜡切片,石蜡切片,酒精浓度梯度脱水,采用PBS缓冲液洗3遍,室温下加入3%H2O2,常温下孵育10 min以抑制内源性过氧化物酶活性,PBS缓冲液冲洗3遍,明火低温加热8 min,待水温下降至室温后采用PBS缓冲液洗涤3次,依次加入10%山羊血清常温下孵育30 min,加入一抗于4 ℃孵育过夜后采用PBS缓冲液冲洗,加入荧光二抗,室温避光孵育30 min,PBS洗。样品制备完毕后于荧光分析仪下观察细胞蛋白表达情况。
1.2.6 乳鼠心肌成纤维细胞内活性氧ROS的测定 利用荧光探针DCFH-DA分析检测心肌成纤维细胞中活性氧ROS,将处于对数生长期的心肌成纤维细胞制成细胞悬液,以1×105个/ml浓度将其接种于每孔200μl的96孔板。分别在不同处理因素下作用24 h,按照试剂盒说明书完成检测。24孔板培养的心肌成纤维细胞培养48 h后,各组无血清培育12 h,以PBS溶液冲洗3次各种处理因素作用24 h后的细胞悬液,去除细胞培养液;加入DCFH-DA(终浓度为10 mmol/L),将其置于37℃细胞培养箱内孵育20 h后用无血清细胞培养液洗涤细胞3次。用荧光共聚焦显微镜观察心肌成纤维细胞内的活性氧ROS。激发波长为488 nm,发射波长为525 nm,其为观察荧光。每组均重复6次。计算每组的平均值和标准差作为该组的测量值。
1.3 统计学分析 所有数据均用SPSS 19.0进行统计分析,对数据先行正态分布检验,对于符合正态分布的计量资料以(±s)表示,采用F检验,P<0.05为差异有统计学意义。
2 结果
2.1 心肌成纤维细胞鉴定 在倒置显微镜下观察到心肌成纤维细胞胞体较大,胞浆透明,细胞成梭形,细胞核呈椭圆形,通常含2~3个核,细胞核内出现棕黄色颗粒,细胞纯度达98%(图1)。
2.2 各组心肌成纤维细胞不同细胞时期增殖情况与对照组相比,AngⅡ组心肌成纤维细胞在S期时增殖率较高,而在G0/G1期、G2/M期时增殖率下降(P<0.05),与AngⅡ组相比,TE组、AM组及TE+AM组心肌成纤维细胞在S期时增殖率显著下降,而在G0/G1期、G2/M期时增殖率升高(P <0.05),TE+AM组与TE组、AM组相比心肌成纤维细胞在S期时增殖率下降,在G0/G1期、G2/ M期时增殖率升高更明显(P<0.05)(表1)。

图1 心肌成纤维细胞鉴定[A:倒置显微镜下观察到的心肌细胞(× 200);B:倒置显微镜下观察到心肌成纤维细胞(×200)]
2.3 免疫荧光法检测TGF-β1蛋白表达 与对照组比,AngⅡ组心肌成纤维细胞中TGF-β1蛋白荧光强度较强,TGF-β1水平显著升高(P<0.05);而TE组、AM组及TE+AM组心肌成纤维细胞荧光强度依次减弱(图2),与AngⅡ组相比,TE组、AM组及TE+AM组TGF-β1水平下降(P <0.05),TE+AM组心肌成纤维细胞中TGF-β1水平低于TE组、AM组(P<0.05)(表2)。
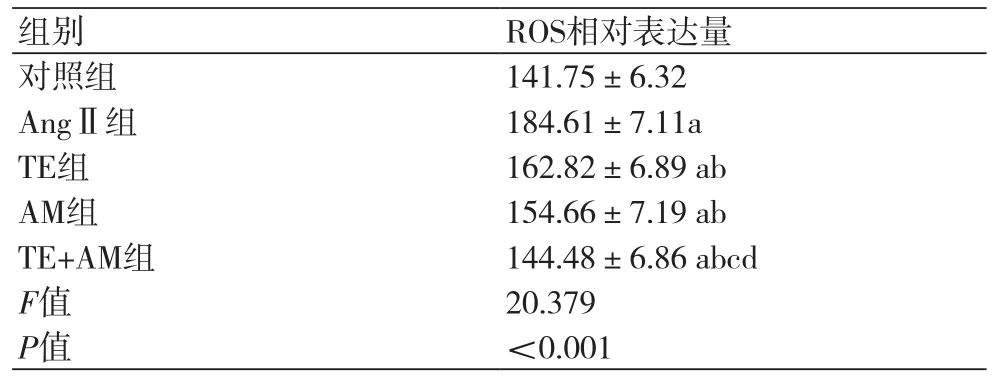
2.4 荧光共聚焦显微镜检测各组活性氧ROS水平 与对照组相比,AngⅡ组红色荧光强度最耀眼,ROS水平显著升高(P<0.05);而TE组、AM组及TE+AM组心肌成纤维细胞荧光强度依次减弱(图3),与AngⅡ组相比,TE组、AM组及TE+AM组ROS水平下降(P<0.05),其中TE+AM组心肌成纤维细胞中ROS水平低于TE组、AM组(P<0.05)(表3)。
表1 各组心肌成纤维细胞不同细胞时期增殖情况(±s,%)

表1 各组心肌成纤维细胞不同细胞时期增殖情况(±s,%)
注:与对照组相比,aP<0.05;与AngⅡ组相比,bP<0.05;与TE组相比,cP<0.05;与AM组相比,dP<0.05
组别 G0/G1期 S期 G2/M期对照组 70.23±1.28 15.33±1.20 17.33±2.12 AngⅡ组 57.22±2.45a 33.58±4.69a 9.33±2.45aTE组 62.33±3.25ab 23.22±2.48ab 12.25±1.78abAM组 62.98±3.35ab 23.69±2.38ab 12.63±1.69abTE+AM组 65.98±2.18abcd 19.33±3.14abcd 14.66±2.02abcdF值 32.123 45.963 25.126 P值 0.000 0.000 0.000

图2 免疫荧光法检测 TGF-β1 蛋白表达[A:对照组;B:AngⅡ组;C、D、E 分别为TE组、AM组及TE+AM组;图中箭头代表阳性细胞,各图右上为Anti-TGF-β1免疫荧光,右下为 DAPI 染色核定位,左侧为右上与右下重叠图]
表2 各组TGF-β1定量分析(±s)
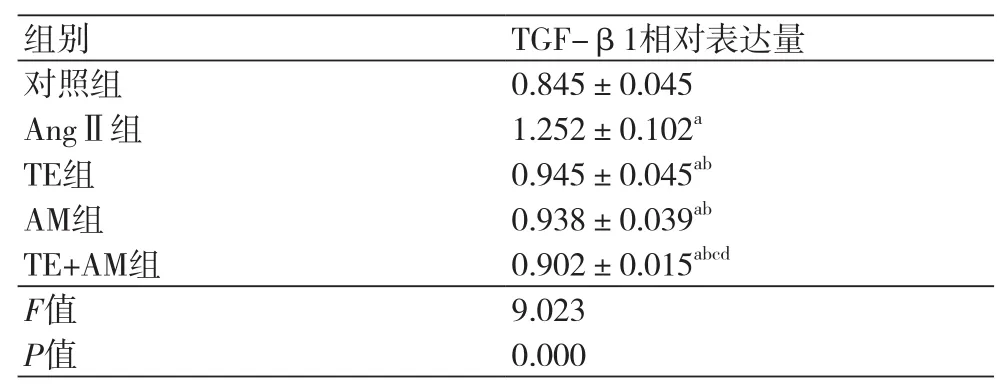
表2 各组TGF-β1定量分析(±s)
注:与对照组相比,aP<0.05;与AngⅡ组相比,bP<0.05;与TE组相比,cP<0.05;与AM组相比,dP<0.05
组别 TGF-β1相对表达量对照组 0.845±0.045 AngⅡ组 1.252±0.102aTE组 0.945±0.045abAM组 0.938±0.039abTE+AM组 0.902±0.015abcdF值 9.023 P值 0.000
3 讨论
心肌纤维化是多种心脏病恶质性病变的终末期表现,在多种血管活性物质及促纤维化因子的作用下可激活多种细胞信号通路,进而引起心肌细胞过度增殖并引起胶原蛋白沉积,增加心室僵硬度,进一步促进心肌纤维化发生[5]。有效抑制心肌成纤维细胞过度增殖对保护心肌有重要作用。

图3 荧光共聚焦显微镜检测各组活性氧ROS水平(A:对照组;B:AngⅡ组; C、D、E 分别为TE组、AM组及TE+AM组)
注:与对照组相比,aP<0.05;与AngⅡ组相比,bP<0.05;与TE组相比,cP<0.05;与AM组相比,dP<0.05
Ang Ⅱ有收缩血管作用,与Ang Ⅱ受体结合可促进基底细胞底物磷酸化,并通过酪氨酸酶途径激活丝裂霉素活化蛋白酶,促进及介导心肌成纤维化细胞增殖及转化,在心脏病终末期病变中起到重要的作用[6]。结果显示,与对照组比,AngⅡ组心肌成纤维细胞在S期时增殖率较高,而在G0/G1期、G2/M期时增殖率下降,结果与既往研究[7]一致。这提示,AngⅡ可破坏细胞外基质稳态,促进胶原蛋白沉积,诱导心肌细胞纤维化。
相关研究指出[8],TGF-β1可通过诱导纤维连接蛋白、蛋白寡糖及纤维胶原等成分从而诱导心肌细胞纤维化。本研究经免疫荧光法测定TGF-β1可知,AngⅡ组心肌组织中TGF-β1蛋白强度较对照组显著加强,结果与Wang等[9]一致。
替米沙坦是新一代非肽类AngⅡ受体拮抗剂,能与AngⅡ受体结合从而阻断肾素-血管紧张素-醛固酮系统(RAS)活性,抑制AngⅡ分泌[10]。宋占春等[11]认为,替米沙坦能有效降低心肌病大鼠炎症标志物及心肌蛋白的表达,有效降低心肌相关胶原蛋白表达,抑制心肌纤维化。氯氨地平属钙离子抑制剂,能有效改善心肌供血,降低心脏负荷,抑制心肌胶原蛋白生成及心肌纤维化[12]。
本研究应用AngⅡ干预以能够了解乳鼠心肌成纤维细胞中活性氧的变化及其可能的产生机制[13]。正常生理状态下,在乳鼠心肌成纤维细胞内活性氧生成和清除会保持低水平动态平衡,不会造成氧化应激损伤(因活性氧爆发性生成)[14]。本研究发现:与对照组相比,AngⅡ组红色荧光强度最耀眼,而TE组、AM组及TE+AM组心肌成纤维细胞荧光强度依次减弱。与对照组相比,AngⅡ组心肌成纤维细胞ROS水平显著升高(P<0.05)。与AngⅡ组相比,TE组、AM组及TE+AM组ROS水平下降(P<0.05),其中TE+AM组心肌成纤维细胞中ROS水平低于TE组、AM组(P<0.05)。可见,正常乳鼠心肌成纤维细胞活性氧水平较低,NADPH氧化酶重要的刺激因子AngⅡ能够促进乳鼠平滑肌和内皮细胞NADPH氧化酶产生活性氧,活性氧水平明显增高,能够有效的阻止氧化应激引起心室重塑。
综上所述,替米沙坦联合氨氯地平能有效抑制AngⅡ诱导心肌成纤维细胞增殖,其可能机制与抑制TGF-β1过度表达及ROS过度生成有关。
[1] 刘源,唐其柱,李利娜,等. 橙皮素对血管紧张素Ⅱ诱导的心肌成纤维细胞增殖及胶原蛋白合成的抑制作用[J]. 中华医学杂志,2014,94(36):2852-6.
[2] 阮滔,何学华,刘丽萍,等. 黄芪对心肌成纤维细胞增殖及分泌转化生长因子-β1的影响[J]. 临床儿科杂志,2015,33(3):284-6.
[3] 胡哲夫,唐其柱,刘源,等. 橙皮素对转化生长因子-β1诱导心肌成纤维细胞增殖的影响[J]. 疑难病杂志,2015,(4):376-9.
[4] 马香芹,黄显峰,卢泽恺,等. 替米沙坦联合氨氯地平对肾性高血压大鼠左室重构的对比研究[J]. 天津医药,2013,(11):1114-6.
[5] 曾翼,赵诚,王霏,等. 二苯乙烯苷对TGF-β1诱导新生大鼠心肌成纤维细胞增殖和胶原合成的影响及其机制[J]. 中国药科大学学报,2014,45(3):362-7.
[6] Lei Tao,SM,Shuai Q,et al. Extracorporeal cardiac shock wave therapy ameliorates myocardial fibrosis by decreasing the amount of fibrocytes after acute myocardial infarction in pigs[J]. Coronary artery disease,2013,24(6):78-82.
[7] Ding Y,Peng Y,Li J,et al. Gualou Xiebai Decoction prevents myocardial fibrosis by blocking TGF-beta/Smad signalling[J]. Journal of Pharmacy and Pharmacology,2013,65(9):45-8.
[8] Beaumont J,López B,Hermida N,et al. microRNA-122 down-regulation may play a role in severe myocardial fibrosis in human aortic stenosis through TGF-β1up-regulation[J].Clinical Science,2014,126 (8):96-8.
[9] Wang W,Wang B,Lu Q,et al. Inhibition of high-mobility group box 1 improves myocardial fibrosis and dysfunction in diabetic cardiomyopathy[J]. Int J Cardiol,2014,172(1):45-8.
[10] Krmer J,Niemann M,Liu D,et al. Two-dimensional speckle tracking as a non-invasive tool for identification of myocardial fibrosis in Fabry disease[J]. Euro Heart J,2013,34(21):45-8.
[11] 宋占春,白静慧,张丽莉,等. 替米沙坦对大鼠急性心肌梗死后炎症反应及纤维化的干预机制[J]. 中华医学杂志,2014,94(33):2628-33.
[12] Li M,Jiang Y,Jing W,et al. Quercetin provides greater cardioprotective effect than its glycoside derivative rutin on isoproterenol-induced cardiac fibrosis in the rat[J]. Canadian Journal of Physiology and Pharm acology,2013,91(11):120-4.
[13] Guo R,Zhou J,Deng XL,et al. Angiotensin II increases ROS production in cardiacfibroblasts by inducing p22phox over-expression[J]. Nan Fang Yi Ke Da Xue Xue Bao,2009,29(2):202-4.
[14] Fiaschi T,Magherini F,Gamberi T,et al. Hyperglycemia and angiotensin II cooperate to enhance collagen I deposition by cardiac fibroblasts through a ROS-STAT3-dependent mechanism[J]. Biochim Biophys Acta,2014,1843(11):2603-10.
本文编辑:刘璐鑫,田国祥
Effect of telmisartan and amlodipine on myocardial fibroblasts proliferation of neonatal rats
MA Xiang qin*, ZHANG Kun, ZHAO Na, ZHAO Bian-xia, LI Ning-ning, LU Ze-kai, YANG Hong-mei.*Henan Medical College, Zhengzhou, HeNan, 451191, China.
YANG Hong-mei; E-mail:wangz_75@163.com
Objective To study the influence of telmisartan and amlodipine on myocardial fibroblasts proliferation and TGF-β1and ROS of neonatal rats. Methods Cells from myocardial fibroblasts of Wistar neonatal rats were divided into 5 groups after primary culture and subculture in vitro: control group (added 15% calf serum DEME cultures), Ang Ⅱ group (added 15% calf serum DEME cultures+1×10-6mol/L AngⅡ), telmisartan group (TE group, added 10μmol/L telmisartan+1×10-6mol/L AngⅡ), amlodipine group (AM group, added 1μmol/L amlodipine+1×10-6mol/L AngⅡ) and telmisartan plus amlodipine group (TE + AM group, added 10μmol/L telmisartan+1μmol/L amlodipine+1×10-6mol/L AngⅡ). Cell proliferation in different periods (by inverted microscope), TGF-β1(by immunofluorescence method) and ROS (by Fluorescent probe DCFH-DA analysis) were observed. Results Compared with the control group, proliferation rate of Ang Ⅱ cardiac fibroblasts was higher in S phase, while proliferation rate was decreased in G0/G1 and G2/M phase (P<0.05). Level of TGF-β1and ROS were significantly increased (P<0.05). Compared with Ang Ⅱ group, proliferation rates of cardiac fibroblasts in TE group, AM group and TE + AM group were dropped significantly during S phase, while were increased in G0/G1 and G2/M phase (P<0.05). Level of TGF-β1and ROS were decreased (P<0.05). Compared with TE and AM group,proliferation rates of cardiac fibroblasts in TE + AM group was declined during S phase, but was increased more significantly in G0/G1 and G2/M phase (P<0.05). TGF-β1in myocardial fibroblasts in TE+AM group was less than that TE group and AM group (P<0.05). Conclusion Telmisartan combined with amlodipine can effectively inhibit proliferation induced by Ang Ⅱ in myocardial fibroblasts. That may be related with inhibition of TGF-β1overexpression and excessive ROS generation.
Telmisartan; Amlodipine; Angiotensin Ⅱ; Rats; Cardiac fibroblasts
R541
A
1674-4055(2016)07-0804-04
河南省2014年基础与前沿技术研究计划项目(142300410467)
1451191 郑州,河南医学高等专科学校
杨红梅,E-mail:wangz_75@163.com
10.3969/j.issn.1674-4055.2016.07.09

