心肌缺血再灌注致急性肺损伤的机制与二丁酰环磷腺苷钙的保护效应
孙泽刚,冯泽瑞,许迎春,陈保增,王云鹏
• 论著 •
心肌缺血再灌注致急性肺损伤的机制与二丁酰环磷腺苷钙的保护效应
孙泽刚1,冯泽瑞1,许迎春1,陈保增1,王云鹏1
目的 探讨心肌缺血再灌注致急性肺损伤(ALI)的机制及二丁酰环磷腺苷钙的保护效应。方法 纳入2014年7月~2015年12月于聊城市第二人民医院心内科成功行经皮冠状动脉介入治疗(PCI)的急性冠脉综合征(ACS)患者92例。随机分为对照组和观察组,每组46例。对照组患者经股/桡动脉路径进行PCI治疗,开通相关血管,恢复TIMI Ⅲ级血流;观察组在PCI术前2 d每日口服二丁酰环磷腺苷钙40 mg,术后继续应用二丁酰环磷腺苷钙40 mg 1 d后停用。比较两组患者于T1(PCI前30 min),T2 (PCI后1 h),T3(PCI后6 h),T4(PCI后12 h),T5(PCI后24 h)白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)、丙二醛(MDA)、超氧化物歧化酶(SOD)的浓度、呼吸指数(RI)、氧合指数(OI)情况。结果 与同组T1比较,对照组在T2~T4 RI升高,在T2~T5时OI降低(P<0.05),观察组各时间点RI、OI指标比较差异无统计学意义(P>0.05)。对照组在T3~T5时MDA、IL-6、IL-8浓度升高,SOD浓度降低,在T2~T5时TNF-α浓度升高(P<0.05)。观察组在T3-T4 时IL-6、IL-8浓度升高,在T2~T4时TNF-α浓度升高,在T3~T5时MDA浓度升高,SOD浓度降低(P <0.05)。与对照组比较,观察组在T2~T4时RI降低,在T2~T5时OI升高(P<0.05),在T3~T5时MDA、SOD IL-6、IL-8浓度与T2~T5时TNF-α浓度明显降低(P<0.05)。对照组患者血浆IL-6、IL-8水平与RI值呈正相关(r=0.520,0.4578,P<0.05),与OI值呈负相关(r=-0.612,-0.579,P<0.05)。结论 二丁酰环磷腺苷钙可以减轻心肌缺血再灌注所致的急性肺损伤。
心肌缺血再灌注;急性肺损伤;二丁酰环磷腺苷钙;炎性细胞因子
心肌缺血再灌注损伤不仅严重影响心脏本身的功能,而且有些患者会出现呼吸衰竭,甚至死亡,考虑与再灌注时释放的大量炎性细胞因子和氧自由基迁移与聚集诱发肺损伤有关,因此心肌缺血再灌注致急性肺损伤(ALI)的机制及其治疗是目前研究的一个热点[1]。二丁酰环磷腺苷钙(商品名:力素,上海第一生化药业)属于人体内第二信使环磷腺苷(cAMP)的衍生物,属于蛋白激酶激活剂,在体内能有效激活蛋白激酶A和蛋白激酶C,催化一氧化磷酸化反应和三羧酸循环,使机体产生大量的ATP,具有多种生物学效能,通过多方面调节作用保护肺损伤。本研究拟探讨二丁酰环磷腺苷钙对心肌缺血再灌注诱发ALI的影响及可能机制,为临床提供参考。
1 资料与方法
1.1 研究对象 入选2014年7月~2015年12月于山东省聊城市第二人民医院心内科成功行经皮冠状动脉介入治疗(PCI)的急性冠脉综合征(ACS)患者92例,随机分为对照组46例,男性25例,女性21例,平均年龄(65.3±12.6)岁;观察组46例,其中男性26例,女性20例,平均年龄(63.6 ±12.4)岁。纳入标准:符合美国心脏病学会(ACC)/美国心脏协会(AHA)ACS诊断标准危险分层中危及高危的患者,并经患者知情同意。ACC/AHA ACS危险分层中危患者:临床心绞痛发作时间少于20 min但已缓解,休息或可用硝酸酯类药物缓解:高度冠心病可能、年龄大于70岁;既往有心肌梗死、卒中病史;曾有冠状动脉旁路移植病史;以往应用阿司匹林;心电图显示T波倒置大于0.2 mV和(或)病理性Q波;0.01 ng/ml <TnT<0.1 ng/ml。高危患者:临床可见休息时心绞痛超过20 min,并进行性加重,48 h内症状加重,可见有肺水肿、可闻及心脏杂音或(和)啰音,低血压,年龄大于75岁;或者心电图显示两个相邻导联ST段压低>1 mm或新出现束支传导阻滞,或ST段抬高<1 mm,或持续性室性心动过速;在3个或更多肢体导联或者4个或更多胸导联(包括V1导联)T波深倒>3 mm,TnT>0.1 ng/ml。排除标准:①经诊断证实胸痛属于重度神经症,更年期综合征,甲状腺功能亢进症、颈椎病、胃食管反流病等所致胸痛者;②合并重度高血压、严重心肺功能不全,严重心律失常及肝、肾、造血系统等严重原发性疾病、精神病患者;③18岁以下,妊娠或哺乳期妇女;④经证实有明确的细菌、病毒感染以及其它急慢性炎症和自身免疫性疾病的患者;⑤不符合纳入标准,资料不全者。本研究经我院伦理委员会审核批准。
1.2 治疗方法 所有患者均给予规范的心血管药物治疗。对照组:经股动脉/桡动脉路径进行冠状动脉造影,明确严重狭窄或梗死相关动脉,然后选择最佳体位显示罪犯血管病变部位,通过球囊扩张及同时支架置入,开通相关血管,恢复缺血区心肌血供,患者术前口服阿司匹林300 mg及氯吡格雷300 mg,此后阿司匹林100 mg/d及氯吡格雷75 mg/d,皮下注射低分子肝素钙5000 u,1/12 h,7 d后停用。观察组:在上述治疗的基础上,术前2 d起应用二丁酰环磷腺苷钙40 mg(商品名:力素,上海第一生化药业)加入5%葡萄糖或生理盐水250 ml中静滴,1/日,术后继续应用,1 d后停用。
1.3 标本采集及指标测定 于T1(PCI前30 min),T2(PCI后1 h),T3(PCI后6 h),T4 (PCI后12 h),T5(PCI后24 h)时抽取股静脉血,采用酶联免疫吸附(ELISA)法检测白细胞介素-8(IL-8)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)。采用硫代巴比妥酸法测定丙二醛(MDA)浓度,采用黄嘌呤氧化酶法测定血浆超氧化物歧化酶(SOD)活性,试剂盒购于深圳晶美生物有限公司。同时采集股动脉血2 ml,测定血气分析,计算呼吸指数(RI)、氧合指数(OI)。公式如下:RI=PA-aO2/ PaO2=[(PB-PH2O)×FiO2-PaO2-PCO2/RQ]/PaO2;OI=PaO2/FiO2。PB=760 mmHg;PH2O=47 mmHg;RQ=0.8;PA-aO2为肺泡、动脉血氧分压差;PB为大气压,PH2O为饱和水蒸气压,FiO2(%)为吸入氧浓度;PaCO2为动脉血二氧化碳分压。呼吸空气时的FiO2取统一值为0.21。
1.4 统计学分析 采用SPSS13.0统计软件进行数据分析,计数资料采用例数(构成比)表示,组间比较采用卡方检验,计量资料以(±s)表示,组内比较采用重复测量设计的方差分析,组间比较采用t检验,IL-6、IL-8与RI、OI做Pearson相关检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较 观察组和对照组在性别、年龄、体质指数、冠心病的危险因素(糖尿病、高血压、吸烟、高血脂、卒中史),PCI的基本情况(病变数)以及服用规范西药治疗(降糖药、β受体阻滞剂、ACEI、硝酸酯类药物)上均无统计学差异(P>0.05,表1)。
2.2 血气指标比较 与T1比较:对照组在T2~T4时RI升高,在T2~T5时OI降低(P<0.05),观察组各时点RI、OI指标比较差异无统计学意义(P>0.05)。与对照组比较:观察组在T2~T4时RI降低,在T2~T5时OI升高(P<0.05,表2)。
2.3 IL-8、IL-6、TNF-α、MDA、SOD的比较 与同组内T1比较对照组在T3~T5时IL-8、IL-6、MDA浓度升高(P<0.05),SOD降低(P<0.05)。在T2~T5时TNF-α浓度升高(P<0.05)。观察组在T3-T4时IL-8、IL-6浓度升高,在T3~T5时MDA浓度升高(P<0.05),SOD降低(P<0.05)。在T2~T5时TNF-α浓度升高(P<0.05)。与同时间点对照组比较:观察组在T3~T5时IL-8、IL-6、MDA浓度及SOD活性明显降低(P<0.05)。在T2~T5时TNF-α浓度明显降低(P<0.05,表3)。
2.4 IL-8、IL-6水平与RI值和OI值的相关性 对照组患者血浆IL-8、IL-6水平与RI呈正相关(r=0.520,0.458,P<0.05),与OI值呈负相关(r=-0.612,-0.579,P<0.05)。
3 讨论
心肌缺血再灌注损伤是临床上常见的病理现象,它不仅损伤心肌本身,而且对远隔器官---肺的结构与功能产生损伤,ALI是临床上较为常见的危急重症,是由多种因子导致的血管通透性增加为主要临床表现的炎症反应综合征。研究表明,氧化应激和炎症反应是介导心肌缺血再灌注致肺损伤的重要机制[2]。氧自由基的大量产生,白细胞的渗透和炎性因子的释放等同时作用于肺部毛细血管内皮细胞,破坏了肺泡毛细血管的完整性,增加血管通透性,引起肺水肿和换气功能障碍[3,4]。
MDA是脂质过氧化反应的产物,MDA含量不仅反映机体内脂质过氧化的程度,也可以作为判断氧自由基昌盛和组织氧化应激损伤程度的重要标志,SOD是氧自由基清除剂,其活性可反映机体清除自由基的能力[5]。有研究表明,心肌缺血再灌注时,大量氧自由基的生成可导致线粒体氧化应激反应,可促进mPTP开放,线粒体跨膜电位下降,导致细胞死亡,激活的蛋白激酶C (PKC)可以通过抑制中性粒细胞在肺内聚集,降低血管壁通透性,减轻细胞线粒体的损伤,对抗氧自由基造成的肺损伤[6,7]。本研究中两组患者PCI后血浆MDA浓度升高,SOD活性降低,与对照组比较,观察组患者血浆MDA浓度降低,SOD活性升高,说明二丁酰环磷腺苷钙可通过激活PKC抑制脂质过氧化反应,清除氧自由基,对肺发挥保护作用。
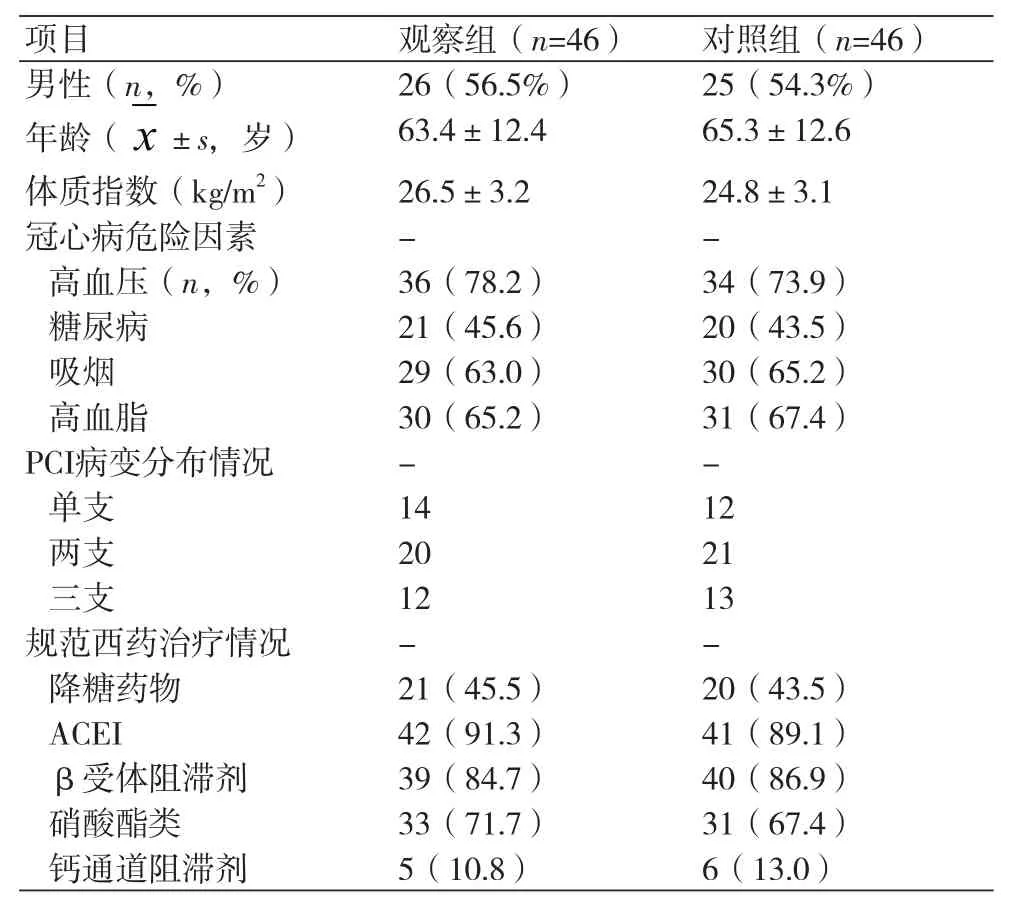
表1 两组患者基线资料的比较
表2 两组患者RI和OI的比较(n=46,±s)

表2 两组患者RI和OI的比较(n=46,±s)
注:RI:呼吸指数;OI:氧合指数;与T1比较,aP<0.05;与对照组同时间点比较,bP<0.05
指标 组别 T1 T2 T3 T4 T5 RI 对照组 0.459±0.061 0.560±0.079a 0.592±0.078a 0.537±0.078a 0.459±0.061观察组 0.449±0.069 0.485±0.094b 0.475±0.085b 0.430±0.083b 0.449±0.069 OI 对照组 399.5±31.7 289.2±33.2a 235.0±28.8a 173.1±23.7a 266.9±26.5a观察组 387.5±27.2 377.7±26.5b 342.1±36.4b 278.9±22.4b 337.8±26.3b
大量研究表明,TNF-α是应激反应产生最早并起到核心作用的促炎因子,是引起ALI的最重要的细胞因子之一,大量的中性粒细胞被TNF-α激活后,聚集于肺泡毛细血管内皮释放氧自由基、脂质代谢产物和炎症介质,形成级联放大的瀑布样连锁反应,诱导过度炎症反应的发生,损伤肺泡上皮细胞及毛细血管内皮细胞引起ALI[8]。TNF-α促进中性粒细胞呼吸暴发的同时,伴有CAMP下降,用蛋白激酶A(PKA)激活剂可明显提高中性粒细胞CAMP水平,使TNF-α诱导的呼吸暴发受到一定程度的抑制,提示PKA途径参与调节TNF-α对中性粒细胞的激活作用,其机制可能是由于CAMP能干扰NADPH氧化酶复合物的装配,后者是呼吸暴发的限速酶[9]。既往研究表明,IL-6主要由缺血再灌注诱导的活化的中性粒细胞产生,且处于炎症调控的枢纽位置,可诱发中性粒细胞释放大量弹性蛋白酶和髓过氧化酶等多种蛋白酶导致肺损伤。IL-8是一种强有力的中性粒细胞(PMN)趋化因子及激活因子,缺血再灌注(I/R)损伤可激活中性粒细胞(PMN)和内皮细胞释放大量的IL-8,进一步诱发中性粒细胞(PMN)迁移黏附和浸润加重肺损伤,说明IL-8的水平与肺损伤相关[10,11]。本研究中发现心肌缺血再灌注(I/R)后,对照组患者IL-6、IL-8及TNF-α含量显著升高,原因可能是由于I/R后由于氧化应激引起心肌细胞释放过多的的炎症因子有关。观察组I/R后IL-6、IL-8及TNF-α含量与对照组相比降低,说明二丁酰环磷腺苷钙能通过激活PKA,抑制中心粒细胞激活爆发,降低炎症因子的释放从而减轻机体的炎症反应,减轻肺损伤。
表3 两组患者各时间点IL-6、IL-8、MDA、SOD的比较(n=46,±s)

表3 两组患者各时间点IL-6、IL-8、MDA、SOD的比较(n=46,±s)
注:IL-6:白细胞介素-6;IL-8:白细胞介素-8;TNF-α:肿瘤坏死因子-α;MDA:丙二醛;SOD:超氧化物歧化酶;与同组T1比较,aP<0.05;与对照组同时间点比较,bP<0.05
指标 组别 T1 T2 T3 T4 T5 IL-6(pg/ml) 对照组 1.9±0.6 3.2±0.9 5.1±1.4a 12.7±2.1a 10.7±3.9a观察组 1.8±0.8 3.6±1.2 4.7±1.3ab 8.4±1.9ab 3.9±1.5bIL-8(pg/ml) 对照组 11.2±3.4 12.5±2.6 18.9±1.9a 25.3±5.7a 19.4±5.5a观察组 10.7±5.2 10.7±2.0 13.8±1.7ab 15.6±2.7ab 11.4±2.8bTNF-α(pg/ml) 对照组 2.5±0.5 7.7±1.3a 6.6±1.3a 6.2±1.8a 5.9±2.0a观察组 2.4±0.8 6.4±1.6ab 5.4±1.6ab 4.8±1.9ab 3.3±1.2bMDA(μmol/ml) 对照组 2.4±0.6 2.5±1.1 4.0±1.8a 4.5±1.6a 4.9±1.5a观察组 2.3±0.5 2.4±0.7 3.4±0.4ab 3.5±1.1ab 3.4±1.2abSOD(U/ml) 对照组 98±6 98±7 84±3a 76±9a 60±11a观察组 97±7 96±6 91±6ab 89±9ab 90±9ab
呼吸指数(RI)和氧合指数(OI)是准确反应肺功能的良好指标,是评价机体氧合状态的敏感指标,RI和OI的明显变化提示出现肺损伤,变化越大,说明肺功能状况越差[12]。本研究发现,对照组患者在T2~T4时刻RI明显升高,而OI在T2~T5明显降低,提示心肌缺血再灌注诱发了患者肺换气功能的降低。观察组RI在T2~T4时明显低于对照组,OI在T2~T5高于对照组(P <0.05),且组内各时间点无明显差异,显示观察组肺功能障碍较对照组轻。统计分析发现,IL-6、IL-8与RI呈正相关,与OI呈负相关,说明IL-6、IL-8可能参与了心肌缺血再灌注肺损伤,显示机体是否发生炎症反应与呼吸功能密切相关。二丁酰环磷腺苷钙可能是通过调节炎症介质表达,抑制促炎因子的释放,以提高远隔组织抗继发性缺血再灌注的能力,从而对心肌缺血再灌注所致肺损伤起到一定保护作用。
总之,本研究结果表明,心肌缺血再灌注损伤释放大量氧自由基、炎性因子伴随血流输送到相应靶器官,导致肺内氧自由基增多,炎性介质和抗炎介质等平衡失调,从而对肺造成损伤,二丁酰环磷腺苷钙通过激活蛋白激酶,抑制脂质过氧化反应和炎症反应,在一定程度上减轻心肌缺血再灌注肺损伤。当然,蛋白激酶可以通过磷酸化作用,使多种蛋白质活性发生变化,包括离子通道、受体、某些酶以及细胞骨架成分等,所以,缺血再灌注损伤的机制较为复杂,参与因素多,二丁酰环磷腺苷钙很有可能通过多个因素或途径保护器官损伤,这些还需进一步探讨研究。
[1] De Campos T,Deree J,Coimbra R. From acute pancreatitis to endorgan injury: mechanisms of acute lung injury[J].Surg Infect (Larchmt), 2007,8(1):107-20.
[2] 吕雪白,赵卉,刘忠保,等. 心肌缺血/再灌注损伤后的肺组织损伤[J]. 中国心血管病研究,2011,4(10):295-8.
[3] Weng TI,Wu TY,Chen BL,et al. CEBP homologous protein deficiency aggravates acute pancreatitis and associated lung injury[J]. World J Gastroenterol,2013,19(14):7097-105.
[4] Wang L,Yuan R,Yao C,et al. Effects of resolving DI on inflammatory response and oxidative stress of lipopolysaccha ride induced acute Lung injury in mice[J]. Chin Med J(Engl),2014,127(5):803-9.
[5] 郝楠楠,雷志礼,陈晖. 右美托咪定对大鼠肢体缺血再灌注所致急性肺损伤的影响[J]. 临床麻醉学杂志,2014,30(6):602-5.
[6] 来丽娜,张晓京,张晓一,等. 蛋白激酶C在缺血预处理减轻大鼠心肌缺血再灌注时线粒体损伤中的作用[J]. 中华麻醉学杂志,2014,34(3):359-62.
[7] 王万铁,王方岩,陈寿权,等. 左旋精氨酸对兔肺缺血再灌注损伤时蛋白激酶C基因表达的影响[J]. 中华急诊医学杂志,2006,15(12):1097-101.
[8] Yassin MM,Harkin DW,Barros DSa AA,et al. Lower limb ischemia reperfusion injury triggers a systemic inflammaory response ang multiple organ dysfunction[J]. Word J Surg,2002,26(1):115-21.
[9] 李莉,李卓娅,龚非力,等. PKA对跨模型与分泌型TNF-α诱导中性粒细胞功能的影响[J]. 华中科技大学学报(医学版),2002,31(1):1-3.
[10] 邹吉丽,尹照萍,张利群,等. 大鼠心肌缺血再灌注早期心肌及血清IL-6、TNF-α的表达[J]. 中国医科大学学报,2013,42(9):830-3.
[11] Matilla JM,Garcia Yuste M,Sanchez Crespo M,et al. Interleukin-8 expression in lung ue during ischemia-reperfusion [J]. Arch Broncon eumol,2007,43(10):542-8.
[12] Sinha PK,Neema PK,Unnikrishnan KP,et al. Effect of lung ventilation with 50% oxygen in air or nitrous oxide versus 100% oxygen on oxygenation index after cardiopulmonry[J]. J Cardiothorac Vasc Anesth,2006,20(2):136-42.
本文编辑:刘畅,田国祥
Mechanism of myocardial ischemia-reperfusion induced acute lung injury and protective effect of calcium dibutyryladenosine cyclophosphate
SUN Ze-gang*, FENG Ze-rui, XU Ying-chun, CHEN Bao-zeng, WANG Yun-peng.*The Second People's Hospital of Liaocheng Affiliated to Taishan Medical College, Linqing 252600, China.
SUN Ze-gang, Email: sunzegang0616@126.com
Objective To investigate the mechanism of myocardial ischemia and reperfusion induced acute lung injury (ALI) and protective effect of calcium dibutyryladenosine cyclophosphate. Methods During 2014.7-2015.12, 92 acute coronary syndrome (ACS) patients treated by percutaneous coronary intervention (PCI)were randomly divided into control group [25 males, 21 females and aged (65.3±12.6) ] and treatment group [26 males, 20 females and aged (63.6±12.4) ]. The control group was given PCI, and the IR flow was restored in TIMI III grade. Each patient in treatment group used calcium dibutyryladenosine cyclophosphate 40 mg daily from 2 days before PCI to 1 day after PCI. Interleukin-6(IL-6), Interleukin-8(IL-8), tumor necrosis factor-α(TNF-α),malondialdehyde (MDA), superoxide dismutase (SOD) concentration, respiratory index (RI), oxygenation index (OI)of 30 minutes (T1), 1h(T2), 6h(T3), 12h(T4) and 24h (T5) before PCI were compared. Results Compare with T1, RI in control group was higher at T2-T4 an
was lower at T2-T5 (P<0.05), and there were no significant differences of RI and OI in Treatment group at T2-T5 (P>0.05). MDA ,IL-6 and IL-8 at T3-T5 and TNF-α at T2-T5 in control group were significantly higher. SOD in control group was lower at T3-T5 (P<0.05). IL-6 and IL-8 level at T3-T4, MDA level at T3-T5 and TNF -αlevel at T2-T4 in treatment group were significantly higher. SOD in the treatment group was lower at T3-T5 (P<0.05). Compare with control group, RI in treatment group was lower at T2-T4 and OI was higher at T2-T5 (P<0.05); MDA,SOD, IL-6, IL-8 level at T3-T5 and TNF-αlevel at T2-T5 in treatment group was significantly lower (P<0.05). IL-6, IL-8 level had positive correlation with RI (r=0.520,0.458,P<0.05), but had negative correlation with OI in control group (r=-0.612, -0.579, P<0.05). Conclusion Calcium dibutyryladenosine cyclophosphate mitigates acute lung injury induced by myocardial ischemia-reperfusion.
Myocardial ischemia-reperfusion; Acute lung injury; Calcium dibutyryladenosine cyclophosphate;Inflammatory
R542.1
A
1674-4055(2016)07-0846-04
1252600 临清,山东泰山医学院附属聊城市第二人民医院心内科
孙泽刚,E-mail:sunzegang0616@126.com
10.3969/j.issn.1674-4055.2016.07.22

