坐骨神经非冻结性冷损伤时血神经屏障损害的研究
李 浩,张 磊,徐 敏
坐骨神经非冻结性冷损伤时血神经屏障损害的研究
李浩1,张磊2,徐敏3
目的使用大鼠坐骨神经制造周围神经非冻结性冷损伤模型,观察非冻结性冷损伤时神经内部的水肿变化,研究冷损伤时血神经屏障功能的损害情况及相应的病理改变。方法48只雄性Wistar随机分成冷损伤后1 d组、3 d组和5 d组。每只大鼠一侧坐骨神经予以3 ℃~5 ℃持续低温2 h;以对侧坐骨神经作为对照。每组大鼠在相应的时间点取下坐骨神经进行观察:静脉注射伊文思蓝后1 h,测量坐骨神经中伊文思蓝浓度;静脉注射伊文思蓝后1 h,坐骨神经包埋制片,在荧光显微镜下观察伊文思蓝的分布;坐骨神经包埋制片,在光学显微镜及电子显微镜下观察有髓纤维、无髓纤维及毛细血管的状况。结果冷损伤后1 d,多数有髓纤维出现以“空、暗”为形式的轴索退变;无髓纤维和紧密连接完好;神经内膜毛细血管管腔狭窄;冷损伤后3~5 d,有髓纤维病变继续加重;神经内膜毛细血管管腔仍然狭窄,内皮细胞间的紧密连接开放;冷损伤后1 d,冷损伤侧坐骨神经中的伊文思蓝浓度与对照侧相比有显著升高;在正常的坐骨神经内,伊文思蓝红色荧光局限于神经内膜的血管腔内,未渗漏至血管外;在冷损伤后1 d,坐骨神经的一些受冷部位出现了神经内膜弥漫性红色荧光;类似荧光也出现冷损伤后3 d与5 d的坐骨神经中,但是其荧光强度有所下降。结论坐骨神经非冻结性冷损伤可以导致血神经屏障功能破坏,引起神经内膜水肿;非冻结性冷损伤早期主要选择性损害有髓纤维,而对无髓纤维损伤极轻。
非冻结性冷损伤;血神经屏障;坐骨神经;神经变性
非冻结性冷损伤是指0 ℃以上的低温潮湿环境所导致的人体组织损伤,如战壕足、浸溃足等[1]。早在古希腊的希波克拉底时代,就已经存在对非冻结性冷损伤的报道。近代以来,随着低温天气下军事战争的增多,非冻结性冷损伤的报道也逐渐增多,例如两次世界大战、朝鲜战争等[2~4]。在当今的和平年代,我国某些人群的非冻结性冷损伤发病率仍可高达8.7%[5],如新兵、登山爱好者、大海中的渔民、冬天的酗酒者、痴呆者等。2008年雪灾时,非冻结性冷损伤在宁波地区发生率为12.78%,占伤害类型的67.28%[6]。虽然非冻结性冷损伤现象已经存在了很长时间,但它对周围神经的损伤机制却依然不清楚,许多领域还有待深入研究。本研究以大鼠坐骨神经内的血神经屏障功能为研究对象,探讨非冻结性冷损伤下血神经屏障功能的损害情况。
1 材料与方法
1.1实验材料体质量300~400 g的3~4月龄SPF级成年雄性Wistar大鼠48只(北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2002-003),室内饲养温度25 ℃,相对湿度50%。制冷装置选择德国Julabo公司生产的制冷和加热循环器(F12-ED),测温装置选择优利德专业型数字测温表(UT325A)。
1.2实验方法
1.2.1坐骨神经非冻结性冷损伤模型非冻结性冷损伤模型的制作参考贾建平等人[7]的方法:用2%戊巴比妥钠以0.25 ml/100 g体质量的剂量腹腔麻醉大鼠;麻醉后大鼠俯卧位固定,在其左侧大腿根部常规备皮、消毒,于菱形窝处皮肤上作一个3 cm长切口;充分暴露坐骨神经后,将其置于已预冷的实验装置(见图1)中,使神经温度维持在3 ℃~5 ℃,持续2 h,受冷结束后直接将神经从铜槽中移出。同样暴露右侧坐骨神经,仅给予暴露坐骨神经,不给予低温处理,作为对照。造模过程中监测大鼠直肠温度、心率。术中大鼠身下用电热毯维持肛门温度在35 ℃以上。术中每20 min记录一次循环水及神经的温度。
1.2.2动物分组将48只大鼠随机分组,冷损伤后1 d组(16只):对大鼠左侧坐骨神经手术暴露后进行2 h的持续冷处理(3 ℃~5 ℃),缝合伤口后于室温下饲养24 h。冷损伤后3 d组(16只):对大鼠左侧坐骨神经手术暴露后进行2 h的持续冷处理(3 ℃~5 ℃),缝合伤口后于室温下饲养72 h。冷损伤后5 d组(16只):对大鼠左侧坐骨神经手术暴露后进行2 h的持续冷处理(3 ℃~5 ℃),缝合伤口后于室温下饲养120 h。对上述3组大鼠右侧坐骨神经手术暴露后不给予冷处理,2 h后缝合伤口,于室温下饲养相应时间作为各组的对照。
1.2.3标本取材、处理在冷损伤后的23 h,给予每组各8只大鼠静脉注射伊文思蓝溶液(1 ml伊文思蓝溶液/100 g体质量)。伊文思蓝溶液是含有1%伊文思蓝的生理盐水溶液。在注射后1 h,取下每只大鼠双侧坐骨神经,吸去多余水分后称重。坐骨神经放置于1 ml甲酰胺内50 ℃下孵育24 h。使用分光光度仪(日本岛津公司苏州市分公司生产,型号:UV-1800)对所得到蓝色溶液测量伊文思蓝吸光度,并根据标准曲线转换为其浓度,除以神经重量。同样采用上述实验方法,每组各4只大鼠的双侧坐骨神经切成5 mm长的数段,包埋于Tissue-Tek Optical Cutting Temperature Compound(美国SAKURA公司生产)中,冷冻于液氮内,储存于-80 ℃环境下。这些组织使用时制成10 μm 厚的横切片,经过甘油-生理盐水封存后在荧光显微镜(日本奥林巴斯公司东京生产,型号:CX41-32RFL)下观察伊文思蓝在神经内的分布。在冷损伤后的24 h,每组4只大鼠被麻醉后迅速取下双侧坐骨神经,按以下步骤操作:(1)2%多聚甲醛-2.5%戊二醛中4 ℃固定2 h;(2)0.1 mmol/L磷酸盐缓冲液(pH值7.4)浸泡3次,每次10 min;(3)四氧化锇固定,乙醇脱水,环氧树脂Epon812包埋;(4)制备1 μm半薄切片,甲苯胺蓝染色后光学显微镜(型号:Eclipse 50i POL;尼康公司,Melville,USA)下观察;(5)制备5 nm超薄切片,醋酸铀-枸橼酸铅染色后用透射电子显微镜(型号:EM208s;荷兰 Eindhoven市,皇家飞利浦公司)观察。
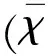
2 实验结果
2.1各组坐骨神经中伊文思蓝的浓度比较将一定量的伊文思蓝分别溶解于甲酰胺内,配制成浓度为2 μg/ml、5 μg/ml、8 μg/ml、10 μg/ml、12 μg/ml、25 μg/ml、50 μg/ml的标准溶液,使用分光光度法测定标准溶液的吸光度,绘制出标准曲线,吸光度与浓度呈线性关系(见表1、图2)。各组坐骨神经放置于甲酰胺内孵育24 h,得到蓝色溶液,使用分光光度法测量溶液吸光度,根据标准曲线将吸光度转换为浓度,并除以神经重量。结果发现:冷损伤后第3天、第5天时低温侧的伊文思蓝浓度均显著低于第1天时,而第1天时低温侧的伊文思蓝浓度显著高于对照侧(具体数据见表2)。
2.2各组坐骨神经中伊文思蓝的分布静脉注射伊文思蓝1 h 后观察作为对照的坐骨神经,发现红色荧光局限于神经内膜的血管腔内,未见有荧光渗漏至血管外。观察低温处理的坐骨神经发现:在冷损伤后第1天,大多数坐骨神经的受冷部位出现了神经内膜弥漫性红色荧光,但也有一些受冷部位始终未见荧光渗漏。类似的弥漫性荧光也出现冷损伤后第3天,第5天的坐骨神经中,但是其荧光强度明显下降(见图3)。
2.3各组大鼠坐骨神经光学显微镜下的形态比较对照侧坐骨神经仅少量有髓纤维出现空或暗轴索,伴随正常的神经内膜毛细血管。低温处理后1 d,许多有髓纤维出现以巨大、空或萎缩、暗为形式的轴索退变。由于内皮细胞肿胀,神经内膜毛细血管管腔狭窄。低温处理后3~5 d时有髓纤维显示出更加严重的以“空或萎缩、暗”为形式的轴索退变,并且神经内膜毛细血管管腔仍然狭窄(见图4)。
2.4各组大鼠坐骨神经电子显微镜下的形态比较对照侧1 d时仅少量有髓纤维轻微板层松散,无髓纤维与神经内膜血管基本正常。低温处理后1 d时,坐骨神经的有髓纤维已经出现严重病变,表现为:髓鞘板层结构松散,乃至于结构完全消失;轴索轻则微丝溶解,重则结构消失,表现为“空轴索”。无髓纤维基本正常。神经内膜血管管腔狭窄,血管内皮细胞增生,但紧密连接未见破坏,血管内未见血小板激活与红细胞淤滞。低温处理后3~5 d时,大鼠坐骨神经中有髓纤维出现更加明显的轴索退变和髓鞘分裂。内皮细胞仍然肿胀,紧密连接出现开放。直到第5天时才能发现散乱的无髓纤维退变(见图5)。

表1 伊文思蓝在甲酰胺中的吸光度-浓度标准曲线
r=0.999

表2 各组坐骨神经中伊文思蓝的浓度比较
与冷损伤后1 d相同侧比较*P<0.05;同一组内与对照侧比较#P<0.05
图1实验装置的设计[7]致冷管道(自制)由铜管组成,表面覆盖环氧树脂,做成一个中空的半圆形。在入水口和出水口之间有15 mm的间距。通过加热制冷循环器(型号:F12-ED;德国Julabo公司)驱动,使冷水不断循环通过管道,从而冷却坐骨神经。在铜管底部和神经之上可放置测温装置,用于测定制冷温度和神经实际温度,两点间温差不超过0.2 ℃

图2伊文思蓝在甲酰胺中的吸光度-浓度标准曲线
3 讨 论
在中枢神经系统内,血脑屏障使脑组织和血液隔绝,并对血液和脑组织之间的多种物质交换进行调控。当机体受到寒冷损伤时,由于氧化损伤导致血脑屏障通透性增加,血管内液体渗出,可以引起继发性脑水肿[8]。在周围神经系统内,神经组织的内环境也由相似的屏障进行维持,该屏障即称为血神经屏障,它主要由神经内膜微血管上皮细胞和神经束膜鞘构成[9]。它对许多物质都具有低通透性,可以阻止一些溶质、大分子物质、白细胞及细菌通过被动扩散方式进入周围神经组织,从而将周围神经与血液系统分隔,起到一种保护作用[10]。同时,它通过一些转运蛋白调节某些离子、营养物质及其他外源性物质出入神经组织,并通过维持钠、钾离子浓度的梯度差,调节轴索去极-复极化过程,保证神经信号正常传导[10~12]。在大部分周围神经疾病中,如热损伤、糖尿病、神经压榨伤,人们都发现了血神经屏障的破坏[13,14]。同样地,在非冻结性冷损伤中也存在血神经屏障的破坏。
人们通过对动物静脉注射多种示踪剂,并对示踪剂所浸润的组织进行化学固定来观察血-神经屏障的完整性变化。荧光类示踪剂如台盼蓝、荧光素钠及伊文思蓝等,已经被广泛应用于此类研究。我们的研究使用了一种分子量为66200 Da的荧光示踪剂-伊文思蓝。该物质可以在特殊显微镜下发出高亮度的红色荧光。在其630 nm的最大吸收值时,通过比色法可以由吸光度算出它的浓度。Olsson[15]发现在正常情况下,神经内膜血管对伊文思蓝不具备通透性。但是,当神经发生损伤,如压榨伤或切割伤时,神经内膜血管对它的通透性会增大,该物质就可以通过损伤部位的细胞间隙渗漏出去,这种现象反映了血神经屏障完整性的损害。目前,伊文思蓝已经被广泛应用于周围神经热损伤后屏障功能破坏的研究[16~18],却没有用于研究周围神经非冻结性冷损伤后屏障功能的破坏。因此,我们采用静脉注射伊文思蓝来观察非冻结性冷损伤时坐骨神经屏障功能的损害。
研究发现冷损伤后1 d时,坐骨神经某些经过低温处理的节段出现神经内膜弥漫性高亮度红色荧光。直到冷损伤后3~5 d时,这种红色荧光依然存在。它提示由于血神经屏障功能的损伤,冷损伤后1 d时神经内膜血管的通透性明显增加,伊文思蓝随着液体从血管内大量渗出至神经内膜中。而电镜发现冷损伤后3 d时,神经内膜中的血管内皮细胞间紧密连接出现开放的现象也支持血-神经屏障功能存在损伤。此外,在大型有髓纤维轴索严重退变时,无髓纤维较好地得到了保存,提示非冻结性冷损伤主要选择性破坏有髓纤维。
周围神经的冷损伤改变了神经内膜中的血管通透性,损伤了血神经屏障,导致液体渗入神经内膜,破坏其微环境,引起神经内膜水肿。这些过多的液体将会进一步挤压周围的神经束膜,使其超出正常调节范围,造成神经内膜压力的迅速上升[19],破坏内部的神经纤维。此外,神经内膜水肿也会进一步降低内部的血流量,加重神经内膜缺氧,继续破坏血神经屏障功能。但是,血神经屏障功能的损伤并非是一个简单过程,而是涉及了两个阶段:早期阶段中(冷损伤后24 h)主要由内皮细胞中的吞饮小泡转运有害物质,而后期阶段(冷损伤后3~5 d)则是有害物质通过损伤的血管内皮细胞间隙渗透进入神经内膜[20]。这就可以解释为什么第1天时已经存在液体渗出至神经内膜,电镜却没有发现内皮细胞紧密连接的开放,直到冷损伤后第3天才发现紧密连接的开放。同时发现当神经内的血流量逐渐恢复到基线状态时[7,21,22],第3天~第5天时的伊文思蓝渗出量却比第1天时明显减少,原因不是很清楚,我们认为可能是由于神经内膜中的液体压力升高,阻止了液体从微血管继续渗出至神经内膜[19]。
与我们的研究发现类似,在许多实验性周围神经疾病中也存在神经内膜血管通透性改变,但是具体过程仍然不清楚。Olsson[23,24]曾指出这种血管通透性的异常可能是由于神经内膜中的肥大细胞脱颗粒释放的血管活性胺引起。因此,冷损伤时血神经屏障的通透性增高也可能是由于血管活性胺的释放。但是,由于实验条件的限制,我们没有进行对血管活性胺的释放进行观察,这是需要继续深入研究的领域。
[1]Loseth S,Bagenholm A,Torbergsen T,et al.Peripheral neuropathy caused by severe hypothermia[J].Clinical Neurophysiology,2013,124(5):1019-1024.
[2]Smith JL,Ritchie J,Dawson J.Clinical and experimental observations on the pathology of trench frostbite[J].J Path Bact,1915,20:159-190.
[3]Ungley CC,Blackwood W.Peripheral vasoneuropathy after chilling “immersion foot and immersion hand”[J].Lancet,1942,2:447-451.
[4]Lewis RB,Moen PW.Experimental immersion leg[J].Am J Med Sci,1952,224:529-539.
[5]宋波,张涌泉.北方海岛部队新兵训练冻伤情况分析[J].白求恩军医学院学报,2008,6(6):363-364.
[6]应焱燕,朱银潮,徐荣,等.2008年宁波地区雨雪冰冻灾害所致伤害的流行病学调查[J].卫生研究,2009,38(4):463-464.
[7]Jia J,Pollock M.The pathogenesis of non-freezing cold nerve injury.Observations in the rat[J].Brain,1997,120(4):631-646.
[8]张锴,李积胜.寒冷环境对机体的影响及其机制[J].国外医学:卫生学分册,2006,33(4):212-215.
[9]Choi YK,Kim KW.Blood-neural barrier:its diversity and coordinated cell-to-cell communication[J].BMB Rep,2008,41:345-352.
[10]Yosef N,Ubogu E.An immortalized human blood-nerve barrier endothelial cell line for in vitro permeability studies[J].Cell Mol Neurobiol,2013,33:175-186.
[11]Ubogu EE.The molecular and biophysical characterization of the human blood-nerve barrier:current concepts[J].J Vasc Res,2013,50:289-303.
[12]Kusunoki S.How is the blood-nerve barrier involved in the pathogenetic mechanisms of multifocal motor neuropathy[J].J Neurol Neurosurg Psychiatry,2014,85:473.
[13]Dyck PJ,Giannini C.Pathologic alterations in the diabetic neuropathies of humans:a review[J].J Neuropathol Exp Neurol,1996,55:1181-1193.
[14]Omura K,Ohbayashi M.The recovery of blood-nerve barrier in crush nerve injury-a quantitative analysis utilizing immunohistochemistry[J].Brain Res,2004,1001:13-21.
[15]Olsson Y.Microenvironment of the peripheral nervous system under normal and pathological conditions[J].Crit Rev Neurobiol,1990,5:265-311.
[16]Kiang JG,Wei ET.Corticotropin-releasing factor inhibits thermal injury[J].J Pharmacol Exp Ther,1987,243:517-520.
[17]Berger J,Sprague SM,Wu Y,et al.Peripheral thermal injury causes early blood-brain barrier dysfunction and matrix metalloproteinase expression in rat[J].Neurol Res,2007,29:610-614.
[18]Patel TH,Sprague S,Lai Q,et al.Blood brain barrier (BBB) dysfunction associated with increased expression of tissue and urokinase plasminogen activators following peripheral thermal injury[J].Neurosci Lett,2008,444:222-226.
[19]Myers RR,Powell HC,Heckman HM.Biophysical and pathological effects of cryogenic nerve lesion[J].Ann Neurol,1981,10:478-485.
[20]Nukada H,Pollock M,Allpress S.Experimental cold injury to peripheral nerve[J].Brain,1981,104:779-811.
[21]Jia J,Pollock M,Jia J.Cold injury to nerves is not due to ischaemia alone[J].Brain,1998,121:989-1001.
[22]Jia J,Pollock M.Cold nerve injury is enhanced by intermittent cooling[J].Muscle Nerve,1999,22:1644-1652.
[23]Olsson Y.Studies on vascular permeability in peripheral nerves 2 Distribution of circulating fluorescent serum albumin in rat sciatic nerve after local injection of 5-hydroxytryptamine,histamine and Compound 48/80[J].Acta Physiol Scand,1966,42:284.
[24]Olsson Y.Mast cells in the nervous system[J].Int Rev Cytol,1968,24:27-70.

A.在对照侧,红色荧光局限于血管腔内,神经内膜中未见荧光外漏出血管;B.冷损伤后1 d 坐骨神经内膜可见弥漫红色荧光;C.冷损伤后3 d,在大鼠坐骨神经受冷段可见神经内膜红色荧光减少;D.冷损伤后5 d,在大鼠坐骨神经受冷段可见神经内膜红色荧光减少
图3冷损伤后坐骨神经内伊文思蓝的分布变化 (伊文思蓝染色,×40)
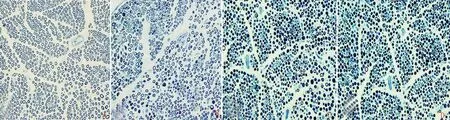
A.对照侧坐骨神经;B.低温组冷损伤后1 d,神经轴索出现以“暗、空”为主要表现的退变,并出现血管管腔狭窄和内皮细胞肿胀;C.冷损伤后3 d,大鼠坐骨神经中出现更多的神经轴索出现严重的暗退变;D.冷损伤后5 d大鼠坐骨神经出现退变轴索
图4坐骨神经非冻结性冷损伤光学显微镜下所见图像(甲苯胺蓝染色,×400)

A.对照侧神经内膜血管内皮细胞大致正常(×13000);B.低温后1 d时低温组神经内膜血管管腔狭窄,内皮细胞增生(×10000);C.低温后3 d时低温组神经内膜血管管腔狭窄,内皮细胞增生(×10000);D.低温后5 d时低温组神经内膜血管管腔狭窄,内皮细胞增生(×10000)
图5坐骨神经非冻结性冷损伤电子显微镜下所见图像(醋酸铀-枸橼酸铅染色)
The study of blood-nerve barriers in non-freezing cold injury of the sciatic nerves
LIHao,ZHANGLei,XUMin.
(DepartmentofNeurology,TheFirstPeople’sHospitalofYibin,Yibin644000,China)
ObjectiveTo make the model of non-freezing cold injury in peripheral nerves,observe edema in endoneurium in non-freezing cold injury,and study the effect of barrier function and corresponding pathological changes.MethodsMale Wistar rats were randomly divided into the 1st group,3rd group and 5th group.One side of sciatic nerves wastreated at 3 ℃ ~5 ℃ for 2 hours,the other side was as control.The bilateral sciatic nerves of each group were harvested on the 1st,3rd and 5th day after cooling.The structure of nerves and blood-nerve barrier were examined.ResultsOn the 1st day,most of the myelinated fibres in sciatic nerves showed “empty or dark” axons,with normal unmyelinated fibres and tight junction.Endoneurial capillary lumen was seriously narrowed.From the 3rd day to 5th day,myelinated fibre degeneration became more widespread and unmyelinated fibres also began to degenerate.The vasculature was similar to that of the 1st day,with tight junction open.There was significant difference between the cooled group and control group in the 1st day.Normal rat sciatic nerve showed a bright red fluorescence confined to the lumen of endoneurial blood vessels and none appeared outside the vascular walls.The segments at the cooling sites of sciatic nerves were examined on 1st day after the cooled injury,the sciatic nerve showed intense red fluorescence in endoneurium,outside the vascular.On the 3rd and 5th day after nerve cooled,the red fluorescence was also seen,but the intensity decreased.ConclusionNon-freezing cold injury to rat sciatic nerve could resulted in breakdown of the blood-nerve barrier function,causing endoneurial edema.Myelinated fibers were mainly selectively damaged,but unmyelinated fibers were preserved.
Non-freezing cold injury;Blood-nerve barrier;Sciatic nerve;Nerve degeneration
1003-2754(2016)02-0104-05
2015-12-16;
2016-01-29
四川省医学会“施慧达”课题(SHD12-21)
(1.宜宾市第一人民医院神经内科,四川 宜宾 644000;2.宜宾市第一人民医院药剂科,四川 宜宾 644000;3.首都医科大学宣武医院神经内科,北京 100053)
李浩,E-mail:lihao119@sohu.com
R745
A

