P-选择素基因S290N和P-选择素糖蛋白配体-1基因M62I多态性与缺血性脑梗死血小板白细胞聚集体的相关性探讨
李 滔,李琳芸,王昌富,梅 冰,姚长江,龚道凯,胡小辉
P-选择素基因S290N和P-选择素糖蛋白配体-1基因M62I多态性与缺血性脑梗死血小板白细胞聚集体的相关性探讨
李滔,李琳芸,王昌富,梅冰,姚长江,龚道凯,胡小辉
目的探讨血小板白细胞聚集体在缺血性脑梗死中的变化以及与P-选择素基因S290N和P-选择素糖蛋白配体-1基因M62I多态性的关系。方法选取58例缺血性脑梗死患者作为病例组,20例正常人群作为对照组。病例组分为大动脉粥样硬化性脑梗死(LAA)19例,小动脉闭塞性脑梗死(SAO)39例。运用流式细胞技术检测所有受试者的血小板白细胞聚集体(PLA)、血小板单核细胞聚集体(PMA)、血小板淋巴细胞聚集体(PLyA)和血小板中性粒细胞聚集体(PNA)水平。并运用基因测序方法检测P-选择素基因S290N和P-选择素糖蛋白配体-1基因 M62I多态性。结果PMA%在病例组与对照组、LAA与对照组、SAO与对照组间差异有统计学意义(P=0.000,P=0.018,P=0.000)。PNA%在病例组与对照组、LAA与对照组间差异有统计学意义(P=0.045,P=0.002)。PNA%在LAA组SELP基因S290N位点SS和SN基因型间差异有统计学意义(P=0.008)。PLA%在LAA组PSGL-1基因M62I位点MM、MI和Ⅱ基因型间差异有统计学意义(P=0.046)。结论PMA和PNA与缺血性脑梗死发病有关,SELP基因S290N位点SN基因型以及PSGL-1基因M62I位点MM基因型会增加LAA发生风险。
血小板单核细胞聚集体;血小板中性粒细胞聚集体;P-选择素;P-选择素糖蛋白配体-1;缺血性脑梗死;基因型
血小板和白细胞的功能在缺血性脑梗死的发生发展中起着重要的作用[1]。血小板和白细胞分别活化后,其表面的黏附分子增加。黏附分子通过配体相互结合和(或)通过纤维蛋白原在黏附分子之间的桥接作用形成血小板白细胞聚集体[2,3](patelet leukocyte aggregation,PLA)。根据血小板与不同类别的白细胞结合,分别形成血小板单核细胞聚集体(platelet monocyte aggregations,PMA)、血小板淋巴细胞聚集体(platelet lymphocyte aggregations,PLA)和血小板中性粒细胞聚集体(platelet neutrophilic aggregations,PNA)。已有的临床研究表明[4],PLA尤其是PMA可以作为评价血小板活化的指标。血小板活化后,血小板膜表面的P-选择素表达增加。P-选择素(P-selectin,SELP)即CD62P,是一种跨膜糖蛋白,主要存在于活化血小板的α颗粒和内皮细胞的Weibel-Palade小体[5]。伴随着血小板活化,SELP迅速定位于活化血小板的表面。P-选择素糖蛋白配体-1(P-selectin glycoprotein ligand-1,PSGL-1),也是一种跨膜糖蛋白,其作为SELP的结合配体,几乎表达于所有白细胞的表面[6]。体内外实验已经证实,PSGL-1是唯一与SELP具有高亲和力的配体,且抗PSGL-1单克隆抗体可以完全阻断血流状态下白细胞在表达SELP细胞上的滚动以及静止状态下白细胞与表达SELP细胞的黏附[7]。活化血小板可以通过表面的SELP和白细胞表面的PSGL-1结合形成PLA。SELP和PSGL-1存在基因多态性。有研究证实SELP基因多态性和PSGL-1基因多态性与缺血性脑梗死的发生可能有关[8~10]。而PLA的形成在缺血性脑梗死的发病中起着关键作用。我们研究旨在关注SELP基因S290N和PSGL-1基因M62I多态性与缺血性脑梗死患者PLA水平变化的关系。
1 材料与方法
1.1研究对象根据2013年美国心脏协会卒中委员会(AHA)/美国卒中协会(ASA)发布的21世纪脑梗死新定义的诊断标准[11],选取缺血性脑梗死患者58例作为病例组。男37例,女22例,平均年龄(62.67±12.67)岁。其中大动脉粥样硬化性脑梗死(large artery atherosclerosis,LAA)19例,小动脉闭塞性脑梗死(small artery occlusion,SAO)39例。另外选取20例无高血压、糖尿病、冠心病等心脑血管疾病的健康人群作为对照组。男11例,女9例,平均年龄(60.05±8.05)岁。
1.2研究方法
1.2.1流式细胞分析抽血时前2 ml血弃去,获取枸橼酸钠抗凝全血标本,立即处理。温和颠倒混匀,取每管50 μl,共2管。(1)标记抗体:每管如下加抗体:对照管加CD45-ECD5 μl,IgG1-PE10 μl。检测管加CD45-ECD5 μl,CD42b-PE10 μl。温和混匀,室温避光孵育20 min。(2)溶血固定:加含1.5%甲醛的溶血剂OptiLyse 500 μl,温和混匀,室温放置10 min。(3)洗涤:加PBS 3 ml,混匀,室温避光孵育5 min。1500 rpm离心5 min。去上清。适量PBS重悬沉淀,上机检测。以CD45-ECD标记所有的白细胞,以CD42b-PE标记血小板,在CD45-ECD/SSC散点图中显示单核细胞,淋巴细胞和中性粒细胞。分别圈定设门,以CD45-ECD/CD42b-PE双阳性为PLA,计数至少1000个白细胞,分别记录PLA、PMA、PLyA和PNA数量占白细胞、单核细胞、淋巴细胞、中性粒细胞数的百分比。所有荧光标记单克隆抗体、OptiLyse溶血剂、Epics XL 流式细胞仪均来自于美国Beckman Coulter公司。
1.2.2基因测序分析采集受试者静脉血2 ml于EDTA-K2抗凝管中,使用Takara Blood Genome DNA Extraction Kit试剂盒提取所有受试者基因组DNA。根据NCBI提供的Genebank库中PSEL S290N和PSGL-1 M62I位点附近260 bp序列,运用斯坦福大学在线引物设计软件设计引物,由Takara宝生物工程(大连)有限公司合成。PSEL S290N上游引物序列为:5’-GTGCAGACCAGTGTCCAGAGT-3’,下游引物序列为5’-CCTGCATTTCAGAGGTGGTT-3’。PSGL-1 M62I上游引物序列为:5’-CAGCTCCGTGGTCAGCTCT-3’,下游引物序列为5’-TGTGGGACACCTGGGCAGAT-3’。基因组DNA在ABI7300荧光定量PCR仪上扩增。扩增产物纯化和基因测序由生工生物工程(上海)股份有限公司完成。
1.3统计学分析计量资料经正态性检验为非正态分布,采用中位数(四分位间距)表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H(K)检验。以P<0.05为差异有统计学意义。所有统计学分析在Windows 7 Service Pack 1操作系统中采用SPSS 18.0软件处理。
2 结 果
2.1PLA%、PMA%、PLyA%、PNA%在病例组(和亚型组)与对照组间比较PMA%在病例组与对照组、LAA与对照组、SAO与对照组间差异有统计学意义(P=0.000,P=0.018,P=0.000)。PNA%在病例组与对照组、LAA与对照组间差异有统计学意义(P=0.045,P=0.002)(见表1)。
2.2对照组、LAA组和SAO组中PLA%、PMA%、PLyA%、PNA%与SELP基因S290N位点不同基因型和PSGL-1基因M62I位点不同基因型间的差异比较PNA%在LAA组SS和SN基因型间差异有统计学意义(P=0.008),SN基因型PNA%明显增高。PLA%在LAA组MM、MI和II基因型间差异有统计学意义(P=0.046),MM基因型PLA%明显增高(见表2)。
2.3SELP基因S290N位点不同基因型以及PSGL-1基因M62I位点不同基因型中PLA%、PMA%、PLyA%、PNA%与对照组、LAA组和SAO组间的差异比较基因型为SN的受试者PNA%在对照组、LAA组和SAO组间差异有统计学意义(P=0.034),LAA组PNA%明显增高。基因型为MM的受试者PNA%在对照组、LAA组和SAO组间差异有统计学意义(P=0.006),LAA组PNA%明显增高(见表2)。
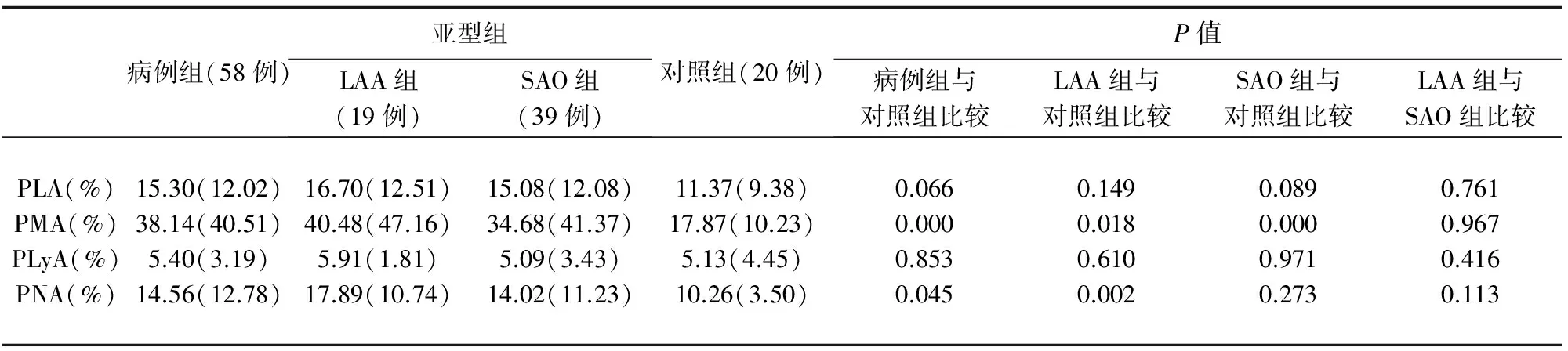
表1 PLA%、PMA%、PLyA%、PNA%在病例组(和亚型组)与对照组间比较

表2 以疾病亚型分组血小板白细胞聚集体水平在基因型间的比较和以基因型分组血小板白细胞聚集体水平在疾病亚型间的比较
注:*以疾病亚型分组血小板白细胞聚集体水平在基因型间的比较,**以基因型分组血小板白细胞聚集体水平在疾病亚型间的比较
3 讨 论
在缺血性脑梗死发病早期,血小板迅速被活化,其α颗粒膜上SELP表达增加。SELP通过植物凝集素样区域,与白细胞上表达的PSGL-1高亲和力结合,形成PLA。大部分研究[2,12,13]指出PLA%在缺血性脑梗死中的水平显著高于对照组。根据血小板与不同类别的白细胞结合,研究者还讨论了PMA%、PLyA%和PNA%在病例组与对照组间的差异。Zeller[14]指出三者在病例组中均高于对照组,差异有统计学意义。而本实验中,除了PLyA%在病例组与对照组间差异均没有统计学意义外,PMA%和PNA%在病例组中均高于对照组。这与Schmalbach[13]和Marquardt[15]报导的结果一致。而Tsai[16]的研究得出PMA%和PLyA%在病例组与对照组间差异有统计学意义,PNA%在病例组与对照组间没有差异。Oberheiden[17]仅仅只发现PMA%在病例组与对照组间差异有统计学意义。按照病因学亚型分型得出,PMA%在亚型组与对照组间差异均有统计学意义,而PLyA%在亚型组与对照组间差异均没有统计学意义,PNA%仅仅在LAA与对照组间差异有统计学意义,而LAA与SAO比较没有发现三者差异有统计学意义。鉴于此,本文认为PMA参与了大动脉粥样硬化与小动脉玻璃样变的形成,其作用程度可能强于PLyA和PNA。但PMA在大动脉粥样硬化与小动脉玻璃样变之间作用程度可能并无差异。
诸多研究结论不一,造成差异的原因不明。本文研究了SELP基因S290N和PSGL-1基因M62I多态性与缺血性脑梗死PLA水平的关系,试图从缺血性脑梗死的遗传学因素中找出原因。各基因型与PLA水平的关系探讨中(以疾病亚型分组),LAA组SELP基因S290N位点SN基因型患者PNA%水平高于SS基因型患者;LAA组PSGL-1基因M62I位点MM基因型患者PLA%水平高于MI和II基因型患者。各疾病亚型与PLA水平的关系探讨中(以基因型分组),SELP 基因S290N位SN基因型受试者,发生LAA的患者体内PNA%水平高于发生SAO的患者和正常对照;PSGL-1基因 M62I位点MM基因型受试者,发生LAA的患者体内PNA%水平高于发生SAO的患者和正常对照。由此可见,PNA在SELP基因S290N位点SN基因型和PSGL-1基因M62I 位点MM基因型患者中发生LAA的形成过程中发挥了重要作用。SELP基因S290N位点位于编码第3个补体调节蛋白样功能区[18],其多态性可能会影响SELP基因的转录和SELP水平的表达。PSGL-1 M62I位点靠近编码SELP结合绑定的区域[19],其多态性可能与SELP和PSGL-1相互作用的能力相关。在LAA形成过程中,SN基因型(NN基因型未检出)患者以及MM基因型患者血小板膜上表达的SELP和白细胞膜上表达的PSGL-1促使PNA的形成更加紧密,结合的量更多,从而加速血管内皮细胞附壁,单核细胞迁移,泡沫细胞形成,内膜增厚,最终导致LAA。关于基因多态性与缺血性脑梗死PLA水平的关系探讨,目前研究极少。Schmalbach[13]报导了PSGL-1 M62I可以作为缺血性脑梗死PLA相关的候选基因多态性位点,这与本文的结果一致。另外Lozano[20]报导PSGL-1基因数量可变的串联重复序列(VNTR)多态性会影响PNA的结合能力。
总之,目前的研究表明缺血性脑梗死患者PMA%和PNA%急速升高。LAA组PMA%和PNA%,SAO组PMA%高于对照组。SELP 基因S290N多态性与LAA组PNA%相关,SN基因型会增加LAA发生风险。PSGL-1基因M62I多态性与LAA组PLA%相关,MM基因型会增加LAA发生风险。
[1]Jonathan S,Alexander D,Marcus C,et al.Platelet function following acute cerebral ischemia [J].Angiology,2009,60:362-369.
[2]Patrik H,Suzanne FM,Bernd T,et al.Course of platelet activation and platelet-leukocyte interaction in cerebrovascular ischemia[J].Stroke,2006,37:2283-2287.
[3]Franks ZG,Campbell RA,Weyrich AS,et al.Platelet-leukocyte interactions link inflammatory and thromboembolic events in ischemic stroke[J].Annals of the New York Academy of Sciences,2010,1207:11-17.
[4]Ray MJ,Walters DL,Bett JN,et al.Platelet-monocyte aggregates predict troponin rise after percutaneous coronary intervention and are inhibited by Abciximab[J].Int J Cardiol,2005,101(2):249-255.
[5]Perumal R,Rajendran M,Krishnamurthy M,et al.Modulation of P-selection and platelet aggregation in chronic periodontitis:A clinical study[J].J Indian Soc Periodontol,2014,18(3):293-300.
[6]Takahashi D,Fujihara M,Azuma H,et al.Adhesive interaction between peripheral blood mononuclear cells and activated platelets in the presence of anti-human leukocyte antigen Class I alloantibody causes production of IL-1b and IL-8[J].Vox Sanguinis,2012,102:250-257.
[7]Janine M,van Gils,Zwaginga JJ.Molecular and functional interactions among monocytes,platelets,and endothelial cells and their relevance for cardiovascular diseases[J].J Leukocyte Biology,2009,85(2):195-204.
[8]Zee RY,Cook NR,Cheng S,et al.Polymorphism in the P-selectin and interleukin-4 genes as determinants of stroke:a population-based,prospective genetic analysis[J].Human Molecular Genetics,2004,13(4):389-396.
[9]Wei YS,Lan Y,Huang RY,et al.Association of the single-nucleotide polymorphism and haplotype of the P-selectin gene with ischemic stroke[J].J Thrombosis & Thrombolysis,2009,27(1):75-81.
[10]Holliday EG,Maguire JM,Evans TJ,et al.Common variants at 6p21.1 are associated with large artery atherosclerotic stroke [J].Nature Genetics,2012,44(10):1147-1151.
[11]Sacco RL,Kasner SE,Broderick JP,et al.An updated definition of stroke for the 21st century:a statement for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2013,44(7):2064-2089.
[12]Zeller JA,Frahm K,Baron R,et al.Platelet-leukocyte interaction and platelet activation in migraine:a link to ischemic stroke [J].J Neurology Neurosurgery & Psychiatry,2004,75(7):984-987.
[13]Schmalbach B,Stepanow O,Jochens A,et al.Determinants of platelet-leukocyte aggregation and platelet activation in stroke [J].Cerebrovascular Diseases,2015,39(3/4):176-180.
[14]Zeller JA,Lenz A,Eschenfelder CC,et al.Platelet-leukocyte interaction and platelet activation in acute stroke with and without preceding infection[J].Arterioscler Thromb Vasc Biol,2005,25(7):1519-1523.
[15]Marquardt L,Anders C,Buggle F,et al.Leukocyte-platelet aggregates in acute and subacute ischemic stroke[J].Cerebrovascular Diseases,2009,28(3):276-282.
[16]Tsai NW,Chang WN,Shaw CF,et al.Levels and value of platelet activation markers in different subtypes of acute non-cardio-embolic ischemic stroke[J].Thrombosis Research,2009,124(2):213-218.
[17]Oberheiden T,Nguyen XD,Fatar M,et al.Platelet and monocyte activation in acute ischemic stroke-is there a correlation with stroke etiology[J].Clin Appl Thromb Hemost,2011,18(1):87-91.
[18]Pasquali A,Trabetti E,Romanelli MG,et al.Detection of a large deletion in the P-selectin (SELP) gene[J].Molecular & Cellular Probes,2010,24(3):161-165.
[19]Bugert P,Vosberg M,Entelmann M,et al.Polymorphisms in the P-selectin (CD62P) and P-selectin glycoprotein ligand-1(PSGL-1) genes and coronary heart disease[J].Clinical Chemistry & Laboratory Medicine,2004,42(9):997-1004.
[20]Lozano ML,Corral J,Rivera J,et al.Polymorphisms of P-selectin glycoprotein ligand-1 are associated with neutrophil-platelet adhesion and with ischaemic cerebrovascular disease[J].British J Haematology,2001,115(4):969-976.
Association of polymorphism of P-selectin gene S290N and P-selectin glycoprotein ligand-1 gene M62I with platelet leukocyte aggregation in ischemic cerebral infarction
LITao,LILinyun,WANGChangfu,etal.
(DepartmentofClinicalLaboratory,AffiliatedJingzhouHospital,TongjiMedicalCollege,HuazhongScienceandTechnologyUniversity,Jingzhou434020,China)
ObjectiveTo investigate the association of polymorphism of P-selectin (SELP) gene S290N and P-selectin glycoprotein ligand-1 (PSGL-1) gene M62I with platelet leukocyte aggregation in ischemic cerebral infarction.MethodsA total of 58 ischemic cerebral infarction patients including 19 large artery atherosclerosis cerebral infarction (LAA) patients and 39 small artery occlusion cerebral infarction (SAO) patients and 20 healthy controls were enrolled into the study.The levels of platelet leukocyte aggregation (PLA),platelet monocyte aggregations (PMA),platelet lymphocyte aggregations (PLyA) and platelet neutrophilic aggregations (PNA) were detected by flow cytometric analysis and the polymorphisms of SELP gene S290N and PSGL-1 gene M62I were detected by gene sequencing.ResultsThe percentages of PMA were significant differences between the cases group and the controls group,the LAA group and the controls group,the SAO group and the controls group(P=0.000,P=0.018,P=0.000,respectively).The percentages of PNA were significant differences between the cases group and the controls group,the LAA group and the controls group(P=0.045,P=0.002,respectively).The percentages of PNA were significant differences between SS and SN genotypes of SELP gene S290N in the LAA group(P=0.008) and the percentages of PLA were significant differences among MM,MI and II genotypes of PSGL-1 gene M62I in the LAA group(P=0.046).ConclusionPMA and PNA are correlated with ischemic cerebral infarction.The genotypes of SN in SELP S290N and MM in PSGL-1 M62I can increase the risk of large artery atherosclerosis cerebral infarction.
Platelet monocyte aggregations;Platelet neutrophilic aggregations;P-selectin;P-selectin glycoprotein ligand-1;Ischemic cerebral infarction;Genotype
1003-2754(2016)02-0113-04
2015-10-24;
2015-11-29
湖北省卫计委基金项目(No.JX5B47)
(华中科技大学同济医学院附属荆州医院检验医学部,湖北 荆州 434020)
王昌富,E-mail:jzyyjyk@sina.com
R743.3
A

