硫酸铵盐析法加工分离白钠镁矾的相图研究*
巩学敏,张嘉勇,曹吉林
(1.华北理工大学化工学院,河北唐山063009;
2.河北省绿色化工与高效节能重点实验室,河北工业大学化工学院)
研究与开发
硫酸铵盐析法加工分离白钠镁矾的相图研究*
巩学敏1,2,张嘉勇1,曹吉林2
(1.华北理工大学化工学院,河北唐山063009;
2.河北省绿色化工与高效节能重点实验室,河北工业大学化工学院)
针对白钠镁矾矿物加工分离困难的问题,对相关水盐体系相图做了研究,设计了以硫酸铵为盐析剂加工分离白钠镁矾的生产工艺。通过相图分析可以发现,当温度为60℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系会形成较大的MgSO4·(NH4)2SO4·6H2O复盐结晶区,0℃时则形成Na2SO4·10H2O结晶区,所以调节混合体系温度和水量可以实现氮镁复肥和硫酸钠的循环生产。硫酸铵为盐析剂加工分离白钠镁矾的生产工艺具有反应时间短、操作简单等特点,此外还可制备得到氮镁复肥和硫酸钠。该工艺对于有效分离白钠镁矾矿物,实现白钠镁矾资源的综合利用具有重要的现实意义。
白钠镁矾;硫酸铵;盐析法;相图
白钠镁矾是一种含水的钠镁硫酸盐矿物,也是芒硝矿床的主要矿物之一[1]。中国西藏、青海、新疆、内蒙古、山西等地都拥有丰富的盐湖资源,贮藏着大量的白钠镁矾。在山西运城发现储量达2×108t以上的盐池资源,内蒙古的阿拉善盟等多处储藏着几十亿吨的白钠镁矾矿。由于白钠镁矾矿是含水的硫酸钠镁复盐,对其进行加工利用较为困难,所以近年来中国针对白钠镁矾的分离和综合利用研究较少[2-3]。
水盐体系相图可用于盐矿物的分离和提纯,是选择结晶法分离提纯盐类的最佳工艺条件。通过对体系相图结晶特征的深入研究,并将其应用于盐矿资源开采和加工技术的分析中,不仅有助于减少传统工艺(物理法或化学法)过程中废弃物或副产物的产生,而且对节能环保和工艺循环利用的实现具有积极的促进作用。目前,已经有比较完整的硫酸镁和硫酸钠的水盐体系相平衡数据和相图[4],但采用传统低温结晶,高温蒸发的方法很难有效分离提纯硫酸钠和硫酸镁。为此,研究者们针对白钠镁矾矿的加工分离和综合利用展开研究。黄雪莉等[5]采用白钠镁矾与氯化钾混合反应,研究了制备硫酸钾的技术工艺。Lan Tianyang等[6]采用加入尿素CO(NH2)2盐析法生产硫酸钠和氮镁复肥的新工艺。H.F.Guo等[7]研究了25℃条件下,加入硫酸铵制备硫酸钠和氮镁复肥的工艺。该工艺通过分析25℃下Na2SO4-MgSO4-(NH4)2SO4-H2O体系相图可析出氮镁复肥,再降温至0℃结晶析出十水硫酸钠。但这些方法均难以解决白钠镁矾的工业综合开发和利用的问题。笔者对60℃和0℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相图特征做了综合分析,通过调节温度和水量,设计了60℃时生产氮镁复肥,0℃时降温生产硫酸钠的技术工艺。
1 不同温度下Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相图
1.1 Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相平衡反应时间与温度的关系
表1为根据文献[7-9]得到的不同温度条件下Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系达到相平衡的时间。

表1 不同温度时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系的相平衡反应时间
由表1可以看出,随着温度升高,Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相反应平衡所需的时间大大缩短,其中温度为60℃时反应时间最短。在60℃条件下,以硫酸铵为盐析剂加工分离白钠镁矾,很大程度上节省了工艺运行时间,提高了工艺生产效率。
原理分析:随着温度升高,相反应平衡的时间缩短主要与溶液的自扩散系数和黏度有关[10],溶液的扩散系数和黏度系数与其微观结构和内能有关。对于同一体系的混合溶液,温度升高加剧了溶液中分子的运动和碰撞,增大了混合溶液中各分子偏离初始位置的程度,减小了各分子间的相互作用力,促进了分子的扩散,所以扩散系数增大。同时随着温度升高,溶液的内能增加,溶液各分子相互间内摩擦力减小,因此黏度系数减小。扩散系数增大和溶液黏度减小都有利于加快混合体系的反应速度,所以温度升高有利于缩短相平衡反应的时间。
1.2 60℃和0℃下Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相图分析
图1为结合文献[8-9]数据所绘制的60℃和0℃条件下Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系的干盐相图,其中组成点均为干基质量分数,基准是以硫酸钠、硫酸镁、硫酸铵3种干盐相加为100g时计算所得。图1是在60℃Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系完整相图的基础上,对0℃条件下该四元体系相图做了描绘。从生产氮镁复肥和硫酸钠的工艺方面出发,图1仅描述了0℃时该四元体系相图的部分相图,即MgSO4·(NH4)2SO4·6H2O和硫酸钠这2个结晶区的二盐共饱曲线。由图1可见,60℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系存在3个等温共饱点B、C和D,分别表示MgSO4·6H2O、MgSO4·NaSO4·4H2O和MgSO4·(NH4)2SO4·6H2O的共饱点,Na2SO4、MgSO4·NaSO4·4H2O和MgSO4·(NH4)2SO4· 6H2O的共饱点,MgSO4·(NH4)2SO4·6H2O、(NH4)2SO4和Na2SO4的共饱点。该四元体系可形成5个结晶区,分别为MgSO4·6H2O结晶区MEBF,MgSO4·NaSO4· 4H2O复盐结晶区 FBCG,Na2SO4结晶区 GCDHS,(NH4)2SO4结晶区AIDH和MgSO4·(NH4)2SO4·6H2O复盐结晶区EBCDI。图1表明,在60℃条件下,Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相图存在MgSO4·(NH4)2SO4·6H2O复盐结晶区,且结晶区的面积较大。
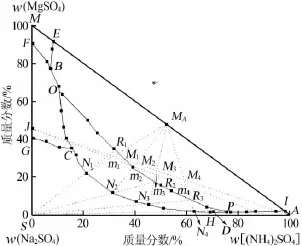
图1 60℃和0℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相图
60℃和0℃条件下Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相图在共饱点、结晶区等方面均存在很大差别。0℃时,该体系不产生MgSO4·Na2SO4·4H2O结晶区,而是生成较小面积的 MgSO4·(NH4)2SO4· 6H2O结晶区,形成Na2SO4·10H2O结晶区,且面积较大。60℃时无Na2SO4·(NH4)2SO4·4H2O复盐结晶区生成,而是生成较大的MgSO4·(NH4)2SO4·6H2O复盐结晶区,形成不含结晶水的Na2SO4结晶区。60℃时该相图的部分氮镁复肥和硫酸钠的二盐共饱线均落在0℃时该相图的十水硫酸钠的结晶区间内,据此可以根据60℃和0℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系的相图特征,设计以硫酸铵为盐析剂、白钠镁矾为原料,通过调节温度和水量,对白钠镁矾进行加工分离的工艺。即在60℃条件下,将白钠镁矾、硫酸铵和水按照一定比例充分溶解反应,静止分层,此时结晶析出氮镁复肥,移去氮镁复肥结晶后,对应的剩余母液点可落在0℃时该相图Na2SO4·10H2O的结晶区内,如图1所示。若将剩余母液降温至0℃时,可进行结晶析出硫酸钠产品的生产工艺。
2 60℃和0℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系的相图工艺
2.1 基于相图的工艺设计
如图1所示,实线表示结晶区域边界线,虚线表示工艺流程线,J点代表白钠镁矾(Na2SO4·MgSO4· 4H2O),其化学组成(质量分数):NaSO4,42.47%、MgSO4,35.99%、H2O,21.54%,用图1中J点表示。MA点代表氮镁复肥[MgSO4·(NH4)2SO4·6H2O],其化学组成(质量分数):MgSO4,36.64%、H2O,29.98%、(NH4)2SO4,33.38%。0℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系部分相图与60℃相图相交于O、P,60℃时Na2SO4-MgSO4-(NH4)2SO4-H2O四元体系相图OP部分落在0℃相图Na2SO4·10H2O结晶区内。
调节体系温度至60℃,向J体系点中逐渐加入H2O和(NH4)2SO4,混合体系点将沿着JA线从J点向A点移动。随着H2O和(NH4)2SO4的不断加入,当混合体系的组成点到达60℃该相图的EBCDI区域内时,Mg-N复肥将会结晶析出。分别选取图1中M1、M2、M3和M4为最初加料点加以分析。
根据杠杆规则和物料平衡定律,对JA线上4个混合体系组成点M1、M2、M3和M4进行比较可知,当初始加料量相同时,结晶出复盐MgSO4·(NH4)2SO4· 6H2O量由大到小的顺序为M4>M3>M2>M1。根据直线规则,图1中N1、N2、N3和N4点分别为分离Mg-N复盐后的剩余母液组成点,N点系列分别是MAM1、MAM2、MAM3和MAM4延长线与60℃时该相图的二盐共饱线CD的交点。
由图1可以看出,剩余母液点N点系列均落在0℃时该四元体系相图的Na2SO4·10H2O结晶区内。调节温度至0℃时,剩余母液中又将析出Na2SO4· 10H2O的结晶,分离该结晶后,剩余母液组成分别为R1、R2、R3和R4点,它们分别是SN1、SN2、SN3和SN4延长线与0℃相图共饱线OP的交点。根据杠杆规则和物料平衡定律可知,析出Na4SO4·10H2O的量从大到小顺序为 R1>R2>R3>R4。分离 Na2SO4·10H2O后,剩余母液中含有(NH4)2SO4、MgSO4和少量Na2SO4,将剩余母液与原料充分混合反应,进入下一步的循环利用。按照一定配比,向母液中分别加入白钠镁矾、硫酸铵和水,这时混合体系点又分别落在MAM1N1、MAM2N2、MAM3N3和MAM4N4线上。当调节混合体系温度至60℃时,体系中又会析出MgSO4·(NH4)2SO4·6H2O复盐结晶。根据直线规则,对应的剩余母液组成点分别为N1、N2、N3和N4,根据上述步骤,母液可进行下一个循环生产。综上所述,配制一定配比的原料混合液,通过调节温度和水量即可以实现Mg-N复肥和硫酸钠产品的循环生产。以白钠镁矾、硫酸铵和水为原料,设计出制备Mg-N复肥和硫酸钠的技术工艺,其工艺流程见图2。
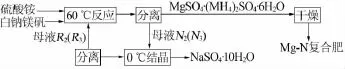
图2 白钠镁矾为原料加工制备氮镁复肥和硫酸钠工艺流程示意图
2.2 基于相图的工艺计算
相图工艺计算是基于1 000 kg的白钠镁矾原材料,选取原料混合体系点M1和M2进行的。表2为依据杠杆规则和物料平衡定理,工艺生产氮镁复肥和硫酸钠相图的相关数据。
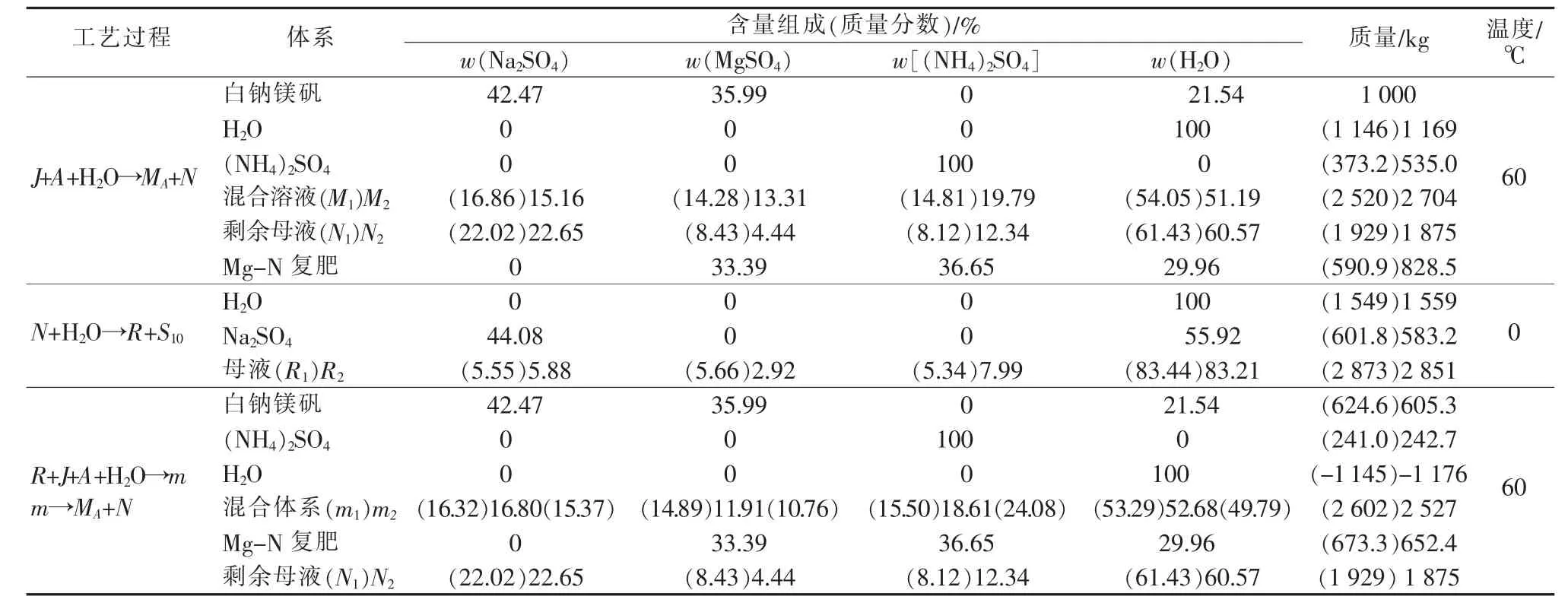
表2 白钠镁矾为原料加工制备氮镁复肥和硫酸钠工艺数据
以混合点M2为例,图1中白钠镁矾的干盐组成点为J点,在60℃条件下,当将535.0 kg硫酸铵和1 169 kg水加入1 000 kg白钠镁矾J点中时,混合溶液点为M2点,反应平衡后将有828.5 kg Mg-N复肥和1 875 kg剩余母液产生,母液点为N2。分离Mg-N复肥固相后,向剩余母液N2中加入1 559 kg水,调节温度至0℃,当混合体系反应平衡时,又将沉淀析出Na2SO4·10H2O 583.2 kg,分离产品Na2SO4· 10H2O后,产生剩余母液2 851 kg,图1中表示为R2点。如向剩余母液R2中加入605.3 kg白钠镁矾、242.7 kg硫酸铵,调节体系温度至60℃时,同时蒸发H2O 1 176 kg,又将得到2 527 kg的混合液,这时系统点落在图1的Mg-N复肥结晶区内,表示为m2点,这时又将产生氮镁复肥652.4 kg和母液1 875 kg,母液为N2点。按照上述步骤操作,N2点可以实现下一个循环生产。
对混合体系点M1、M2、M3、M4进行综合对比,析出复盐MgSO4·(NH4)2SO4·6H2O的量由大到小顺序为M4>M3>M2>M1,析出Na2SO4的量由大到小顺序为R1>R2>R3>R4,且R2比R1析出Na2SO4的量减少量很少,可忽略不计。而且M2点析出氮镁复肥和Na2SO4后母液量较小,故选择M2为适宜的最初加料点。
3 结论
1)依据数据分析,对0、25、35℃时相平衡时间做了对比。结果表明,60℃时四元体系 Na2SO4-MgSO4-(NH4)2SO4-H2O达到相平衡的时间最短。2)依据相图分析和计算,设计了生产Na2SO4的新工艺。以白钠镁矾矿和硫酸铵为原料,首先在60℃时反应可生产Mg-N复肥,再调节温度和水量,降温至0℃时得到Na2SO4产品,生产剩余母液还可以与原材料混合实现循环生产。通过工艺计算,确定了适宜的最初加料点。
[1] 宋彭生,李武,孙柏,等.盐湖资源开发利用进展[J].无机化学学报,2011,27(5):801-815.
[2] 程芳琴,成怀刚,崔香梅.中国盐湖资源的开发历程及现状[J].无机盐工业,2011,43(7):1-4.
[3] 程怀德,马海洲.中国硫酸盐型盐湖资源及无氯钾肥开发展望[J].无机盐工业,2008,40(3):8-10.
[4] Howard S.Solubilities of inorganic and organic compounds[M].3rd ed.Oxford:New York Pergamon Press,1979.
[5] 黄雪莉,高飞,迪木拉提.钠镁矾类矿制取硫酸钾工艺开发研究[J].海湖盐与化,2001,30(5):8-11.
[6] Lan Tianyang,Cao Jilin,Jin Huaiyong,et al.Phase diagrams of Na2SO4-MgSO4-CO(NH2)2-H2O system at 25℃and their application[J].Chem.Eng.Data,2012,57(2):389-393.
[7] Guo H F,Cao J L,Wang J J,et al.Phase diagrams of Na2SO4-MgSO4-(NH4)2SO4-H2O system at 25℃and their application[J]. Fluid Phase Equilibria,2014,367:79-84.
[8] Gong X M,Zhao B,Zhang J Y,et al.Phase diagrams of the Na2SO4-MgSO4-(NH4)2SO4-H2O system at 60℃and their application[J]. Journal of Chemical&Engineering Data,2015,60:1048-1055.
[9] Zhang Jing,Guo Hongfei,Cao Jilin.Phase equilibrium of the quaternary system Na2SO4-MgSO4-(NH4)2SO4-H2O at 0℃[J].Journal of Chemical&Engineering Data,2013,58(9):2622-2628.
[10] 娄彦敏,刘娟红,周晓平,等.温度对水的粘度和扩散系数影响的研究[J].西南师范大学学报:自然科学版,2009,34(6):34-39.
Study on phase diagram of processing bloedite by ammonium sulfate salting out method
Gong Xuemin1,2,Zhang Jiayong1,Cao Jilin2
(1.College of Chemical Engineering,North China University of Science and Technology,Tangshan 063009,China;2,Hebei Provincial Key Lab of Green Chemical Technology and High Efficient Energy Saving,College of Chemical Engineering and Technology,Hebei University of Technology)
In allusion to the difficulty of processing and separation of bloedite,a technology was designed to separate bloedite with ammonium sulfate as the salting-out agent,and the corresponding phase diagram of water-salt system was studied.The analysis on phase diagram of the quaternary system Na2SO4-MgSO4-(NH4)2SO4-H2O showed that MgSO4·(NH4)2SO4·6H2O can be crystallized out at 60℃and Na2SO4·10H2O crystallized out at 0℃.So adjusting temperature and water amount of the mixture system can realize cycle production of Mg-N compound fertilizers and Na2SO4·10H2O.The new process is easy to operate,fast to reach phase equilibrium and can gain Mg-N compound fertilizers and Na2SO4directly.The new technology has a very important practical significance in comprehensive utilization of bloedite resources.
bloedite;ammonium sulfate;salting-out method;phase diagram
TQ113.73
A
1006-4990(2017)02-0015-04
2016-18-16
巩学敏(1979— ),女,讲师,博士,主要从事无机盐化工等方面的教学和科研工作,已公开发表文章10余篇。
国家自然科学基金资助项目(21076057)。
联系方式:gongxm1212@163.com

