系统性红斑狼疮并发难治性血小板减少患者临床特征
陈颖娟,李梦涛,曾小峰
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科, 北京 100730)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多系统受累的经典自身免疫性疾病。血液系统常受到攻击,几乎所有SLE患者在其病程某一阶段有某种血细胞损伤[1- 2]。SLE并发血小板减少(systemic lupus erythematosus associated thrombocytopenia,SLE-TCP)是血液系统损伤最常见表现,常为SLE首发症状,是与病情进展和结局相关的独立危险因素[3- 4]。根据1997年美国风湿病协会(American College of Rheumatology,ACR)修订的SLE分类标准,血小板减少定义为血小板计数至少2次低于100×109/L[5]。SLE-TCP发生率约为7%~40%,但重度SLE并发难治性血小板减少(systemic lupus erythematosus associated refractory thrombocytopenia,SLE-RTCP)不足5%[6- 7]。LUMINA研究中血小板计数低于50×109/L SLE患者例数少,未进一步分层讨论[8]。
SLE-TCP临床表现多样,可按不同角度分类。根据起病方式,SLE-TCP可分为急性和慢性;根据血小板减少程度,SLE-TCP可分为轻至中度[血小板计数为(50~100)×109/L]和重度(血小板计数低于50×109/L);根据受累系统情况,SLE-TCP可分为孤立性血小板减少和多系统受累;根据治疗效果,SLE-TCP可分为非难治和难治型。
SLE-TCP难治性定义尚无共识。“难治性”并非初始诊断,而是基于疗效的回顾性诊断。SLE-TCP具有异质性,对糖皮质激素和免疫抑制剂疗效反应差异是治疗面临的挑战[9]。部分SLE-TCP患者对治疗完全反应,血小板计数恢复正常;部分SLE-TCP患者对治疗不完全反应,血小板计数维持在(50~100)×109/L;还有一小部分SLE-TCP患者即使予以强化治疗,血小板计数仍低于50×109/L或伴有出血倾向,可归类为SLE-RTCP。Psaila等[10]定义难治性免疫性血小板减少为经治疗(药物或脾切除)血小板计数低于20×109/L,但其认为难治性定义如何涵盖特定的低血小板计数、治疗反应不完全、慢性病程、伴或不伴有出血倾向几方面仍有待讨论。本研究参考免疫性血小板减少定义和结局标准[11]将符合条件的患者归类为SLE-RTCP,回顾性分析SLE-RTCP临床特征。
对象与方法
对象
选取1998年1月至2013年12月在北京协和医院住院的SLE-RTCP患者35例,入选标准为:满足1997年美国ACR修订的SLE分类标准[5];SLE-TCP经规律糖皮质激素[初始剂量≥1 mg/(kg·d)]联合至少2种免疫抑制剂治疗后,血小板计数低于50×109/L持续至少6个月以上。根据SLE-RTCP首次出现血小板减少时的系统受累情况,分为孤立性血小板减少组(14例)和多系统受累组(21例)。
观察指标
包括性别、发病年龄、病程、首发症状、临床表现、实验室指标、系统性红斑狼疮活动性指数(systemic lupus erythematosus disease activity index,SLEDAI)评分、系统性红斑狼疮损伤指数(systemic lupus erythematosus damage index,SDI)和组间类型相互转变。
统计学处理
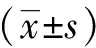
结 果
一般资料
35例SLE-RTCP患者中,孤立性血小板减少组和多系统受累组均多为女性患者[14/14(100%)vs. 19/21(90.5%),P>0.05]、年轻起病[(27.8±12.6)岁vs. (27.0±11.3)岁,P>0.05]、慢性病程[30(15~102)个月vs. 84(30~162)个月,P>0.05]、出血事件[14/14(100%)vs. 18/21(85.7%),P>0.05]常见。但与多系统受累组相比,血小板减少出现早于SLE确诊的发生率在孤立性血小板减少组更常见(64.3%vs. 14.3%,P=0.002)(表1)。
临床表现
首发症状方面,与多系统受累组相比,血小板减少为首发症状的发生率在孤立性血小板减少组中增高(100%vs. 28.6%,P=0.000),首发症状为皮肤黏膜损伤(14.3%vs. 57.1%,P=0.011)、关节炎(0%vs. 23.8%,P=0.049)的发生率在孤立性血小板减少组中降低,狼疮肾炎、神经精神狼疮、干燥综合征和发热等其他首发症状两组间差异无统计学意义。符合1997年ACR SLE分类标准方面,与多系统受累组相比,孤立性血小板减少组表现为浆膜炎(7.1%vs. 38.1%,P=0.040)、关节炎(14.3%vs. 66.7%,P=0.002)、神经系统病变(0%vs. 38.1%,P=0.009)和抗双链DNA(double-stranded DNA,dsDNA)抗体阳性(42.9%vs. 76.2%,P=0.046)减少,其他标准包括颧部红斑、盘状红斑、光过敏、口腔溃疡、血液系统病变、肾脏病变两组间差异无统计学意义。累及脏器损伤方面,与多系统受累组相比,孤立性血小板减少组骨骼肌肉损伤[2/14(14.3%)vs. 15/21(71.4%),P=0.001]减少,其他累及脏器损伤包括肾脏、神经系统、呼吸系统、心血管系统、皮肤黏膜系统等两组间差异无统计学意义。SLE-RTCP主要骨髓病变为巨核细胞成熟障碍和巨核细胞生成减少两种,分析骨髓象发现该两种骨髓病变的组间差异无统计学意义(表1)。
进展和转归
早期多系统受累组SLEDAI [5(3~12)vs. 1(1~5),P=0.007]和SDI[0(0~1)vs. 0(0~0),P=0.031]显著高于孤立性血小板减少组,晚期两组患者表现为低疾病活动评分SLEDAI [5(1~8)vs. 5(1~8),P=0.808]和损伤指数SDI [1(1~1.5)vs. 0(0~1),P=0.088]的差异无统计学意义。疾病进展过程中SLE-RTCP患者出现受累系统变化,在早期孤立性血小板减少组5/14(35.7%)进展为多系统受累,多系统受累组1/21(4.8%)转变为仅血小板减少而其他系统临床缓解(P=0.000);在晚期孤立性血小板减少组2/14(14.3%)进展为多系统受类型,而多系统受累组则20/21(95.2%)转变为仅血小板减少而其他系统临床缓解(P=0.324)。死亡率孤立性血小板减少组为1/14(7.1%,颅内出血),多系统受累组为2/21(9.5%,感染),两组间差异无统计学意义(表1、2)。

表1 SLE-RTCP孤立性血小板减少组和多系统受累组临床特征Table 1 Clinical characteristics of SLE-RTCP between isolated thrombocytopenia type and multisystem involved type
SLE:系统性红斑狼疮;SLE-RTCP:SLE并发难治性血小板减少;IQR:四分位间距;ACR:美国风湿病协会;ANA:抗核抗体;dsDNA:双链DNA;-:未进行统计学分析
讨 论
SLE-RTCP发病机制尚不明确。自身免疫机制介导SLE-TCP从外周到中枢造血的破坏,但是中枢造血系统是攻击的靶标还是始动因素存在争议,巨核前体细胞功能受损可能与SLE-RTCP相关[12]。已知,血小板由巨核细胞脱胞质形成,巨核细胞的数量和成熟程度影响了血小板的产生。SLE-RTCP临床骨髓穿刺细胞学分析提示巨核细胞成熟障碍和巨核细胞生成减少两种表现。巨核细胞成熟障碍是指骨髓巨核细胞数量正常或增多,颗粒巨核细胞增多,产板巨核细胞减少和外周血血小板减少。巨核细胞成熟障碍可能与抗血小板抗体介导血小板破坏、抗磷脂抗体/血栓性微血管病变介导血小板消耗相关[13- 15]。巨核细胞生成减少是指由于巨核细胞克隆形成受抑,导致巨核细胞数量减少或消失、血小板产生受损[16]。本研究发现该两种骨髓病变的组间差异无统计学意义,即在首次出现血小板减少时,不管骨髓病变提示巨核细胞成熟障碍还是巨核细胞生成减少在早期均不能区分两组SLE-RTCP患者。

表2 SLE-RTCP孤立性血小板减少组和多系统受累组病情进展的比较Table 2 The progress of SLE-RTCP between isolated thrombocytopenia type and multisystem involved type
SLEDAI:系统性红斑狼疮活动性指数;SDI:系统性红斑狼疮损伤指数;SLEDAI- 1:首次出现血小板减少时SLEDAI;SLEDAI- 2:病情进展到晚期SLEDAI;SDI- 1:首次出现血小板减少时SDI;SDI- 2:病情进展到晚期SDI;IQR:四分位间距
SLE-TCP临床表现多样,研究显示总体上血小板减少是与SLE病情、预后相关的主要指标。Femandez等[9,17]报道SLE-TCP常见受累系统为血液、肾脏、神经和肺。血小板减少与SLE疾病活动度、累及脏器损伤、低补体血症和死亡率相关。SLE疾病早期出现血小板减少提示疾病活动性和严重性更高。Ziakas等[18]提出血小板减少是SLE患者即将出现脏器损伤的定量和定性指标。之后Ziakas等[19]证实血小板减少与SLE终末期脏器损伤和死亡并无直接相关性,将其定义为具有较高死亡率的SLE亚群患者,血小板减少作为SLE主要并发症,影响预后。但进一步SLE-TCP分类研究结论与上述观点存在差异。Ktona等[20]认为血小板减少与疾病活动性无直接相关性,但可作为预后指标将SLE患者归类为病情可能加重。Miller等[21]将SLE-TCP患者分为急性血小板减少和慢性血小板减少两种类型,观察到慢性类型血小板减少程度与SLEDAI评分、多系统损害、糖皮质激素和免疫抑制剂治疗后疾病的缓解并不平行,而急性类型则是平行的。急性血小板减少与SLE死亡率呈正相关,可预测患者生存率[22]。一项22年随访研究表明,约3.3% SLE患者并发计数低于50×109/L的血小板减少,重度血小板减少是增加SLE脏器损伤和死亡的独立预测指标[23]。反复血小板减少可能是与疾病活动、治疗强度无关的独立表现[24]。而与疗效相关的SLE-TCP分类研究尚缺乏,亦无SLE-RTCP临床特征研究。
本研究通过将SLE-RTCP患者分成孤立性血小板减少组和多系统受累组分析SLE-RTCP临床特征。观察到两组患者均以女性为主且有年轻起病、慢性病程的特点,这符合SLE一般特点。但组间比较发现,与多系统受累组相比,血小板减少出现早于SLE确诊的发生率(64.3%vs. 14.3%,P=0.002)、血小板减少为首发症状的发生率(100%vs. 28.6%,P=0.000)在孤立性血小板减少组中常见,首发症状为皮肤黏膜损伤(14.3%vs. 57.1%,P=0.011)、关节炎(0%vs. 23.8%,P=0.049)的发生率在孤立性血小板减少组中较少见,而狼疮肾炎、神经精神狼疮、干燥综合征和发热等其他首发症状两组间差异无统计学意义。符合1997年ACR SLE分类标准方面[5],与多系统受累组相比,孤立性血小板减少组表现为浆膜炎(7.1%vs. 38.1%,P=0.040)、关节炎(14.3%vs. 66.7%,P=0.002)、神经系统病变(0%vs. 38.1%,P=0.009)和抗dsDNA抗体阳性(42.9%vs. 76.2%,P=0.046)少见,其他标准组间差异无统计学意义。疾病进展方面,与多系统受累组相比,孤立性血小板减少组累及脏器损伤中骨骼肌肉损伤[2/14(14.3%)vs. 15/21(71.4%),P=0.001]减少,其他累及脏器损伤差异无统计学意义。早期SLE-RTCP可分为孤立性血小板减少和多系统受累两种类型,疾病进展过程中SLE-RTCP患者存在受累系统变化,晚期两组患者常表现为低疾病活动评分SLEDAI [5(1~8)vs. 5(1~8),P=0.808]和损伤指数SDI [0(0~1)vs. 1(1~1.5),P=0.088],大部分SLE-RTCP转变表现为持续严重的血小板减少伴有低疾病活动评分和出血征象。
迄今SLE-RTCP多基于临床经验的个体化治疗,缺乏前瞻性随机研究。通常以大剂量糖皮质激素联合至少2种免疫抑制(包括环磷酰胺、环孢素A、长春新碱、他克莫司、硫唑嘌呤、霉酚酸酯、甲氨蝶呤、羟氯喹等)作为一线治疗,可同时或相继使用静脉丙种球蛋白或脾切除。但是SLE-RTCP患者对上述强化治疗应答不全,血小板计数仍持续低于50×109/L,伴有低SLEDAI评分和出血征象,从常见的皮肤黏膜出血到重要脏器出血(如颅内出血),而血小板减少相关的出血程度则影响预后。SLE-RTCP难治亦是相对的,研究显示利妥昔单抗介导的B细胞耗竭治疗可能是SLE-RTCP一种有效选择[25- 26]。关于SLE-RTCP治疗仍有待探索。
综上,SLE-RTCP早期可分为孤立性血小板减少和多系统受累两种类型,但最终大部分SLE-RTCP以持续的血小板减少,伴随低疾病活动评分和出血倾向为主要特征。本研究为小样本回顾性分析,需扩大样本前瞻性研究进一步证实。
[1]Keeling DM, Isenberg DA. Haematological manifestations of systemic lupus erythematosus[J]. Blood Rev,1993,7:199- 207.
[2]Bashal F. Hematological disorders in patients with systemic lupus erythematosus[J]. Open Rheumatol J,2013,7:87- 95.
[3]Li M, Zhang W, Leng X, et al. Chinese SLE Treatment and Research group (CSTAR) registry:I. Major clinical characteristics of Chinese patients with systemic lupus erythematosus[J]. Lupus, 2013,22:1192- 1199.
[4]Zhao H, Li S, Yang R. Thrombocytopenia in patients with systemic lupus erythematosus: significant in the clinical implication and prognosis[J]. Platelets, 2010,21:380- 385.
[5]Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum, 1997,40:1725.
[6]Cervera R, Khamashta MA, Font J, et al. Morbidity and mortality in systemic lupus erythematosus during a 5-year period. A multicenter prospective study of 1,000 patients. European Working Party on Systemic Lupus Erythematosus[J]. Medicine (Baltimore),1999,78:167- 175.
[7]Hepburn AL, Narat S, Mason JC. The management of peripheral blood cytopenias in systemic lupus erythematosus[J]. Rheumatology (Oxford),2010,49: 2243- 2254.
[8]Toltl LJ, Arnold DM. Pathophysiology and management of chronic immune thrombocytopenia: focusing on what matters[J]. Br J Haematol, 2011,152:52- 60.
[9]Fernandez M, Alarcon GS, Apte M, et al.Systemic lupus erythematosus in a multiethnic US cohort: XLIII. The significance of thrombocytopenia as a prognostic factor[J]. Arthritis Rheum, 2007,56:614- 621.
[10] Psaila B, Bussel JB. Refractory immune thrombocytopenic purpura: current strategies for investigation and management[J].Br J Haematol, 2008,143:16- 26.
[11] Rodeghiero F, Stasi R, Gernsheimer T, et al.Standardization of terminology, definitions and outcome criteria in immune thrombocytopenic purpura of adults and children: report from an international working group[J]. Blood, 2009,113:2386- 2393.
[12] Ziakas PD. SLE Thrombocytopenia: From Peripheral Platelet Destruction to Central Hemopoietic Defect[J].Open Hematol J, 2008,2:111- 118.
[13] Norton A, Allen DL, Murphy MF. Review: platelet alloantigens and antibodies and their clinical significance[J]. Immunohematology,2004,20:89- 102.
[14] McMillan R. Autoantibodies and autoantigens in chronic immune thrombocytopenic purpura[J]. Semin Hematol, 2000,37:239- 248.
[15] Cines DB, Liebman H, Stasi R. Pathobiology of secondary immune thrombocytopenia[J]. Semin Hematol, 2009,46: S2- 14.
[16] Nagasawa T, Sakurai T, Kashiwagi H, et al.Cell-mediated amegakaryocytic thrombocytopenia associated with systemic lupus erythematosus[J]. Blood, 1986,67:479- 483.
[17] Jallouli M, Frigui M, Marzouk S, et al.Clinical implications and prognostic significance of thrombocytopenia in Tunisian patients with systemic lupus erythematosus[J]. Lupus,2012,21:682- 687.
[18] Ziakas PD, Dafni UG, Giannouli S, et al.Thrombocytopaenia in lupus as a marker of adverse outcome—seeking Ariadne’s thread[J]. Rheumatology (Oxford), 2006,45:1261- 1265.
[19] Ziakas PD, Giannouli S, Zintzaras E, et al.Lupus thrombocytopenia: clinical implications and prognostic significance[J]. Ann Rheum Dis, 2005,64:1366- 1369.
[20] Ktona E, Barbullushi M, Backa T, et al.Evaluation of thrombocytopenia in systemic lupus erythematosus and correlation with different organs damages[J]. Mater Sociomed, 2014,26:122- 124.
[21] Miller MH, Urowitz MB, Gladman DD.The significance of thrombocytopenia in systemic lupus erythematosus[J]. Arthritis Rheum, 1983,26:1181- 1186.
[22] Patel N, Mody GM.Acute presentation of thrombocytopaenia in systemic lupus erythematosus is associated with a high mortality in South Africa[J]. Lupus, 2014,23:204- 212.
[23] Sultan SM, Begum S, Isenberg DA. Prevalence, patterns of disease and outcome in patients with systemic lupus erythematosus who develop severe haematological problems[J]. Rheumatology (Oxford), 2003,42:230- 234.
[24] Ziakas PD, Poulou LS, Giannouli S, et al.Thrombocytopenia in lupus: baseline C3 as an independent risk factor for relapse[J]. Ann Rheum Dis, 2007,66:130- 131.
[25] Fukushima T, Dong L, Sakai T, et al.Successful treatment of amegakaryocytic thrombocytopenia with anti-CD20 antibody (rituximab) in a patient with systemic lupus erythematosus[J]. Lupus,2008,17:210- 214.
[26] Chen H, Zheng W, Su J,et al.Low-dose rituximab therapy for refractory thrombocytopenia in patients with systemic lupus erythematosus--a prospective pilot study[J]. Rheumatology (Oxford), 2011,50:1640- 1644.

