玉米微孔淀粉制备止血剂研究
边文海, 刘成程, 李 倩, 王超展, 边六交
1.西北大学化学与材料科学学院, 西安 710069; 2.西北大学生命科学学院, 西安 710069
玉米微孔淀粉制备止血剂研究
边文海1§, 刘成程2§, 李 倩2, 王超展1*, 边六交2
1.西北大学化学与材料科学学院, 西安 710069; 2.西北大学生命科学学院, 西安 710069
为了制备玉米微孔淀粉止血剂,并对止血剂性能进行评价研究,采用酸酶序解法制备玉米微孔淀粉,测定其孔密度和吸水率,用动物创面出血模型检验其止血效果。研究结果显示,该方法所得微孔淀粉孔密度为3.4×104/mm2,吸水率为156.98%,无病原微生物和内毒素;兔耳创面和兔肝脏创面完全止血时间分别在140 s和80 s之内,止血迅速、牢固,优于云南白药。研究结果表明,该微孔淀粉组织相容性良好,符合生物材料安全性的要求,可望开发为新型止血材料。
玉米淀粉;微孔淀粉;止血剂;生物相容性
日常突发事故、外科手术和战争是造成人体出血的主要原因,如未及时处理或处理不当,往往危及生命[1]。临床中常用止血纱布等材料,由于止血时间较长、伤口易化脓感染和易与伤口粘附等缺点,使得其局限于实际应用。因此,快速止血和功能性止血是新型止血材料的发展方向[2]。
目前,医学上用于止血的材料主要分为沸石类、多肽类、多糖类、多糖-多肽复合类和微孔淀粉类。多孔沸石粉末止血材料,商品名为QuikClot,由美国Z-Medica公司生产[3]。该止血材料未添加任何生物成分,避免了免疫反应和物种间的疾病传播,但由于其无法被人体降解和易于放热使创口灼伤的缺点,限制了其应用。纤维蛋白敷料为多肽类止血材料的主要成分,包括纤维蛋白原粉末、钙离子和凝血酶等,其性质稳定,可被人体吸收,在内脏与动脉出血时具有良好效果,但易碎性限制了它的广泛应用[4,5]。壳聚糖为虾蟹壳中一种带正电荷的粘性多糖,与血液接触后可粘附于创口[6],吸引负电荷血细胞以促进凝血,美国HemCon公司以其为基质,发明了一种止血绷带,止血效果良好,且无毒副作用。舒宁[7]为一种壳聚糖-多肽复合止血材料,具有高效、安全、生物相容性好的特点,通过聚集红细胞和血小板促进凝血。此外,美国Medafor公司以马铃薯淀粉为基质生产了一种海绵状止血材料(TraumaDEX),可在伤口处吸收大量水分,利用血液自身凝结作用和淀粉的生物相容性达到止血效果,其缺点在于吸水的同时会使创面温度升高,不利于伤口愈合[8~10]。
随着科技的发展,人们对止血材料提出了更高的要求。新型止血材料必须具备止血迅速、抑菌抗菌、促进伤口愈合、可被人体降解及生物相容性好等特点[11,12]。多孔淀粉是一种原料来源广泛、制备工艺简便、安全无毒且可被人体降解的新型变性淀粉,可开发为止血材料,具有广阔的发展空间和市场前景,为多孔淀粉的应用提供一种新思路[13]。本研究以玉米微孔淀粉为原料,制备一种新型止血剂,并对其止血效果和生物相容性进行评估,有望为临床与生活止血提供一种新选择。
1 材料与方法
1.1 材料与试剂
玉米淀粉购自西安市淀粉厂;浓盐酸、磷酸氢二钠、柠檬酸、氢氧化钠、无水碳酸钠由国药集团化学试剂有限公司提供;α-淀粉酶(1.0×104U/g)和葡萄糖淀粉酶(1.0×105U/mL)购自西安润德生物技术有限公司;牛肉粉、蛋白胨、硫乙醇酸盐液体培养基和改良马丁氏培养基购自美国Ameresco公司;鲎试剂购自厦门鲎试剂厂;新西兰大白兔和昆明小鼠均购自第四军医大学动物实验中心;云南白药、乌拉坦、一次性注射器、医用碘伏等购自老百姓大药房。
1.2 仪器
高压灭菌锅(SS-326,日本TOMY公司),超净工作台(ZHJH-C1112C,上海智诚分析仪器制造有限公司),恒温水浴锅(HH-W21-420,天津泰斯特仪器有限公司),生化培养箱(GH4500,天津泰斯特仪器有限公司),石蜡切片机(RM2135,德国Leica公司),烘片机(HI1220,德国Leica公司),摊片机(HI1210,德国Leica公司),多功能光学显微镜(日本OLYMPUS公司)。
1.3 方法
1.3.1 玉米微孔淀粉的制备 采用实验室前期研究成果(酸酶序解法)[14]制备玉米微孔淀粉。酸处理条件为:盐酸浓度3%,淀粉乳浓度40%,反应时间70 min,反应温度50℃。酶解条件为:复合酶加入量为理论水解量的40%,反应时间18 h,反应温度40℃,pH 4.0。
1.3.2 无菌试验 在超净工作台内将多孔淀粉置于小烧杯内,加入适量无菌水,使液面浸没过多孔淀粉,然后用玻璃棒充分搅拌,使其充分吸水并使无菌水在多孔淀粉的孔隙间进出足够多的次数,用微量移液管移至倒好牛肉膏蛋白胨培养基的一次性培养皿内,用玻璃涂布器涂布后置于生化培养箱37℃下培养5 d、10 d和15 d后观察培养皿是否有菌落长出。向试管中分别加入5 mL的硫乙醇酸盐液体培养基和改良马丁氏培养基,无菌条件下分别加入适量洗涤液,将试管分别置于37℃培养箱和25℃培养箱内培养5 d、10 d和15 d后观察液体培养基是否浑浊并判断结果(实验中所用的实验器具和试剂均已灭菌)。
1.3.3 内毒素检测 浸提液的制备参照国家16886标准[15],制备多孔淀粉的浸提液。内毒素的检测参照中国药典[16]《细菌内毒素检查法》—凝胶法进行操作。
1.3.4 兔耳创面止血效果研究 将新西兰大白兔随机分为3组(每组4只):实验组(多孔淀粉组)、阳性对照组(云南白药组)和阴性对照组。将新西兰大白兔固定在解剖台上,剪去耳部绒毛,耳缘静脉消毒后缓慢注射10 mL 20%(w/V)乌拉坦溶液麻醉,然后在大白兔耳部中央动脉处用碘伏进行消毒和医用酒精进行脱碘,后做一个1 cm2大小的创口,切断中央动脉并撕下表皮。动脉血涌出后先用灭菌的医用纱布吸收,然后将0.2 g干燥的多孔淀粉或云南白药施加于创面,施压时用已灭菌的医用纱布按压止血,记录完全止血时间。实验数据采用平均值±标准差表示,统计学处理采用SPSS 17.0分析软件,组间差异采用单因素方差分析,P<0.01具有统计学意义。
1.3.5 兔肝脏创面止血效果研究 将新西兰大白兔随机分为3组(每组4只):实验组(多孔淀粉组)、阳性对照组(云南白药组)和阴性对照组。首先将新西兰大白兔固定在解剖台上,耳缘静脉消毒后缓慢注射10 mL 20%(w/V)乌拉坦溶液麻醉。剪去腹部绒毛,用碘伏进行消毒,后用医用酒精脱碘,逐层开腹并暴露肝脏。用手术刀在肝叶上做一个1 cm2创面,血液涌出后先用灭菌的医用纱布吸收,将0.2 g干燥的多孔淀粉或云南白药施加于创面,施压时用医用纱布按压止血,记录完全止血时间,以平均值±标准差表示, SPSS 17.0软件进行分析,单因素方差分析组间差异,P<0.01具有统计学意义。
1.3.6 组织相容性研究 将昆明小鼠随机分成2组,每组12只。腹腔注射2.5%戊巴比妥那麻醉后剪去右股处绒毛,用碘伏进行消毒,后用医用酒精脱碘,在右股处划出长约1 cm,深约0.5 cm的条形切口,实验组将0.2 g无菌多孔淀粉填入其中,对照组不填塞。缝合切口。各组小鼠饲养在同样条件下,分别于2 d、6 d、10 d、14 d各取3只小鼠,观察一般状况后断颈处死,切取肝脏、肾脏和右股部肌肉的组织块,厚度以5 mm左右为宜,迅速加入10%甲醛溶液,固定24 h。固定后的组织块先用自来水冲洗30 min,后进行脱水。脱水的具体方法是:将组织块投入75%乙醇25 min→85%乙醇30 min→95%乙醇30 min(2次)→无水乙醇30 min→无水乙醇25 min→无水乙醇25 min。捞出后沥干无水乙醇,立即投入至二甲苯10 min→二甲苯6 min,直至组织块达到透明为止,随后开始浸蜡,浸蜡过程温度需控制在58℃左右。具体方法是将透明的组织块从二甲苯中取出后浸入含有二甲苯的石蜡(二甲苯:石蜡为1∶3)30 min→含有二甲苯的石蜡(二甲苯:石蜡为1∶8)→纯石蜡24 h。浸蜡后取出组织块用铜制包埋框进行包埋。包埋后取出蜡块用切片机切成4 μm厚的组织,42℃条件下在摊片机上进行摊片,用载玻片捞出后置于烘片机上60℃烘烤24 h。
染色:将烘烤过的载玻片投入二甲苯15 min(2次)→无水乙醇5 min(2次)→95%乙醇5 min→90%乙醇5 min→85%乙醇5 min→80%乙醇5 min→自来水冲洗10 min→苏木精染色20 min→自来水冲洗1 min→1%盐酸乙醇分20 s→自来水冲洗1 min→1%氨水反蓝30 s→自来水冲洗1 min→伊红染色5 min→自来水冲洗30 s→85%乙醇20 s→90%乙醇25 s→95%乙醇1 min(2次)→无水乙醇2 min(2次)→二甲苯2 min(3次),后用中性树胶封片,待树胶干燥后显微镜下观察。
2 结果与分析
2.1 玉米微孔淀粉表征
计算结果表明,多孔淀粉颗粒表面小孔的孔半径为0.76 μm,孔直径为1.5 μm,小于人体血小板的平均直径(2~8 μm)。利用此多孔结构,微孔淀粉在吸收血液的同时能够阻止血小板进入其多孔结构之内,利于血小板的聚集。孔密度测定表明经酸酶序解法制备的多孔淀粉的孔密度为3.4×104个/mm2。此外,该微孔淀粉吸水率为156.98%,较单用复合酶解方法制备的多孔淀粉的吸水率提高约20%。
2.2 无菌试验结果
微孔淀粉无菌实验结果见表1,由表1可知,微孔淀粉在生产过程中经最后一步Co60照射灭菌,未检验出任何微生物。牛肉膏蛋白胨培养基是一种应用广泛的细菌培养基,含细胞生长繁殖所必需的基本营养物质,可供细菌生长繁殖之用。硫乙醇酸盐液体培养基是药典中明确规定的需氧菌检查用培养基,不但可以检查需氧菌,也可检查厌氧菌。而改良马丁氏培养基是药典中规定的用于检查真菌存在与否的培养基。因此使用上述3种培养基可以确保各种微生物都不被漏检。多孔淀粉作为一种新型的止血材料,在止血效果良好的同时还必须保证其未检测出任何病原微生物,这样才能确保其止血的安全性。

表1 多孔淀粉的无菌实验结果
2.3 内毒素检测
内毒素是革兰氏阴性菌中存在的毒性物质的总称,化学成分为有磷脂多糖-蛋白复合物。各种革兰氏阴性菌的内毒素毒性作用大致相同,可引起发热、内毒素休克、播散性血管内凝血及微循环障碍等,因此又称为“热原”。内毒素抗原性弱,耐热稳定。人体对内毒素极为敏感。微量(1~5 ng/kg)内毒素就能引起体温上升,发热反应持续约4 h后消退。因此,内毒素含量是衡量止血材料安全性的一个非常重要的指标。经检测,多孔淀粉浸提液的内毒素检测结果为阴性。高吸水性多孔淀粉的内毒素检测结果为阴性,符合止血材料安全性的要求。
2.4 兔耳创面止血效果研究
多孔淀粉和云南白药对兔耳创面完全止血时间结果如图1所示。
SPSS 17.0统计软件分析表明,在创伤处施加多孔淀粉后用医用纱布加压的止血时间与单纯用纱布加压的止血时间相比具有极显著差异(P<0.01)。在创伤处施加多孔淀粉的止血时间和施加云南白药的止血时间相比差异极显著(P<0.01)。和目前市场上广泛应用的云南白药相比,高吸水性多孔淀粉在兔耳创面的止血效果实验中能够表现出更好的止血效果。
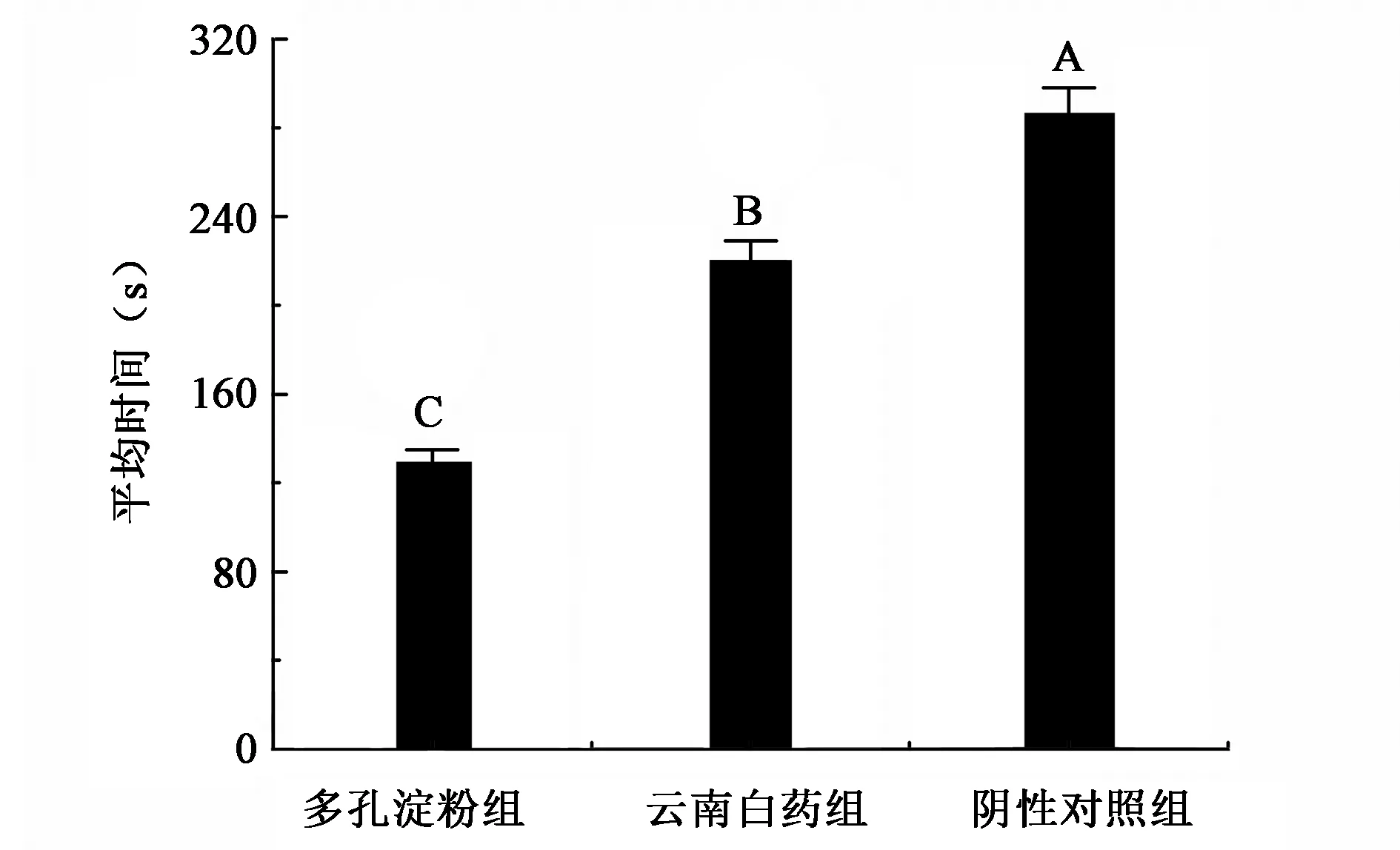
图1 不同处理兔耳创面止血时间比较Fig.1 Comparison of the hemostatic time in different treatment of the rabbit ear trauma.注:不同大写字母表示数据在P<0.01水平上有极显著性差异。
由图2(彩图见图版二)可知,在创面出血情况大致相同的情况下,多孔淀粉的颗粒间空隙和颗粒的多孔结构能够吸收大量血液,并且由于淀粉的凝胶作用,聚集的直链淀粉分子会把血液包含在部分缔合的直链淀粉网中形成凝胶体,因而止血更加牢固。而云南白药仅能依靠颗粒间的空隙吸收血液,因此止血效果不甚理想,并在血液凝固过程中伴有微量渗血现象。
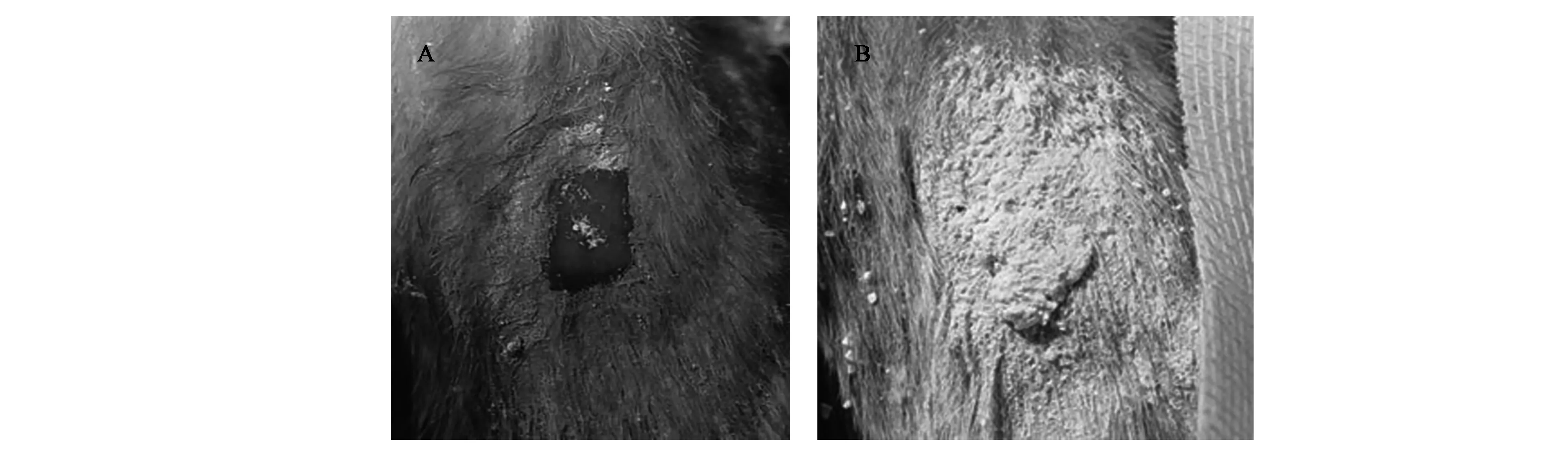
图2 不同处理兔耳创面止血效果Fig.2 The hemostasis effect of the rabbit ear trauma in different treatment.A:微孔淀粉组;B:云南白药组。(彩图见图版二)
2.5 兔肝脏创面的止血效果研究
多孔淀粉和云南白药对兔肝脏创面完全止血时间结果如图3所示。SPSS 17.0统计软件分析表明,多孔淀粉止血时间与纱布加压止血时间相比具有极显著差异(P<0.01)。在创伤处施加多孔淀粉的止血时间和施加云南白药的止血时间相比具有显著差异(P<0.01)。与目前市场上广泛应用的云南白药相比,高吸水性多孔淀粉在兔耳创面的止血实验中表现出更好的止血效果。止血时间表明,多孔淀粉对实质性脏器的止血效果更好。这是因为和动脉出血相比,脏器出血多为隐蔽的毛细血管渗血,出血速度较慢,而多孔淀粉可以紧密的粘附于创面并形成一层血痂,同时协助凝血因子发挥作用,最终达到快速止血的目的。
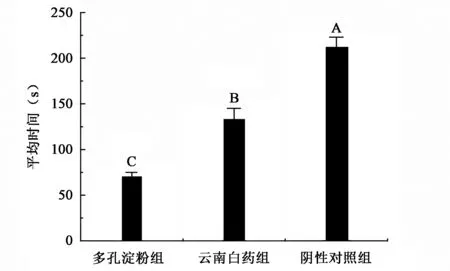
图3 不同处理兔肝脏创面止血时间比较Fig.3 The hemostatic time in different treatment of the rabbit liver trauma.注:不同大写字母表示数据在P<0.01水平上有极显著性差异。
由图4(彩图见图版二)可知,在兔肝创面的止血效果实验中,多孔淀粉组的肝脏表面干燥,这充分说明了多孔淀粉具有极强的吸水能力,多孔淀粉在与血液接触后能形成一层牢固的血痂而紧密粘附于创伤表面。而云南白药组的肝脏表面时刻伴有渗血现象,止血效果并不理想。
2.6 组织相容性结果
2.6.1 小鼠一般观察 术后小鼠毛色光亮,饮食、活动正常。右股部伤口无明显溢脓、渗血、红肿等炎症反应。手术切口处周围组织无明显化脓、积液、坏死等现象。肝脏、肾脏和未填塞组小鼠相比无明显变化。图5A(彩图见图版二)表明,在植入多孔淀粉2 d后,多孔淀粉已基本被吸收,但伴有少量炎症反应。由图5B可知,在植入多孔淀粉6 d后,多孔淀粉已全部被吸收,无明显炎症反应,手术切口处周围组织愈合情况良好。

图4 不同处理兔肝脏创面止血效果Fig.4 The hemostasis effect of the rabbit liver trauma in different treatment.A:微孔淀粉组;B:云南白药组。(彩图见图版二)
2.6.2 HE染色分析 植入淀粉2 d、6 d、10 d、14 d后肝脏、肾脏和淀粉植入处周围组织的HE染色结果如图6(彩图见图版三)所示,多孔淀粉植入2 d后基本被完全吸收并开始降解,植入组织周围有少量炎性细胞浸润,植入6 d、10 d、14 d后多孔淀粉被完全吸收,炎症反应消除,未见明显纤维细胞包膜,肝、肾组织切片未见异常。

图6 植入微孔淀粉后2 d、6 d、10 d、14 d小鼠肝脏、肾脏和伤口周围组织HE染色图Fig.6 HE stain images of rat liver, kidney and surrounding tissues of wound after administration with microporous starch for 2 days, 6 days, 10 days and 14 days.A:2 d(肝脏);B:2 d(肾脏);C:2 d(伤口周围组织);D:6 d(肝脏);E:6 d(肾脏);F:6 d(伤口周围组织);G:10 d(肝脏);H:10 d(肾脏);I:10 d(伤口周围组织);J:14 d(肝脏);K:14 d(肾脏);L:14 d(伤口周围组织)(彩图见图版三)
3 讨论
采用酸酶序解法制备微孔淀粉,吸水率为156.98%,比单用复合酶解法制备的微孔淀粉吸水率提高约20%,其浸提液未检出病原微生物,内毒素检测为阴性,表明该微孔淀粉可满足止血材料的基本要求。
兔耳创面和兔肝脏创面出血模型检验微孔淀粉止血效果,发现其止血迅速、牢固,优于云南白药。分析多孔淀粉与云南白药的止血效果的差异性,可能存在以下3方面原因:①多孔淀粉具有良好的吸附能力,能够迅速吸收血液从而起到辅助止血的作用。②多孔淀粉颗粒表面粗糙,有助于血小板的粘附和聚集,从而激活凝血机制。③多孔淀粉在较浓的淀粉悬浮液中会形成凝胶体,并形成一层血痂,阻止血液外溢。
临床中已使用的微孔淀粉基质止血剂主要为AristaTM和PerClotTM,两种止血剂均为美国进口,虽止血效果较好,但其价格昂贵,难以大范围推广使用[17,18]。杜宝堂等[19]发明了一种具有自主知识产权的微孔真空多聚糖止血微球,该微球基质为马铃薯微孔淀粉,止血效果良好,可被体内的淀粉酶酶解为单糖,生物安全性较高。该微孔淀粉需经糊化、酶解、交联、乳化等工艺制备,与本研究中使用的微孔淀粉在性能上无明显差异,但制备工艺较为复杂,其性价比有待进一步提高。
本研究采用酸酶序解法制备微孔淀粉,细胞毒性为0~1级,组织相容性良好,符合生物材料安全性的要求,有望开发为新型止血材料。
[1] Friberg L, Benson L, Lip G Y. Balancing stroke and bleeding risks in patients with atrial fibrillation and renal failure: the Swedish Atrial Fibrillation Cohort study [J]. Eur. Heart J., 2015, 36(5): 297-306.
[2] Jerome J, Graber M D, Viviane M P H,etal.. Acute inammatory reactions to hemostatic materials mimicking post-operative intracranial abscess[J]. Interdiscip. Neuro. Adv. Tech. Case. Manage, 2014,1(1): 5-7.
[3] Alam H B, Uy G B, Miller D,etal.. Comparative analysis of hemostatic agents in a swinemodel of lethal groin injury [J]. J. Trauma, 2003, 54: 1077-1082.
[4] Sondeen J L, Pusateri A E, Coppes V G,etal.. Comparison of 10 different hemostatic dressings in an aortic injury [J]. J. Trauma, 2003(54): 280-285.
[5] Zhao X, Cao X, Yuyuan M A. Hemostatic efficacy of fibrin dressing [J]. Chin. Blood Transfus, 2010,23(4): 250-252.
[6] Minami S. Mechanism of wound healing acceleration by chitin and chitosan [J]. Jan. J. Vet. Res., 1997, 44(4): 218-219.
[7] 张 妍, 杨德林, 岳 武, 等. 舒宁可溶性止血材料制备工艺研究 [J]. 哈尔滨医科大学学报, 2002, 36(1): 71-72, 84.
[8] Kurosumi S, Fukuda M. Chitin-derived sponge hemostatic material and method for producing same [P]. Europen:WO2011099087.
[9] Marques A P, Reis R L, Hunt J A. The biocompatibility of novel starch-based polymers and composites: in vitro studies [J]. Biomaterials, 2002, 23: 1471-1478.
[10] 王艳玲, 刘光万, 吴丽娟, 等. 新型淀粉基止血材料的制备及生物相容性研究[J]. 生物医学工程研究, 2015, 34(2): 102-105.
[11] 杜宝堂, 史 跃. 利用马铃薯淀粉制备止血材料方法[J]. 医疗卫生装备, 2014, 35(3): 23-25.
[12] Araujo M A, Cunha A M, Mota M. Enzymatic degradation of starch-based thermoplastic compounds used in protheses: identication of the degradation products in solution [J]. Biomaterials, 2004, 25: 2687-2693.
[13] Wu C,Wang Z,Zhi Z,etal.. Development of biodegradable porous starch foam for improving oral delivery of poorly water soluble drugs [J]. Int. J. Pharm., 2011, 403:162-169.
[14] 刘成程, 边六交, 陈 超. 酸酶序解法制备高吸水性玉米多孔淀粉的研究[J]. 化学与生物工程, 2010, 27(2): 57-61.
[15] 国家质量技术监督局. 第12 部分: 样品制备与参照样品 GB/T 16886. 12-2000 [S]. 北京:中国标准出版社, 2000.
[16] 药典编委. 中华人民共和国药典(第五版) [M]. 北京: 中国医药科技出版社, 2005.
[17] Ereth M H, Henderson J L,Schrader L M,etal.. Efficacy of microporous polysaccharide hemospheres on liver punch biopsies porcine model [J]. Anesthesiology, 2003, 99:153.
[18] Murat F J, Ereth M H, Dong Y,etal.. Evaluation of microporous polysaccharide hemospheres as a novel hemostatic agent in open partial nephrectomy: favorable experimental results in the porcine model [J]. J. Urol., 2004, 172(3): 1119-1122.
[19] 杜宝堂, 史 跃, 何远清, 等. 微孔真空多聚糖止血微球体内降解与生物安全性 [J]. 中国组织工程研究, 2015, 19(52): 8444-8449.
Research on the Hemostatic Preparation with Corn Microporous Starch
BIAN Wenhai1§, LIU Chengcheng2§, LI Qian2, WANG Chaozhan1*, BIAN Liujiao2
1.CollegeofChemistryandMaterialsScience,NorthwestUniversity,Xi′an710069,China; 2.CollegeofLifeSciences,NorthwestUniversity,Xi′an710069,China
To prepare and evaluate the hemostatic that made of corn microporous starch, a sequential hydrochloric acid and composite enzyme hydrolysis method was utilized for preparation of corn microporous starch. The density and water-absorbing ratio of the microporous starch were determined. The hemostatic effect was evaluated by animal wound hemorrhage model. Results showed that, the density and water-absorbing ratio of the microporous starch were determined to be 3.4×104/mm2and 156.98%, respectively. The microorganism and endotoxin had been picked out. The hemostatic time of the microporous starch to the rabbit ear and liver trauma were within 140 s and 80 s, and the hemostasis effect was superior to Yunnan Baiyao. The microporous starch had good biocompatibility and met the safety criterion of biomaterial. It has potential to be a promising biomaterial for hemostasis.
corn starch; microporous starch; hemostatic; biocompatibility
2016-10-29; 接受日期:2017-01-20
陕西省科技统筹创新工程计划项目(2016KTCQ02-18);陕西省科技研究发展(攻关)计划项目(2013K01-48-01)资助。
§边文海与刘成程为本文共同第一作者。边文海,本科生,主要从事微孔淀粉制备及应用研究。E-mail:837758820@qq.com。刘成程,硕士研究生,主要从事微孔淀粉制备及应用研究。*通信作者:王超展,教授,主要从事新型分离材料制备与应用及色谱分析研究。E-mail:czwang@nwu.edu.cn
10.19586/j.2095-2341.2016.0126

