禽腺病毒AH株的分离与鉴定
赵瑞宏 , 张丹俊 , 戴 银 , 沈学怀 , 潘孝成 , 胡晓苗 , 侯宏艳 , 周学利
(安徽省农业科学院畜牧兽医研究所,安徽 合肥 230031)
禽腺病毒AH株的分离与鉴定
赵瑞宏 , 张丹俊 , 戴 银 , 沈学怀 , 潘孝成 , 胡晓苗 , 侯宏艳 , 周学利
(安徽省农业科学院畜牧兽医研究所,安徽 合肥 230031)
为获得禽腺病毒毒株,将临床疑似Ⅰ群禽腺病毒感染病例的肝组织,通过接种SPF鸡胚进行病毒分离,用PCR方法对分离产物进行扩增,将PCR产物进行序列测定,对测定的序列在NCBI网上进行分析,结果显示,从病料可分离出病毒,用PCR方法特异性地扩增出了与设计片段大小相一致的片段,序列分析表明,分离株序列与禽腺病毒SD1-15分离株序列同源性99%,说明分离株为Ⅰ群禽腺病毒血清4型。
禽腺病毒 ; 分离 ; 鉴定
Ⅰ群禽腺病毒病最早于1987年发生于临近巴基斯坦卡拉奇的安格拉地区,因此又称“安格拉病”。在短短一年内,本病迅速传播到巴基斯坦地区的多数肉仔鸡群。我国1988年山东即有Ⅰ群禽腺病毒的报道[1],近两年病毒毒力增强,能引起3~6周龄鸡群发病,病死率超过30%,2015年,安徽淮北发现有鸡群感染Ⅰ群禽腺病毒,2016年蔓延至淮南、合肥等地区,现将该病实验室检验情况报告如下。
1 材料与方法
1.1 材料 UNlQ-10柱式病毒基因组DNA抽提试剂盒,购自上海生工生物工程技术服务有限公司;2×TaqMastermix和MarkerⅦ,购自天根生化科技(北京)有限公司;0.22 μm一次性滤器,购自Millipore公司;其他化学试剂均为国产分析纯。鸡胚购自山东无特定病原鸡实验种鸡场的SPF种蛋孵化至9~11日龄。20日龄SPF鸡为SPF种蛋孵化后隔离饲养。
病料采自安徽省淮北、淮南和合肥等地区的多个养鸡场发病鸡群。
1.2 方法
1.2.1 临床症状及剖检观察 记录2015年11月以来,送检至本所兽医临床诊断指导中心的发病鸡的临床症状及其病理变化。
1.2.2 细菌学检测 无菌采取病(死)鸡的肝脏、脾脏、肾脏组织,接种于普通营养琼脂、麦康凯琼脂、鲜血琼脂平板等培养基,置37 ℃温箱培养。
1.2.3 病料的采集与病毒分离[2]采集病鸡肝脏、脾脏和肾脏,按1∶4加灭菌生理盐水研磨成乳状,冻融3次,8 000 r/min离心10 min,取上清,加入终浓度为2 000 IU/mL(μg)青霉素和链霉素 37 ℃作用1 h后,0.22 μm微孔滤膜除菌。尿囊腔接种9日龄SPF鸡胚,每胚接种0.2 mL,37 ℃孵化,收集24 h~120 h死亡鸡胚的尿囊液。
1.2.4 分离毒血凝性测定 按文献[3]介绍的方法对分离的鸡胚尿囊液进行血凝性测定。
1.2.5 病毒核酸的提取 分别取200 μl死亡鸡胚尿囊液和对照鸡胚尿囊液,按UNlQ-10柱式病毒基因组DNA抽提试剂盒说明书所述方法提取病毒DNA,-20 ℃保存备用。
1.2.6 PCR检测[4]参照GenBank上登录的腺病毒SDSX-15株(登录号:KU877435.1)的序列,应用DNAStar设计引物,上游引物:5′-GATGCGCGGGTGGTCCTTC-3′,下游引物:5′-AGTTGTTGCGCACGGCTTCC-3′,由上海生工生物工程技术服务有限公司合成。
PCR扩增:取2×TaqPCR Master Mix 12.5 μL,上、下游引物(20 mmol/L)各1.0 μL,病毒DNA 2.0 μL,ddH2O 8.5 μL混匀。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。1%琼脂糖凝胶电泳分析扩增效果。
1.2.7 序列测定与比对 将PCR产物送上海生工生物工程技术服务有限公司进行测序,用BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行同源性检索。
1.2.8 动物回归试验 SPF种蛋孵化后隔离饲养至20日龄分成两组,每组10只,攻毒组经肌肉注射接种鸡胚尿囊液毒,对照组接种灭菌生理盐水,接种剂量均为0.2 mL/只。观察并记录攻毒组和对照组鸡群在接种后的精神状态、采食量和死亡情况,剖检并观察死亡鸡的病理变化。
2 结果与分析
2.1 临床特征 主要临床症状表现为:4-6周龄突然发病,精神沉郁,羽毛松乱,腹泻,贫血,消瘦,最后死亡。
剖检病变主要见于心脏和肝脏,表现心包积液,胶胨样(见中插彩版图1),肝脏肿大、质脆、易碎,有的会出现肝周炎;脾脏有白色坏死点,气管常有较多黏液,肺脏淤血,肾呈树枝状充血;有的腺胃有出血点。
2.2 病毒分离 病料接种各种培养基平板,在 37 ℃培养72 h后,均无细菌生长。病料接种鸡胚后,鸡胚在72 h后出现死亡,收集72 h~120 h死亡的鸡胚尿囊液。将此分离毒株命名为Anhui(简称AH)。
2.3 尿囊液血凝性测定 收获的鸡胚尿囊液作常规血凝试验(HA),结果显示,所收集的尿囊液均无血凝性,证明不是禽流感和新城疫等有血凝活性的病毒。
2.4 PCR检测 用腺病毒特异性的的引物进行PCR扩增,在1%琼脂糖凝胶电泳,鸡胚尿囊液和鸡病料均可见1条大小约为500 bp的特异条带(见图2)。
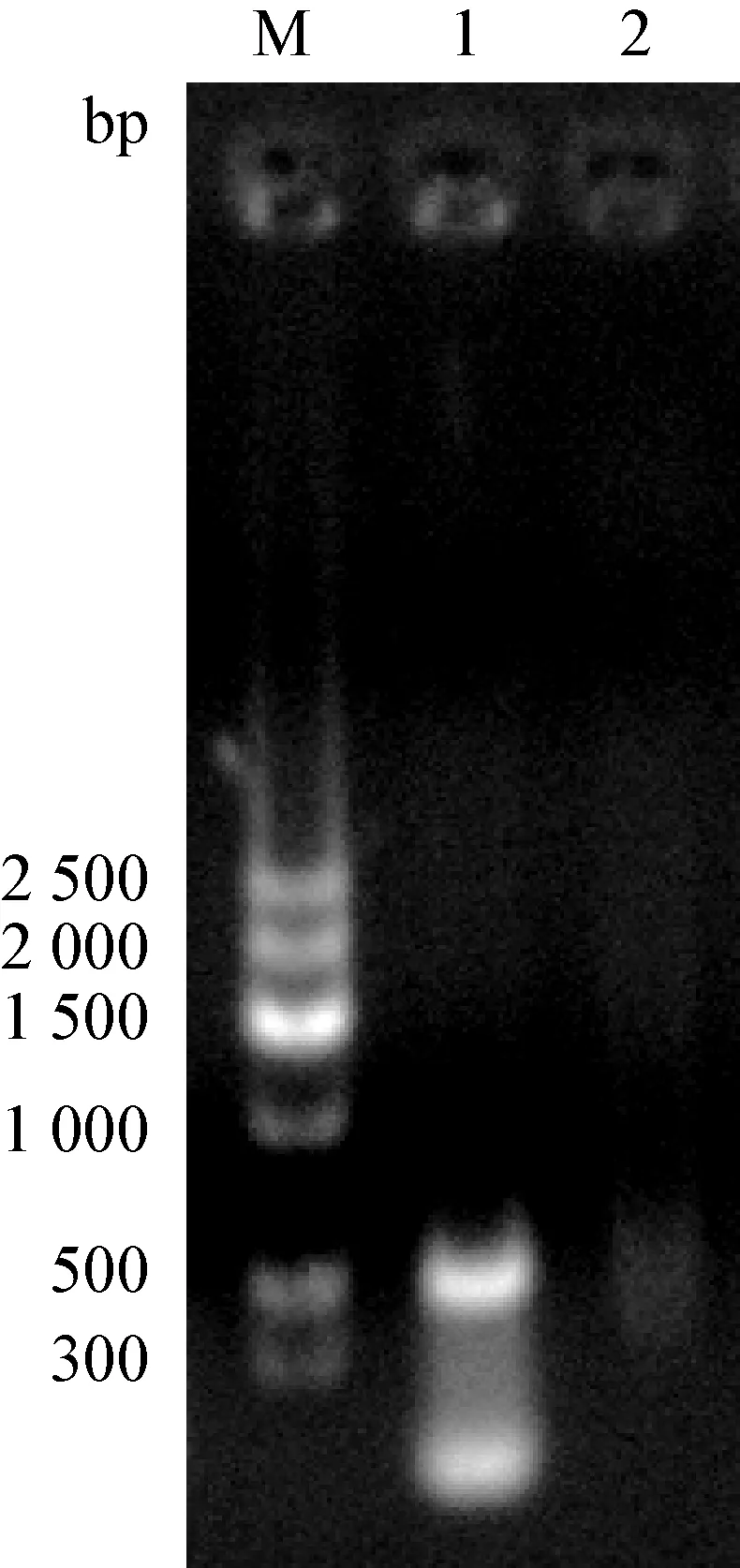
图2 PCR产物的电泳结果
2.5 序列测定与比对 将测得的基因序列用BLAST(http:// blast. ncbi.nlm.nih.gov/Blast.cgi) 进行同源性检索,结果表明,所测序列与腺病毒SD1-15株、SDXT4-15株和SDSX1株序列相似性为99%(见图3)。

图3 所测序列检索结果
2.6 动物回归试验 攻毒组鸡群第2天出现精神沉郁,羽毛蓬乱,采食量减少,第3天死亡2只,第4天死亡1只。对照组没有死亡,精神正常,采食量未发生变化。剖检死亡鸡只可见心包积液,肝肿大、淤血,呈土黄色,质脆易碎,与禽腺病毒感染鸡剖检病变一致。
3 讨论
3.1 Ⅰ群禽腺病毒能引起鹌鹑支气管炎以及鸡包涵体肝炎[5-6],也可以导致心包积水综合征(HPS),在3~5周龄的肉鸡中常出现[7-9]。Adrych K认为,禽腺病毒有可能引起人以及动物的肥胖[10-11]。我国1988年山东即有Ⅰ群禽腺病毒的报道[1],近两年病毒毒力增强,能引起3~6周龄鸡群发病,病死率超过30%,2015年蔓延至安徽淮北地区,2016年淮南、合肥等地区均有发生,本研究通过细菌培养、鸡胚接种、PCR鉴定和测序,说明所分离的病毒为Ⅰ群禽腺病毒血清4型,为Ⅰ群禽腺病毒疫苗的研制打下基础。
3.2 在引物设计时,根据邻近省份流行株进行设计,由于分离株与流行株相近,故更容易扩增出预期片段。同时由于分离株与流行株相近,用其生产灭活疫苗或培育弱毒疫苗用于免疫鸡群,将会对鸡群起到更好的保护作用。
3.3 从流行情况看,本次疫情扩散快,流行范围广,在短短半年时间内就迅速波及至全省,这也与新发病特点相符,由于鸡体内缺乏抵御新发病的中和抗体,一旦感染即会迅速传播。从送检的病例可以看出,本病一年四季均有发生,发病的主要是一些中小型企业及散养户,说明中小型企业及散养户在平时的饲养管理和生物安全方面重视不够,仍需进一步加强。
3.4 防控方面,从中国兽医药品监察所官网查询可知,针对Ⅰ群禽腺病毒的疫苗,还无生产批文。控制此病主要依靠生物安全措施:(一)控制人员和车辆流动,加强鸡场周围及人员和车辆的卫生消毒工作,努力把该病控制在鸡场之外;(二)加强饲养管理,做好常规疫苗免疫工作,提高饲料营养水平,增强鸡体的抵抗力;(三)一旦发病,要立即采取隔离消毒措施,避免病毒在鸡群中扩散。
[1] 国纪垒,I群禽腺病毒山东株的分离鉴定及其致病性研究[D].泰安:山东农业大学,2012.
[2] 赵瑞宏,侯宏艳,张丹俊,等.鸭黄病毒AH01株的分离与鉴定[J].中国兽医科学,2012,42(05):473-477.
[3] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997: 204-209,343-353.
[4] 萨姆布鲁克J,拉塞尔D W,著.分子克隆实验指南[M].黄培堂,王嘉喜,朱厚础,等译.3版.北京:科学出版社,2002:614-616.
[5] Christensen N,Saifuddin M.Aprimary epidemic of inclusion body hepatitis inbroilers[J].Avian Dis,1988,33(5):622-631.
[6] Bauer H J,Logeman K,Hauschild S,etal.Avian adeno-associated virus and fowl adenovirus: Studies of viral interactions in chicken cell cultures[J].Avian Pathol,1986,15(4):355-356.
[7] Yates V J,Fry D,Rhee Y O.Serological response of chickens exposed to a typeⅠavian adenovirus alone or incombination with the adeno-assoeiated virus[J].Avian Dis,1977,21(4):407-413.
[8] Emy K,Sheppard M,Pallister J.Immunological and molecular comparison of fowl adenovirus serotype 4 and 10 [J].Arch Virol,1995,140(4):491-501.
[9] Van Den Ende,Kipps A,Don P.The isolation in eggs of a new filtrable agent which may be the cause of bovine lumpy skin disease[J].J Gen Microbiol,1949,3(3): 174-182.
[10] Adrych K.Can obesity be infeetious[J].Przegl Lek,2005,62(9):916-8.
[11] Jaworowska A,Bazylak G.Obesity development associated with viral infections [J].Postepy Hig Med Dosw,2006,60:227-236.
IsolationandIdentificationofFowlAdenovirusAHStrain
ZHAO Rui-hong , ZHANG Dan-jun , DAI Yin , SHEN Xue-huai , PAN Xiao-cheng , HU Xiao-miao , HOU Hong-yan , ZHOU Xue-li
(Institute of Animal Husbandry and Veterinary Medicine,Anhui Academy of AgriculturalSciences, Hefei 230031,China)
In order to obtain the virus of fowl adenovirus,liver tissue collected from chicken with clinical suspected fowl adenovirus infection. we isolate virus throughinoculate collected specimens to SPF chicken embryo,and then identify the collected specimens and chicken embryo allantoic fluid using PCR. The PCR product was sequenced.The results showed that the allantoic fluid was PCR positive for duck flavivirus. The sequence was 99% identity between tested virus and fowl adenovirus 4 isolate SD1-15 hexon protein gene.This indicated that the isolated virus was fowl adenovirus.
fowl adenovirus ; isolation ; identification
ZHANG Dan-jun
S855.3
A
0529-6005(2017)10-0045-03
2016-12-19
国家蛋鸡产业技术体系合肥综合试验站项目(CARS-41-S13)
赵瑞宏(1973-),男,副研究员,硕士,主要从事畜禽传染病学研究,E-mail:zrhkdy@aliyun.com
张丹俊,E-mail: zhangdj694@sina.com

