白细胞介素-8对人肺癌A549细胞放疗敏感性的影响
阮肇扬 应可净 (浙江大学,浙江 杭州 30058)
白细胞介素-8对人肺癌A549细胞放疗敏感性的影响
阮肇扬 应可净1(浙江大学,浙江 杭州 310058)
目的探讨白细胞介素(IL)-8对人肺癌A549细胞放疗敏感性的影响。方法将A549细胞又分为对照组、照射组及IL-8组,IL-8组细胞分为三个亚组(分别用0.1、0.2、0.5 μg/ml IL-8处理)。MTT法检测各组细胞的增殖抑制率(IR),流式细胞仪检测细胞周期,Western印迹检测Caspase-3、bcl-2及bax表达水平。结果IL-8组细胞的G0/G1及S期细胞比例及bcl-2表达显著高于照射组(P<0.05),Caspase-3及bax表达水平显著低于照射组(P<0.05);0.5 μg/ml IL-8处理细胞的IR、细胞周期、Caspase-3、bax及bcl-2表达水平与0.1、0.2 μg/ml IL-8组比较差异有统计学意义(P<0.05)。结论IL-8能够降低A549细胞的放疗敏感性。
白细胞介素(IL)-8;A549细胞;放射治疗;敏感性
2004~2010年中国肺癌死亡分布及趋势分析显示,肺癌仍然是我国死亡率最高的恶性肿瘤〔1〕。老年人是肺癌发病及死亡的高危群体,患者因常合并多种基础疾病,肺癌表现不典型,诊断时已经处于中晚期,部分患者一般状态较差,既使诊断较及时也因不能耐受手术而错失治疗机会〔2,3〕。放射治疗是肺癌临床治疗的重要手段之一,但部分患者对放疗的敏感性较差,尤其以非小细胞肺癌患者多见〔4〕。随着肿瘤免疫的发展,多种细胞因子在肿瘤治疗中的作用引起广泛的注意。既往研究发现,白细胞介素(IL)-8在多种肿瘤细胞(肺癌、肝癌及乳腺癌等)的增殖及转移中发挥重要作用〔5〕。但目前关于IL-8对肺癌患者放疗敏感性的研究较少,本研究旨在探讨IL-8对人肺癌A549细胞放疗敏感性的影响。
1 材料及方法
1.1细胞 人肺癌A549细胞株由浙江大学提供。
1.2主要试剂及仪器 试剂:IL-8 1640培养液及胎牛血清(Gibco公司,美国);噻唑蓝(MTT)及二甲基亚砜(DMSO,Sigma公司,美国);碘化丙啶(PI,上海翊圣生物科技有限公司);Gel DoxTM XR+凝胶成像系统(BIO-RAD公司,美国);Caspase-3,bcl-2、bax及β-actin抗体、BCA定量及Western印迹试剂(Invitrogen公司,美国)。仪器:FCC-7000型同中心回转式60Co治疗机(山东新华医疗器械股份公司);超净无菌工作台(Spetec公司,德国);细胞培养箱(Thermo公司,美国),低速离心机(Beckman Coulter公司,美国);倒置荧光显微镜(OLYMPUS公司,日本);酶标仪(Biotek公司,美国),thermo fisher流式细胞仪(Thermo公司,美国)。
1.3实验方法
1.3.1细胞培养 按3×105个细胞/ml的密度将细胞悬液接种于96孔板培养,1 ml/孔,置于37℃,5%CO2培养箱中恒温培养,待细胞面积生长至70%~80%后传代。
1.3.2细胞分组及处理 将所有细胞分为三组:对照组、IL-8组及照射组。对照组不进行进行特殊处理,IL-8组细胞分为三个亚组,分别在培养基中加入不同浓度IL-8(0.1、0.2、0.5 μg/ml),每一组细胞设置6个复孔,IL-8组及照射组均接受X射线照射:在96孔板上加盖1.5 cm的有机玻璃,置于室温下,采用6 MV的射线处理,源皮距为100 cm,照射剂量为2 Gy(200 cGy/min)。
1.3.3细胞增殖抑制率(IR)检测 分别于24、48、72 h采用MTT检测A549细胞的情况:各组细胞处理完后去除培养基,加入RPMI1640培养液100 μl/孔及含0.5%MTT的培养液(5 μl/孔),于37℃、5%CO2培养箱中孵育4 h后弃培养液,加入100 μl DMSO原液,振荡10 min,待结晶完全溶解后用酶标仪于490 nm波长处测定吸光值(OD值),实验重复3次,IR=(1-OD处理/OD对照)×100.00%。观察不同浓度的IL-8对IR的影响。
1.3.4检测细胞周期变化 取对数生长期的细胞,制备细胞密度为3×105个/ml的单细胞悬液,将1 ml的细胞悬液置于6孔板中,细胞的分组及处理方式同1.3.2。将各组细胞于37℃、5%CO2孵育箱中培养72 h后进行细胞周期检测:去除上清液,每孔加入0.3 ml的0.25%胰蛋白酶消化120 s,收获细胞。用4℃的磷酸盐缓冲液(PBS)洗涤3次,置于70%的冷乙醇溶液中固定过夜,PI染色30 min后采用流式细胞仪检测细胞周期,计算G0/G1、G2+M期和S期细胞所占的比例。
1.3.5Western印迹检测Caspase-3,bcl-2及bax表达水平变化 24 h后,Western印迹检测对照组、IL-8组及照射组Caspase-3、bcl-2及bax表达水平。按照说明书用蛋白裂解液(含磷酸酶抑制剂)裂解30~60 min,4℃,12 000 r/min离心5 min获取总蛋白,BCA法测浓度后各取30 μg蛋白在聚丙烯酰胺凝胶电泳,100 V恒压转膜60~90 min;5%脱脂奶粉/TBST室温封闭1~2 h,Caspase-3、bcl-2及bax(稀释倍数1∶1 000)抗体4℃孵育过夜;1∶5 000 β-actin室温孵育1.5 h,TBST洗膜10 min×3次,辣根过氧化物酶标记的羊抗兔/鼠二抗室温孵育2 h,TBST洗膜10 min×2次,TBS洗膜5 min,电化学发光法(ECL)发光试剂盒色,显影,Gel Doxtm XR+凝胶成像系统成像,图像分析采用Quantity One软件,取各条带透光体积与内参条带的比值作为目标蛋白相对表达量,实验重复3次。
2 结 果
2.1各组细胞不同时刻的IR比较 对照组各时点IR均为0。与照射组相比,不同浓度IL-8处理细胞的抑制率显著降低(P<0.05)。0.5 μg/ml IL-8组细胞的抑制率低于0.2 μg/ml、0.1 μg/ml,差异具有统计学意义(P<0.05)。见表1。
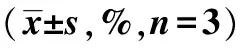
表1 各组细胞的IR比较
与照射组比较:1)P<0.05;与0.5 μg/ml组比较:2)P<0.05
2.2各组细胞的细胞周期比较 与对照组相比,照射组细胞的G0/G1及S期细胞比例显著降低,G2+M期细胞比例显著增多(P<0.05)。不同浓度的IL-8处理后,细胞的G0/G1及S期细胞比例显著高于照射组,G2+M期细胞比例低于照射组(P<0.05);0.5 μg/ml IL-8组细胞的G0/G1及S期细胞比例高于0.2、0.1 μg/ml组,G2+M期细胞比例低于0.2、0.1 μg/ml组(P<0.05),见表2。
2.3各组细胞的Caspase-3、bcl-2及bax表达水平变化 与对照组相比,照射组细胞的Caspase-3及bax表达水平显著升高,bcl-2表达水平显著降低(P<0.05)。不同浓度IL-8处理后,细胞的Caspase-3及bax表达水平低于照射组,bcl-2表达水平高于照射组(P<0.05)。0.5 μg/mlg IL-8组bcl-2水平明显高于0.2、0.1 μg/ml组,0.5 μg/ml IL-8组Caspase-3及bax水平低于0.2、0.1 μg/ml组,差异均具有统计学意义(P<0.05),见图1。
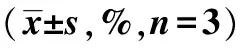
表2 各组细胞的细胞周期比较
与照射组比较:1)P<0.05

与对照组相比:1)P<0.05;与照射组相比:2)P<0.05;与IL-8 0.5 μg/ml组比较:3)P<0.05图1 各组细胞的caspase-3、bcl-2及bax表达水平变化
3 讨 论
付宝红等〔6〕研究发现,血清IL-8与老年非小细胞肺癌患者放疗效果具有明显的相关性。本研究提示放疗能够抑制A549细胞的DNA合成作用,阻止细胞周期从G1期到S期的转化过程〔7〕。bcl-2定位于线粒体外膜,能够通过多种机制发挥抗细胞凋亡的作用;bax蛋白多以非活性的单体形式分布于胞质中,只有在接收到凋亡信号刺激被激活后发生分子构象改变,移位并插入线粒体外膜后形成bax大孔道,破坏线粒体膜的完整性,并与bcl-2等抑制凋亡的蛋白对抗,阻止其抗凋亡作用。Caspase-3作为Caspase级联下游最关键的凋亡执行者,其激活在很大程度上依赖cyt-c的释放,而bcl-2家族中的bcl-2、bax基因可通过线粒体途径介导cyt-c等物质的释放。近年来研究发现,bcl-2、bax可作为Caspase-3的上游调控机制,参与对Caspase-3激活和与之相关的细胞凋亡途径的调节〔8~10〕。本研究结果说明放射治疗能够明显抑制A549细胞的增殖,促进其凋亡。
A549细胞为非小细胞肺癌细胞系。临床上,部分非小细胞肺癌患者放疗效果不佳。肿瘤放疗的敏感性与多种因素相关,本次研究中细胞均在对数期接受处理,增殖活跃的细胞对射线敏感性优于增殖较慢的细胞;且离体培养细胞呈贴壁生长,与射线接触较为充分,故非小细胞肺癌细胞系放疗的敏感性较好〔11,12〕。
不同浓度的IL-8呈时间-剂量依赖效应降低射线对A549细胞增殖的抑制作用。上述研究说明IL-8能够降低人肺癌A549细胞对放疗的敏感性。IL-8作为常见的细胞趋化因子,不仅能促进中性粒细胞、白细胞及血管内皮细胞的迁移,在肿瘤细胞的浸润及转移中也发挥重要作用〔13〕。既往研究发现,肺癌患者血清中的IL-8水平显著高于正常人群,患者IL-8水平与肿瘤血管密度、病理分型及临床分期具有重要相关性,IL-8与肿瘤细胞表面特异性受体结合,激活下游信号分子,发挥促进肿瘤细胞增殖及血管新生的作用。但IL-8影响肿瘤细胞放疗敏感性的具体机制有待于更加深入的研究〔14,15〕。
综上所述,IL-8能够降低A549细胞的放疗敏感性,且呈剂量依赖效应。
1屈若祎,周宝森.2004~2010年中国肺癌死亡分布及趋势分析〔J〕.中国卫生统计,2014;31(6):932-5.
2陈永利,陈艳玲,汪建中,等.老年非小细胞肺癌患者放疗同期化疗与手术疗法的预后分析〔J〕.中国老年学杂志,2015;35(5):1167-9.
3刘博宇,孙志强,李玉平,等.放射治疗局部晚期非小细胞肺癌的研究进展〔J〕.中国老年学杂志,2014;34(23):6827-30.
4刘晓晴.第15届世界肺癌大会非小细胞肺癌放疗研究进展〔J〕.肿瘤研究与临床,2014;26(2):73-5.
5鲁克庆,马宝良,佘东立,等.IL-8与肿瘤的研究进展〔J〕.实用医学杂志,2015;32(19):3269-71.
6付宝红,关 玲,付占昭,等.老年非小细胞肺癌患者血清VEGF、IL-8水平与放疗疗效的相关性〔J〕.中国煤炭工业医学杂志,2016;19(7):1005-7.
7夏 晖,于长海,张宜明,等.肿瘤坏死因子-α对人肺癌A549细胞的放疗增敏作用〔J〕.南方医科大学学报,2012;32(4):565-8.
8刘郁东,郑启新,吴宏斌,等.雷帕霉素对不同肿瘤细胞Bax/Bcl-2和活性caspase-3表达的影响〔J〕.肿瘤,2013;33(2):138-43,163.
9李 蓉,章运生,谭小武,等.黄芪多糖联合顺铂对人肺癌A549细胞增殖抑制作用及其机制研究〔J〕.现代医药卫生,2015;(4):481-4.
10刘 华,王小军.HPS-1对人肺腺癌A549细胞凋亡诱导作用的机制研究〔J〕.国际呼吸杂志,2017;37(2):102-6.
11梁 雁.综合治疗局限期小细胞肺癌的临床观察〔J〕.实用癌症杂志,2013;28(4):427-9.
12张木根,陈 鹏.综合治疗对局限期小细胞肺癌患者的疗效及预后影响因素〔J〕.中国老年学杂志,2013;33(12):2897-8.
13惠 烨.IL-8、IL-6评价非小细胞肺癌化疗效果的研究〔D〕.南京:东南大学,2014.
14尹德刚.白细胞介素8在肺腺癌中的异常表达及其临床意义〔D〕.杭州:浙江大学,2015.
15马钟铃,秦思达,张伯翔,等.非小细胞肺癌中IL-8与MCP-1的表达及其临床意义〔J〕.现代肿瘤医学,2016;24(3):394-7.
R734.2
A
1005-9202(2017)24-6011-03;
10.3969/j.issn.1005-9202.2017.24.003
1 浙江大学医学院附属邵逸夫医院呼吸内科
阮肇扬(1979-),男,主治医师,主要从事呼吸系统疾病研究。
〔2017-07-13修回〕
(编辑 李相军)

