枸杞多糖对癫痫大鼠神经的保护作用及机制
冯 云 刘 津 唐海丹 黄晓华 陈海燕 苏 丽
(右江民族医学院附属医院神经内科,广西 百色 533000)
枸杞多糖对癫痫大鼠神经的保护作用及机制
冯 云 刘 津 唐海丹 黄晓华 陈海燕 苏 丽
(右江民族医学院附属医院神经内科,广西 百色 533000)
目的探讨枸杞多糖(LBP)对癫痫大鼠神经细胞的保护作用。方法选择健康5周龄雄性SD大鼠75只,随机分为对照组、癫痫组和LBP干预组各25只,LBP干预组灌服50 mg/kg LBP,癫痫组和LBP干预组大鼠癫痫模型制备采用腹腔注射氯化锂-匹罗卡品法,对照组给予等剂量生理盐水。大鼠海马组织由溴脱氧尿嘧啶核苷(BrdU)标记,并进行免疫荧光染色,对比各组BrdU阳性细胞数量、抗兔微管相关蛋白(MAP)-2及抗小鼠神经元核抗原(NeuN)阳性神经元细胞周长及分化率。结果与对照组相比,癫痫组BrdU阳性细胞数量显著增加(P<0.05);LBP干预组BrdU阳性细胞数低于癫痫组(P<0.05);癫痫组大鼠MAP-2、NeuN阳性神经元周长及分化率低于对照组(P<0.05),LBP干预组大鼠MAP-2、NeuN阳性神经元周长及分化率显著高于癫痫组(P<0.05)。结论LBP对癫痫模型大鼠进行干预后,大鼠海马齿状回颗粒层BrdU阳性细胞数、MAP-2和NeuN阳性神经元细胞表达均出现一定程度改善,具有较好的神经保护作用。
癫痫;枸杞多糖;NeuN阳性神经元
有研究〔1〕报道在生长发育阶段若存在癫痫长期反复发作或是癫痫持续状态,可导致个体存在语言、记忆甚至学习等认知功能障碍。病理生理学研究证实〔2〕,在癫痫发作情况下,能够导致海马神经出现异常。枸杞是一种中医滋补药材,富含多种营养成分、微量元素,其中重要的一种有效成分是枸杞多糖(LBP)。LBP能够发挥降血脂、降血糖、抗氧化及抗肿瘤等作用,还能有效保护神经系统,并对损伤的神经起到一定修复作用〔3〕。本研究旨在探讨LBP对癫痫大鼠神经细胞的作用,分析LBP对海马神经元相关保护机制。
1 材料和方法
1.1材料
1.1.1实验动物 选择健康清洁级雄性SD大鼠75只,体重(200.1±15.5)g(宁夏医科大学动物中心提供)。大鼠饲养每笼放置2只,室内温度控制在(20.5±1.2)℃,相对湿度控制在(50.3±5.1)%,饮食饮水均进行标准化供给,所有SD实验大鼠均先适应性喂养1 w。将实验大鼠进行随机均衡分组,分为对照组、癫痫组及LBP干预组,各25只。
1.1.2主要设备和试剂 HM650V振动切片机(Microm公司提供);激光荧光显微镜(Olympus公司提供);培养板、培养箱等。主要试剂包括氯化锂、溴化甲基阿托品、阿托品、地西泮、苯巴比妥(天津市化学试剂研究所提供);匹罗卡品、溴脱氧尿嘧啶(BrdU),Sigma公司提供;小鼠抗大鼠BrdU (Immunologicals Direect公司提供);抗兔微管相关蛋白(MAP)-2多克隆抗体(购自Chemicon公司);抗小鼠神经元核抗原(NeuN)单克隆抗体(购自Millipore公司);DMEM/F12(1∶1)无血清培养液;磷酸盐缓冲液(PBS,pH7.2 )。
1.2方法
1.2.1癫痫模型 制备癫痫模型采用经典的氯化锂-匹罗卡品注射法〔4〕:腹腔注射浓度为127 mg/kg的氯化锂,12 h后进行10 mg/kg溴化甲基阿托品腹腔注射,注射完成后30 min进行(100 ±5)mg/kg剂量的匹罗卡品腹腔注射。若大鼠痫性持续发作时间超过1 h,或大鼠出现严重抽搐至濒危状态,则需要腹腔注射4 mg/kg地西泮、1 mg/kg阿托品 或25 mg/kg苯巴比妥,直至痫性解除。经典癫痫发作标准〔4〕分为6级:0级:实验大鼠无任何异常反应;Ⅰ级:大鼠出现面部节律性抽动;Ⅱ级:大鼠出现甩尾或是点头动作;Ⅲ级:大鼠某一肢体出现抽动动作;Ⅳ级:大鼠躯体僵直或是四肢抽动;V级:大鼠完全僵直,并出现阵挛。大鼠癫痫发作在Ⅳ级以上,且发作解除后状态良好,可判断为合格癫痫大鼠模型。对照组则采用等量生理盐水替代氯化锂-匹罗卡品,其他处理方式与癫痫组相同。癫痫组、LBP干预组实验均选择等级在Ⅳ级以上的大鼠。LBP干预组采用LBP(宁夏启元药业有限公司,批号:040603)50 mg/kg灌服,并在造模后持续灌服2 w。
1.2.2BrdU标记处理 所有大鼠在进行末次相关操作后24 h进行BrdU腹腔注射〔5〕,剂量为100 mg/kg,注射后24 h采用4%多聚甲醛PB液150 ml对大鼠进行灌注,直至大鼠全身呈僵硬状。把大鼠处死后,取脑,放入相同固定液固定24 h,再把大脑置于PB液(含10%~20%蔗糖)中,4℃环境中过夜,直至沉底。取出样本后置于冠状位,切取1~2 mm3大脑中海马组织,并由浓度为0.01 mol/L的PBS配制成5%琼脂,并用其固定海马组织切片,厚度50 μm,每只连续取片10张。
1.2.3免疫荧光染色 将各组大鼠海马组织切片进行PBS漂洗,每次10 min,并漂洗3次,采用2N-HCl在37℃环境中进行抗原修复,持续30 min,后用0.1 mol/L硼酸缓冲液(pH8.5)冲洗10 min,PBS漂洗2次,分别持续10 min,大鼠BrdU以1∶500比例加入0.01 mol/L胎牛血清(BSA)-PBS,置于4℃冰箱内过夜,再进行3次PBS漂洗,每次10 min。将0.01 mol/L BSA-PBS内加入比例为1∶200标记了Cy3的猴抗大鼠IgG,常温下再孵育1 h,随后采用PBS漂洗干净后,甘油封片。 MAP-2/NeuN免疫荧光染色:常规漂洗、固定、清洗后加入含10%山羊血清的抗体稀释液(pH7.4),4℃环境下行2 h封闭,封闭液清洗后,加入200 μl 1∶1 000稀释的MAP-2多克隆抗体、200 μl 1∶500 NeuN单克隆抗体,室温下轻摇1 h,随后置于4℃冰箱中12 h。设定激光共聚焦显微镜波长,从X、Y、Z轴三个方向进行观察。
1.2.4观察指标 分析海马神经干细胞向MAP-2阳性神经元、NeuN阳性星形胶质细胞分化等情况,统计增殖细胞的数量,采用Leica Qiwn Plus软件分析MAP-2/NeuN阳性神经元的周长及分化率。癫痫发作情况下,位于海马齿状回内的BrdU阳性细胞出现红色荧光,计算BrdU阳性细胞数量。
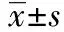
2 结 果
2.1BrdU阳性细胞数 三组大鼠BrdU阳性颗粒细胞数之间的差异具有统计学意义(P<0.05)。与对照组〔(20.23±7.96)个〕相比,癫痫组大鼠、LBP干预组BrdU阳性细胞数〔(32.42±8.43)个,(23.58±6.98)个〕显著增加(P<0.05)。与癫痫组相比,LBP干预组BrdU阳性细胞数显著降低(P<0.05)。见图1。
2.2MAP-2阳性神经元周长及分化率 三组大鼠MAP-2阳性神经元周长及分化率的差异具有统计学意义(P<0.05)。LBP干预组、对照组大鼠MAP-2阳性神经元周长及分化率高于癫痫组,且LBP干预组高于对照组,差异有统计学意义(P<0.05)。见表1,图2。
2.3NeuN阳性神经元表达情况及分化率 三组大鼠的NeuN阳性神经元周长和NeuN阳性神经元分化率之间的差异有统计学意义(P<0.05)。LBP干预组、对照组大鼠NeuN阳性神经元周长及分化率高于癫痫组,且LBP干预组高于对照组,差异有统计学意义(P<0.05)。见表2,图3。
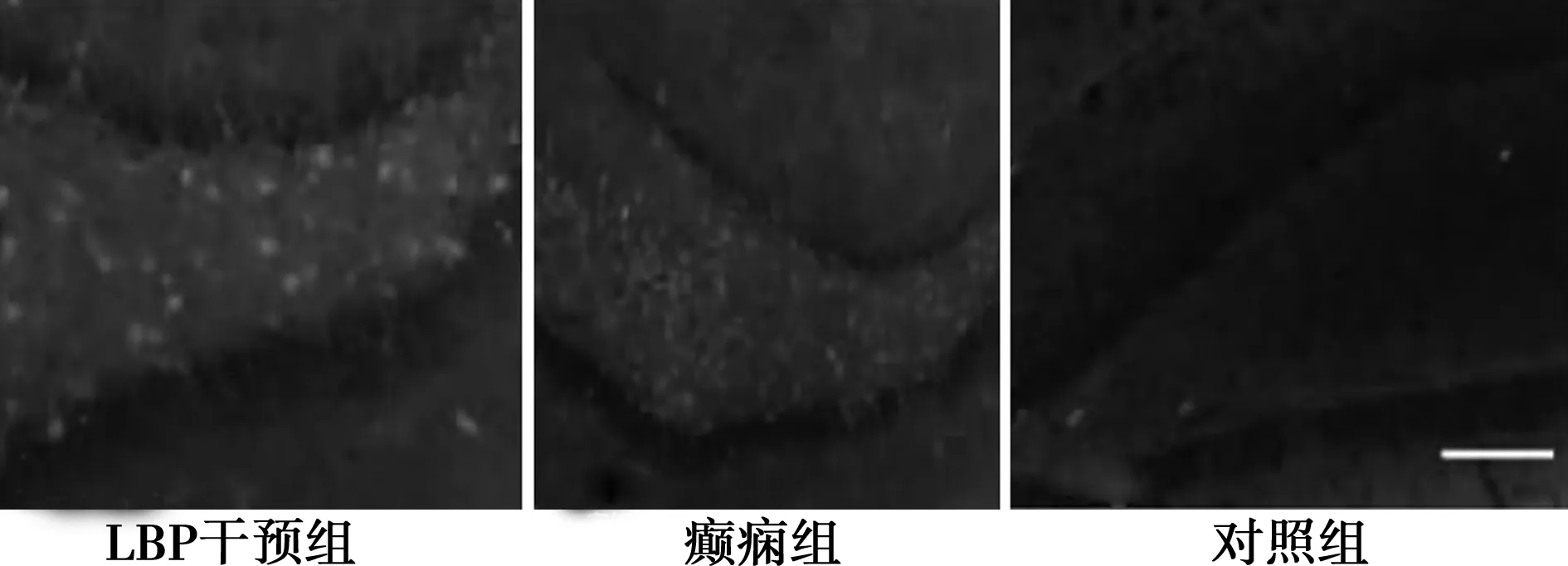
图1 BrdU阳性细胞免疫荧光染色(×50)
图2 MAP-2阳性神经元免疫荧光染色(×50)
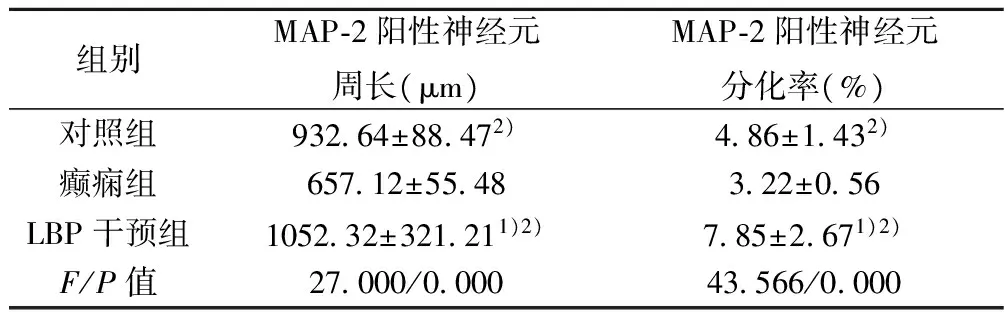
组别MAP⁃2阳性神经元周长(μm)MAP⁃2阳性神经元分化率(%)对照组93264±88472)486±1432)癫痫组65712±5548322±056LBP干预组105232±321211)2)785±2671)2)F/P值27000/000043566/0000
与对照组比较:1)P<0.05;与癫痫组比较:2)P<0.05;下表同

图3 NeuN阳性神经元免疫荧光染色(×50)
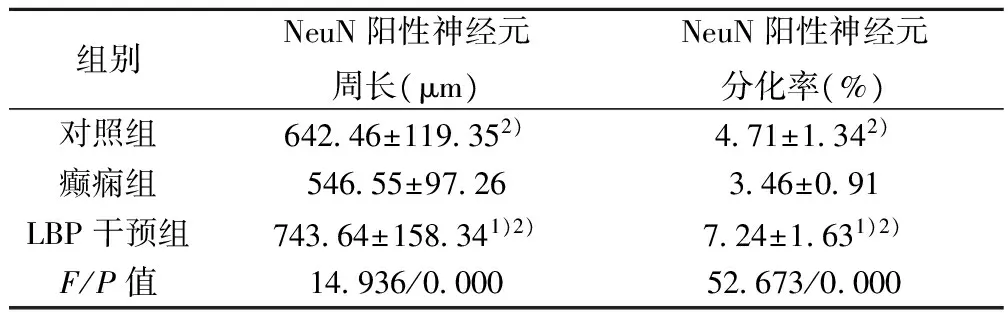
组别NeuN阳性神经元周长(μm)NeuN阳性神经元分化率(%)对照组64246±119352)471±1342)癫痫组54655±9726346±091LBP干预组74364±158341)2)724±1631)2)F/P值14936/000052673/0000
3 讨 论
癫痫易导致患者出现认知障碍,记忆、学习、语言等功能受到损害,其发生发展机制尚未完全确认,治疗也缺少金标准〔6〕。研究〔7〕表明,癫痫发作与大脑内海马存在密切关系,动物模型实验结果也证实海马神经在癫痫发生发展过程中起到一定作用,在癫痫发病早期进行海马神经干预尤为重要。枸杞子作为一种传统中药,具有味甘性平等特性,发挥明目养肝、补髓滋肾及祛风等作用。研究表明〔8〕,枸杞中含有主要成分LBP,LBP具有抗氧化、免疫调节、抗衰老、抗肿瘤等多种生物活性作用。尤其近年来对神经保护生物活性研究成为热点,但对于这种保护作用机制并不是有深入明确的研究,且LBP属于天然药物提取物,安全易吸收、价格低廉、易透过血脑屏障,若可以利用LBP的保护神经作用作为治疗神经损伤相关疾病的辅助措施,对癫痫等神经功能性疾病的研究具有重要的意义。有研究结果证实〔9〕,LBP能够对大鼠锰中毒后神经发生数量进行有效干预,从而对小鼠记忆、学习能力起到改善作用,与本文结果一致。
本次实验结果表明,大鼠癫痫发病后,海马齿状回颗粒细胞层的相关神经细胞数目高于对照组,LBP干预组在癫痫模型制作前进行干预,干预完成后齿状回颗粒层细胞增生水平显著降低。出现这种现象的原因是癫痫一旦发作,会导致海马神经异常;LBP具有保护神经细胞的作用,LBP干预后在抑制乳酸脱氢酶释放的同时,还可以下调caspase-3的活性,降低神经细胞的凋亡率;进行LBP干预后,海马神经干细胞向 MAP-2/NeuN阳性神经元分化,LBP干预组细胞周长及分化率均显著高于癫痫组。对实验结果进行分析,癫痫发病机制主要与大脑内氧自由基过高导致的神经元脱失有关〔10〕。LBP易进入血脑屏障,提高实验大鼠体内谷胱甘肽过氧化物酶(GSH-Px)及超氧化物歧化酶(SOD)活性,调节氧化应激状态,通过P38MAPK途径有效抑制诱导神经细胞的凋亡,从而可以清除过量的自由基〔11〕;降低脂质过氧化水平,保证神经细胞结构与功能的完整性,促进海马神经干细胞转化为 MAP-2/NeuN阳性神经元,修复损伤的神经元等,降低对损伤认知功能的程度,减轻记忆、学习等认知功能障碍情况〔12〕。综上所述,LBP能够有效保护大脑内神经细胞,减轻神经元凋亡,对癫痫、阿尔茨海默病等疾病引起的神经元损伤或异常增生起到干预作用;LBP可以通过清除大脑内自由基,降低脂质过氧化,而促进认知功能。本研究的不足之处在于只对大鼠进行了相关研究,并未在其他的动物中重现实验结果,最重要的是未真正在人体上进行研究,但是依然为临床上治疗癫痫提供了理论依据,为更好地治疗癫痫奠定基础。
1罗亚坤,程 燕,冯玉萍,等.枸杞多糖对2型糖尿病大鼠免疫功能影响的研究〔J〕.中医药信息,2014;31(1):13-6.
2董 静,单铁英,潘秀兰,等.枸杞多糖对大鼠脑胶质瘤细胞株C6增殖及凋亡的影响〔J〕.医学临床研究,2015;32(8):1610-2.
3李军凯,许 文,刘 燕,等.枸杞多糖对肝癌患者血清AFP、PHCA、VEGF及CTGF水平的影响〔J〕.现代生物医学进展,2015;15(25):4912-5.
4Ren M,Li K,Wang D,etal.Neurofibromin regulates seizure attacks in the rat pilocarpine-induced model of epilepsy〔J〕.Mol Neurobiol,2016;53(9):6069-77.
5钟莲梅,艾青龙,郭家智,等.匹罗卡品诱导癫痫大鼠模型小胶质细胞的激活与极化〔J〕.昆明医科大学学报,2016;37(5):1-4.
6Fu P,Wen Y,Xiong Y,etal.Abnormal expression of FBXL20 in refractory epilepsy patients and a pilocarpine-induced rat model〔J〕.Neurochem Res,2016;41(11):3020-31.
7刘 震,周 艳,杨 艺,等.CASK在癫痫大鼠模型中影响癫痫发作的机制研究〔J〕.中华神经医学杂志,2015;14(6):591-6.
8Bar-Klein G,Klee R,Brandt C,etal.Isoflurane prevents acquired epilepsy in rat models of temporal lobe epilepsy〔J〕.Ann Neurol,2016;80(6):896-908.
9刘 波,丁协刚,赵颀涵,等.枸杞多糖对大鼠海绵体神经钳夹损伤的修复作用〔J〕.中华实验外科杂志,2013;30(12):2560-2.
10葛建彬,卢红建,宋新建,等.枸杞多糖对小鼠脑缺血再灌注损伤的保护作用及其抗氧化应激的机制研究〔J〕.中风与神经疾病杂志,2016;33(9):790-4.
11吴彩霞,王腾飞,余建强,等.枸杞多糖预处理对小鼠脑缺血-再灌注损伤的保护作用〔J〕.中药材,2015;38(7):1454-9.
12董淑楠,朱柯蕙,印 虹,等.枸杞多糖的理化性质及其免疫调节研究进展〔J〕.中国医药生物技术,2013;8(1):66-8.
R749
A
1005-9202(2017)24-6036-03;
10.3969/j.issn.1005-9202.2017.24.014
冯 云(1982-),女,硕士,主治医师,主要从事神经病学研究。
〔2017-01-17修回〕
(编辑 袁左鸣)

