七氟烷对人脑胶质瘤细胞侵袭迁移能力的影响及相关机制
谢小娟 樊冬梅 马立刚 宋绍团 孔金玉 李前辉 郭孝龙
(河南科技大学第一附属医院麻醉科,河南 洛阳 471300)
七氟烷对人脑胶质瘤细胞侵袭迁移能力的影响及相关机制
谢小娟 樊冬梅1马立刚 宋绍团 孔金玉2李前辉 郭孝龙
(河南科技大学第一附属医院麻醉科,河南 洛阳 471300)
目的探讨七氟烷对人脑胶质瘤细胞侵袭迁移能力的影响及相关机制。方法接种对数生长期的人脑胶质瘤细胞U251于培养皿中,细胞传代后分为对照组及七氟烷组。对照组通入含5%CO2及95%的空气,七氟烷组通入5%CO2及92.5%的空气和2.5%七氟烷,气流量为2 L/min,处理4 h。Transwell侵袭实验检测两组细胞侵袭能力的变化,细胞划痕修复实验检测细胞迁移能力,Western印迹检测两组细胞上皮间充质转化(EMT)相关分子〔包括E-钙黏蛋白(cadherin)、N-cadherin、snail及紧密连接蛋白(Zo)-1〕、肿瘤干细胞相关分子(包括CD133)及侵袭相关分子〔包括基质金属蛋白酶(MMP)-2、MMP-9〕表达的变化。结果七氟烷组穿透基底膜细胞数显著低于对照组(P<0.05)。七氟烷组细胞24 h后划痕修复面积差显著低于对照组(P<0.05)。七氟烷组相比对照组细胞E-cadherin及Zo-1表达显著上调,N-cadherin、snail、CD133、MMP-2及MMP-9表达显著下调(P<0.01)。结论七氟烷可显著抑制人脑胶质瘤细胞的侵袭迁移能力,相关机制可能与其对细胞干性、EMT及MMP的抑制作用有关。
七氟烷;人脑胶质瘤;侵袭及迁移;上皮间充质转化;肿瘤干细胞
人脑胶质瘤是常见的中枢神经系统原发性肿瘤,发病率约占全部中枢神经系统肿瘤的40%〔1〕。手术切除原发病灶联合术后放化疗是治疗脑胶质瘤最有效的方式之一,但由于脑组织功能及结构的限制及肿瘤细胞放化疗抵抗的形成,绝大多数患者难以根治进而复发,导致患者5年生存率低于5%〔2〕。七氟烷具有保护脑功能的作用〔3〕,是颅脑手术中常用的吸入性麻醉剂。研究显示七氟烷可影响多种恶性肿瘤的侵袭迁移能力〔4〕,但其对人脑胶质瘤细胞的影响及相关机制尚不明确。本研究通过体外实验探究七氟烷与人脑胶质瘤细胞U251侵袭迁移能力的关系及其对侵袭迁移能力相关分子的影响。
1 材料与方法
1.1实验细胞 人脑胶质瘤细胞U251来自美国模式菌种收集中心(ATCC),由国内北纳生物公司提供。
1.2实验仪器 ECO1.8超净工作台、Forma3110生化培养箱(美国Thermo Scientific公司);DM500显微镜(德国Leica公司);3-16KL高速冷冻离心机(德国Sigma公司);电泳仪、转膜仪及GelDoc XR凝胶成像仪(美国Bio-Rad公司);麻醉气体监测仪(德国Drager公司),Aestiva7900型麻醉机、七氟烷挥发罐(美国GE Datex-Ohmeda公司);10、100 μl、1 ml移液器(德国Eppendorf公司)。
1.3实验耗材 6孔板、Transwell小室、6 cm培养皿(美国Corning公司),各规格移液枪头(美国Invitrogen公司),1.5 ml离心管(德国Sigma公司),15 ml离心管(中国NEST公司),聚偏氟乙烯膜(PVDF膜,德国Millipore公司)等。
1.4实验试剂 七氟烷(批号:161226,日本Maruishi Pharmaceutical公司),RPMI1640培养基及胎牛血清(BSA,美国Thermo Scientific公司),30%聚丙烯酰胺(美国Thermo Scientific公司),四甲基乙二胺、乙二胺四乙酸(EDTA)胰蛋白酶(德国Sigma公司),无核酶水(美国Invitrogen公司),十二烷基硫酸钠及甲醇(国药集团化学试剂有限公司),过硫酸铵(中国上海Yeasen公司),细胞裂解液、二喹啉甲酸(BCA)蛋白浓度测定试剂盒及化学增强发光法(ECL)发光显色液(中国碧云天公司)等,蛋白酶抑制剂cocktail及蛋白marker(日本Takara公司)。抗体购自美国abcam公司,E-钙黏蛋白(cadherin)抗体(ab15148),N-cadherin抗体(ab18203),snail抗体(ad180714),CD133抗体(ab19898),基质金属蛋白酶(MMP)-2抗体(ab37150),MMP-9抗体(ab73734),β-Actin(M ab8226),鼠二抗(ab6728),兔二抗(ab150077)。
1.5实验方法
1.5.1细胞培养及分组 将3碟同一来源培养于10 cm培养皿中融合度为80%以上的U251细胞使用500 μl胰蛋白酶消化3 min,以1.5 ml/碟含10% BSA的RPMI1640培养基终止消化,其中2碟传代至另外2碟10 cm培养皿中,得到4碟10 cm培养皿的U251细胞,另外1碟细胞计数,以5×105/孔在2块6孔板中进行种板。24 h细胞贴壁且6孔板细胞长满后对4碟细胞进行编号,随机数字表法将4碟细胞平均分为两组,对照组细胞在通入含5%CO2及95%空气的气体环境下培养4 h,七氟烷组细胞在通入5%CO2及92.5%的空气和2.5%七氟烷的气体环境下培养4 h,处理完成后进行后续实验。
1.5.2Transwell侵袭实验检测细胞侵袭能力 用50 mg/L,1∶8的Matrigel胶稀释液包被Transwell小室底的上室面,4℃风干。风干后吸出残余液体,50 μl含10 g/L的BSA无血清培养液,生化培养箱中37℃放置30 min水化基底膜。将处理好的两组细胞胰酶消化并重悬,1 ml含10% BSA的RPMI1640培养基终止消化后转移至1.5 ml离心管,500 r/min室温离心5 min,去上清后磷酸盐缓冲液(PBS)洗3次,1% BSA无血清培养液重悬并进行细胞计数,取200 μl,5×105/孔细胞加入Transwell上小室,下小室加入600 μl 10% BSA的RPMI1640培养基,置于生化培养箱中37℃,5%CO2培养24 h。10%甲醇固定10 min,0.1%结晶紫染色10 min后,洗净结晶紫,光镜下细胞计数,200倍光镜下观察膜背面侵袭的细胞数,随机统计从中间和四周5个视野的总数,重复3次,求其平均值及标准差。
1.5.3细胞划痕修复实验检测细胞迁移能力 将6孔板中处理好的两组细胞含10% BSA的RPMI1640培养基弃去,5 ml PBS洗2次,100 μl移液枪头垂直水平面进行划痕,每孔3~5条,再次5 ml PBS洗2次后加入无血清RPMI1640培养基培养过夜,于0、12 h进行拍照。ImageJ软件对细胞12 h前后的划痕面积占视野的百分比进行计算,取同一视野12 h前后面积的差值(△S),对照组细胞△S为△S0,七氟烷组为△S1,重复5个视野计算平均值及标准差。
1.5.4Western印迹检测细胞相关蛋白的表达 收集10 cm培养皿中处理好的两组细胞,500 μl胰蛋白酶消化3 min,1 ml含10% BSA的RPMI1640培养基终止消化后转移至1.5 ml离心管中,500 r/min离心5 min,去上清液,PBS洗2次,加入500 μl细胞裂解液及55 μl 10×cocktail,冰上进行裂解2 h后,最大转速16 000 r/min,4℃离心15 min,收集上清液于新的1.5 ml离心管中,使用BCA试剂盒进行蛋白定量分析,和上样缓冲液混合并配平体系,每孔上样量50 μg。配制10%丙烯酰胺胶,蛋白marker上至两侧上样孔中,中间孔进行上样,上样后80 V稳压跑出积层胶,调整电压至120 V稳压跑1 h,250 mA稳流湿转至PVDF膜,2 h后取出膜,丽春红染色,剪取目的条带后10%脱脂奶粉封闭2 h,一抗4℃摇床孵育过夜,孵育浓度为:E-cadherin抗体(1∶1 000),N-cadherin(1∶1 000),snail抗体(1∶500),CD133(1∶500),MMP-2抗体(1∶1 000),MMP-9抗体(1∶1 000),β-Actin(1∶2 000),12 h后PBS洗膜3次,每次10 min,相应二抗孵育1 h,孵育浓度为1∶2 000,发光液按A、B液1∶1混合后曝光显影,ImageLab4.2软件进行灰度扫描,样品目的蛋白灰度比值为样品DPI值与内参基因β-Actin DPI值的比值。
1.6统计学方法 应用SPSS17.0软件进行t检验。
2 结 果
2.1两组细胞侵袭能力比较 七氟烷组细胞24 h后穿透基底膜的细胞数〔(48.1±8.7)个〕显著低于对照组〔(76.3±11.5)个,t=11.31,P<0.01〕,见图1。
2.2两组细胞迁移能力比较 △S1(13.82±4.73)显著低于△S0(22.96±6.45,t=7.23,P<0.01),见图2。
2.3两组细胞上皮间充质转化(EMT)相关分子表达比较 七氟烷组相比对照组细胞E-cadherin及Zo-1表达显著上调,N-cadherin及snail表达显著下调(P<0.01);七氟烷组E-cadherin、Zo-1相对灰度值(0.336±0.052,0.406±0.065)显著高于对照组(0.218±0.067,0.310±0.042;t=8.80,7.85;均P<0.01)。N-cadherin、snail相对灰度值(0.479±0.046,0.381±0.063)显著低于对照组(0.623±0.064,0.537±0.054;t=11.56,11.89;均P<0.01)。见图2。
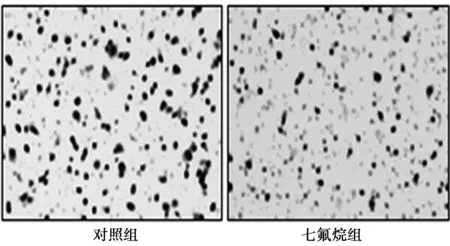
图1 两组细胞穿透基底膜的情况(×200)

图2 两组细胞划痕修复情况
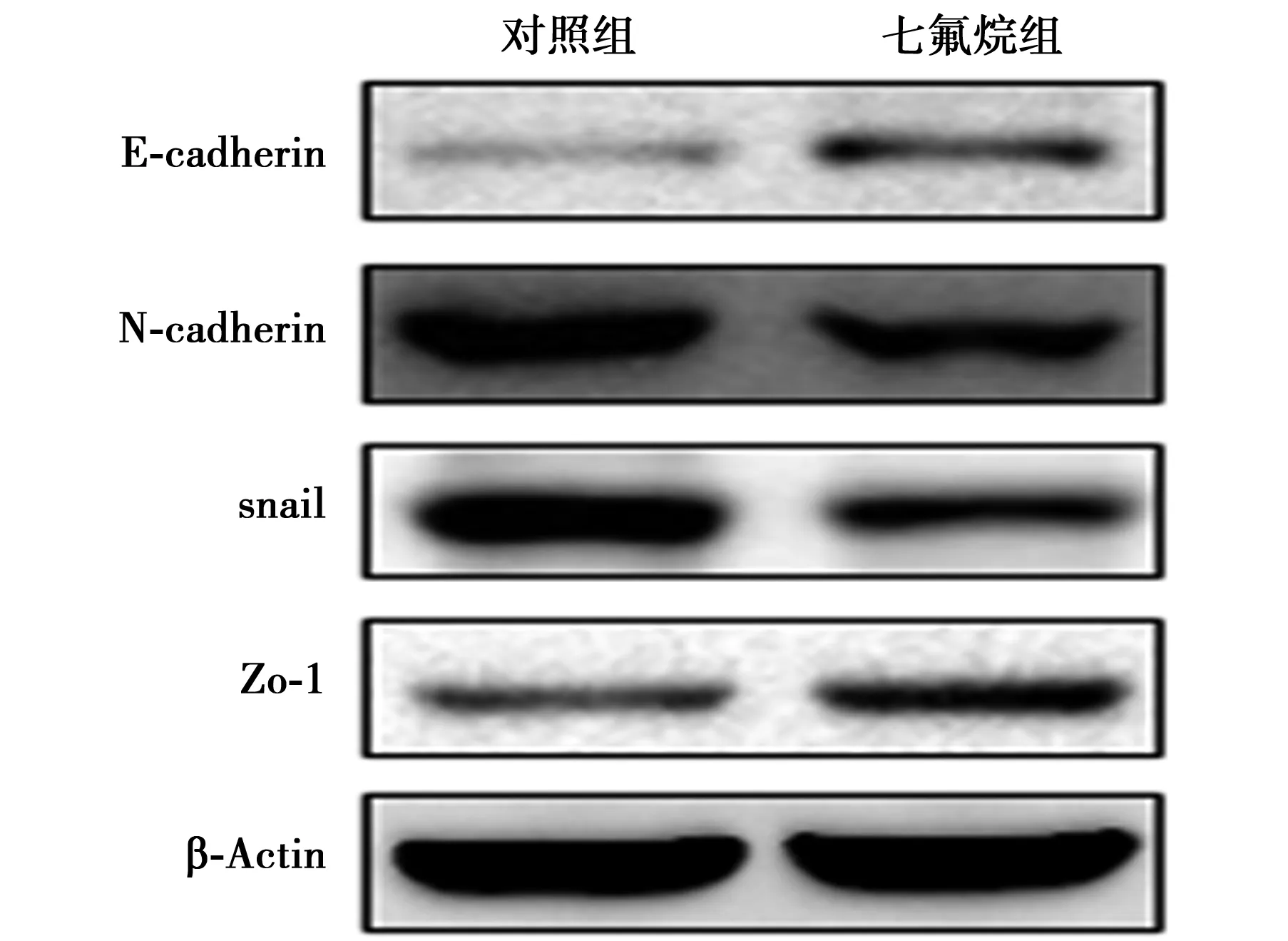
图3 Western印迹检测两组细胞EMT蛋白表达情况
2.4两组细胞干性相关分子及侵袭相关分子表达比较 七氟烷组相比对照组CD133、MMP-2及MMP-9表达显著下调(P<0.01),七氟烷组细胞CD133、MMP-2、MMP-9相对灰度值(0.383±0.061,0.486±0.055,0.160±0.034)显著低于对照组(0.452±0.072,0.579±0.074,0.241±0.038;t=4.62,6.38,10.04;均P<0.01)。见图4。
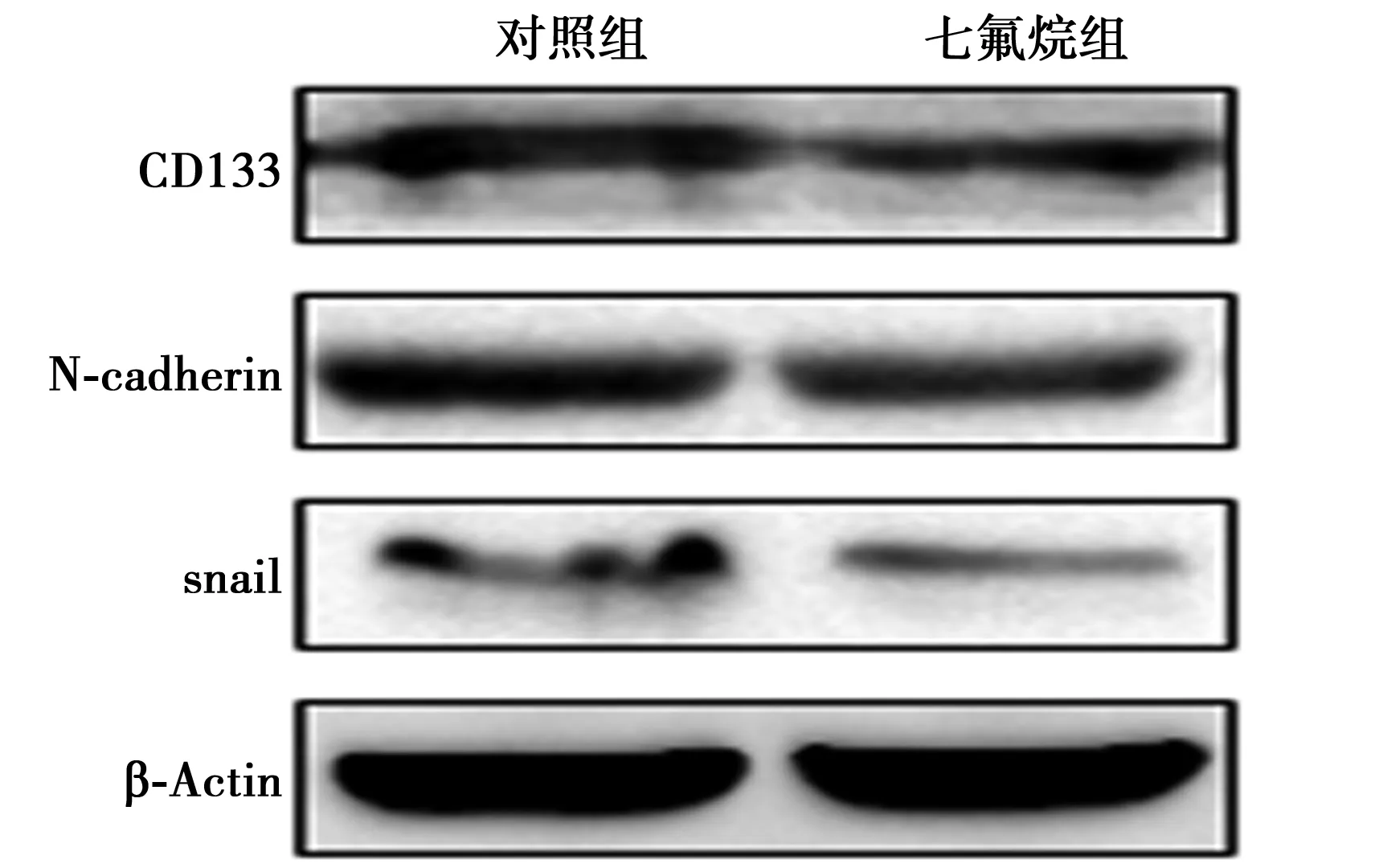
图4 Western印迹检测两组细胞干性相关及侵袭相关蛋白表达情况
3 讨 论
七氟烷是临床上广泛应用的吸入性麻醉药,有研究显示其可选择性舒张脑血管平滑肌,降低脑血管阻力,增加麻醉过程中脑组织的供氧及灌注〔5〕,同时可降低脑的氧代谢率,起到对脑组织的保护作用〔6〕。Liang等〔7~10〕研究显示,七氟烷可通过抑制p38/MAPK、缺氧诱导因子(HIF)-1α及MMP家族的表达抑制非小细胞肺癌侵袭转移能力,且可促进肿瘤细胞放疗敏感性增加。徐红萌等〔11〕发现七氟烷可下调乳腺癌MDA-MB-231细胞MMP-9的表达,进而抑制其侵袭迁移能力。Wei等〔12〕研究发现七氟烷可诱导人非小细胞肺癌细胞A549的凋亡,进而降低细胞活力,增加凋亡小体〔13〕。
Transwell侵袭实验结果提示七氟烷可减弱人脑胶质瘤细胞的侵袭转移能力。EMT是与肿瘤细胞侵袭转移密切相关的生物学过程〔13〕,其代表性分子包括E-cadherin、N-cadherin、snail及Zo-1等。E-cadherin是上皮细胞表达的一种重要的黏附分子,代表细胞的黏附强度,恶变过程中E-cadherin的表达下调往往意味着细胞活动性增加,肿瘤细胞侵袭转移能力增强〔14〕;N-cadherin及snail是间质细胞标志物,其表达上调意味着细胞EMT程度加深,是肿瘤分化不良的标志;Zo-1是细胞间隙封闭的关键因子,其下调可导致细胞间紧密连接中断,促进癌细胞的扩散〔15〕。本研究结果提示七氟烷可能通过抑制胶质瘤细胞EMT过程,抑制细胞的侵袭和迁移。MMP-2及MMP-9是MMP家族的重要成员,可降解细胞外基质,促进肿瘤细胞的转移能力〔16〕;CD133是肿瘤干细胞标志物,其表达上调往往意味着肿瘤细胞恶性程度加深,进而促进肿瘤的恶性行为〔17〕。本研究结果提示七氟烷抑制胶质瘤细胞的侵袭和迁移能力可能与下调MMP及逆转胶质瘤细胞干性有关。
1朱 航,雷 迅,张 帆,等.脑胶质瘤危险因素Meta分析及危险因素控制后发病率的变化趋势〔J〕.中国医科大学学报,2012;41(6):554-8.
2陈正和,陈忠平.高级别胶质瘤的治疗现状及思考〔J〕.中国临床神经外科杂志,2016;21(6):350-2.
3Yu Q,Chu M,Wang H,etal.Sevoflurane preconditioning protects blood-brain-barrier against brain ischemia〔J〕.Front Biosci,2011;3(3):978-88.
4Ecimovic P,Mchugh B,Murray D,etal.Effects of sevoflurane on breast cancer cell function in vitro〔J〕.Anticancer Res,2013;33(10):4255-60.
5Rhondali O,Pouyau A,Mahr A,etal.Sevoflurane anesthesia and brain perfusion〔J〕.Pediatr Anesth,2015;25(2):180-5.
6Guo JY,Fang JY,Xu SR,etal.Effects of propofol versus sevoflurane on cerebral oxygenation and cognitive outcome in patients with impaired cerebral oxygenation〔J〕.Ther Clin Risk Manage,2016;12(1):81-5.
7Liang H,Wang HB,Liu HZ,etal.The effects of combined treatment with sevoflurane and cisplatin on growth and invasion of human adenocarcinoma cell line A549〔J〕.Biomed Pharmacother,2013;67(6):503-9.
8Liang H,Gu M,Yang C,etal.Sevoflurane inhibits invasion and migration of lung cancer cells by inactivating the p38 MAPK signaling pathway〔J〕.J Anesth,2012;26(3):381-92.
9梁 桦,杨承祥,文先杰,等.不同浓度七氟烷对人肺腺癌A549细胞侵袭能力及MMP-2、MMP-9表达的抑制作用〔J〕.临床麻醉学杂志,2012;28(3):275-7.
10梁 桦.七氟烷对人肺腺癌A549细胞生长、转移能力及化疗敏感性的影响〔D〕.广州:南方医科大学,2012.
11徐红萌,张艳红,邱东洁,等.异丙酚和七氟烷对人乳腺癌细胞转移能力的影响〔J〕.中华麻醉学杂志,2015;35(10):1248-50.
12Wei GH,Zhang J,Liao DQ,etal.The common anesthetic,sevoflurane,induces apoptosis in A549 lung alveolar epithelial cells〔J〕.Mol Med Rep,2014;9(1):197-203.
13Son H,Moon A.Epithelial-mesenchymal transition and cell invasion〔J〕.Toxicol Res,2010;26(4):245-52.
14Canel M,Serrels A,Frame MC,etal.E-cadherin-integrin crosstalk in cancer invasion and metastasis〔J〕.J Cell Sci,2013;126(2):393-401.
15Jain K,Basu A.Protein kinase C-ε promotes EMT in breast cancer〔J〕.Breast Cancer,2014;8(1):61-7.
16Liu HY,Gu WJ,Wang CZ,etal.Matrix metalloproteinase-9 and-2 and tissue inhibitor of matrix metalloproteinase-2 in invasive pituitary adenomas:A systematic review and meta-analysis of case-control trials〔J〕.Medicine,2016;95(24):e3904.
17Suresh R,Ali S,Ahmad A,etal.The role of cancer stem cells in recurrent and drug-resistant lung cancer〔J〕.Adv Exp Med Biol,2016;890(3):57-74.
R73
A
1005-9202(2017)24-6054-03;
10.3969/j.issn.1005-9202.2017.24.021
1 河南科技大学第一附属医院妇产科
2 河南科技大学第一附属医院神经外科
郭孝龙(1972-),男,博士,主任医师,主要从事神经外科研究。
谢小娟(1976-),女,硕士,副主任医师,副教授,主要从事肿瘤患者围麻醉期应激调控研究。
〔2017-05-17修回〕
(编辑 袁左鸣/滕欣航)

