普拉格雷干预对脑梗死大鼠神经功能的影响及可能机制
刘克洪 李景琦 高 坚 (武警浙江省总队杭州医院康复中心,浙江 杭州 310051)
普拉格雷干预对脑梗死大鼠神经功能的影响及可能机制
刘克洪 李景琦 高 坚 (武警浙江省总队杭州医院康复中心,浙江 杭州 310051)
目的考察普拉格雷对脑梗死大鼠神经功能的影响及可能机制。方法雄性SD大鼠随机分为假手术组,模型组和普拉格雷组3组,每组40只。假手术组与模型组灌胃给予生理盐水,普拉格雷组给予普拉格雷10 mg·kg-1·d-1,连续给药14 d。记录或检测各组行为障碍、组织病理学改变、脑内半胱天冬酶(Caspase)-3及程序化死亡基因(PDCD)-5表达情况,外周血超氧化物歧化酶(SOD)、丙二醛(MDA)、神经元特异性烯醇化酶(NSE)及S-100β蛋白表达情况。结果与假手术组比,模型组及普拉格雷组神经功能评分升高显著(P<0.05);与模型组比较,普拉格雷组神经功能评分显著降低(P<0.05)。假手术组脑组织细胞结构完整;模型组细胞排列紊乱,水肿严重,血管充血;与模型组比较,普拉格雷组脑组织结构较完整,且坏死及水肿程度降低。与假手术组比,模型组可见大量Caspase-3和PDCD-5细胞(P<0.05),SOD明显降低(P<0.05),MDA、NSE和S-100β明显增高(P<0.05);与模型组比,普拉格雷组Caspase-3和PDCD-5细胞显著降低(P<0.05),SOD明显增高(P<0.05),MDA、NSE和S-100β明显降低(P<0.05)。结论普拉格雷可以通过抑制Caspase-3及PDCD-5凋亡因子,调控SOD、MDA、NSE及S-100β表达从而改善脑梗死大鼠的神经功能障碍。
普拉格雷;脑梗死;半胱天冬酶-3;程序化死亡基因;超氧化物歧化酶;丙二醛;神经元特异性烯醇化酶;S-100β
脑梗死后神经功能的改善成为近年来研究的难点和热点,针对脑梗死动物模型的研究发现,抑制凋亡及保护神经成为治疗的重点〔1〕。普拉格雷作为第三代血小板抑制剂,可与P2Y12受体相结合,从而发挥更强更迅速的抗血小板聚集作用,是一种已处于Ⅲ期临床试验的药物〔2〕,然而有关普拉格雷可否改善脑梗死大鼠神经功能的研究至今缺如,其可改善神经保护的机制也未知。本文探究普拉格雷对脑梗死大鼠神经功能的影响及可能机制。
1 资料与方法
1.1一般资料 雄性Wistar大鼠(北京维通利华公司)120只,8~10周龄,体重180~220 g,随机分为假手术组,模型组和普拉格雷组各40只。
1.2脑梗死大鼠的制备 大鼠全麻后置于操作台上,分离右侧颈总动脉(CCA),颈外动脉(ECA)及颈内动脉(ICA)。结扎ECA及CCA近心端。在CCA近分叉处插入备用鱼线,将栓线送至大脑中动脉分叉处,平均进线(18.5±0.5)mm(ECA与ICA分叉处为起点),栓线尾端留于皮肤外,栓塞90 min后抽线实现再灌注。以大鼠清醒后爬行时右转圈,提尾时右前肢内收屈曲为纳入标准。假手术组操作同上,仅暴露各组血管,而不进行线栓插入〔3〕。
1.3给药 假手术组和模型组均灌胃给予生理盐水,剂量10 ml·kg-1·d-1,普拉格雷组给予普拉格雷10 mg·kg-1·d-1,连续给药14 d。
1.4神经功能评分〔3〕记录所有大鼠治疗后的神经功能评分。0分:活动自如,未有障碍;1分:存在活动障碍,左侧前爪无力;2分:存在活动障碍,推手术侧肩部,发现对侧的移动阻力降低;3分:存在活动障碍,大鼠出现旋转转圈;4分:活动障碍明显,无肢体活动。分值越高提示行为障碍越明显。
1.5脑组织病理 治疗后,水合氯醛腹腔注射麻醉大鼠处死,取脑组织,参照固定-脱水-包埋-切片-染色等步骤,光镜观察病理形态。
1.6Caspase-3及程序化死亡基因(PDCD)-5在脑组织的表达 选择1.5的切片,按照脱蜡-透明-脱水-抗原修复-抗体孵育-染色等步骤,光镜观察Caspase-3及PDCD-5表达情况。按染色强度与阳性细胞数比例确定阳性情况,无着色0分,<1%为1分、1%~10%为2分,11%~33%为3分,34%~66%为4分,67%~100%为5分,染色强度按无、弱、中和强分别为0、1、2和3分,阳性细胞百分率评分+细胞染色强度评分≥3为阳性,否则为阴性。
1.7外周血超氧化物歧化酶(SOD)和丙二醛(MDA)表达 治疗前后,自大鼠眼球取血,静置2 h,离心取血清,按照说明书操作步骤〔3〕,并应用仪器检测吸光度并计算SOD和MDA的相对含量。SOD和MDA试剂购于美国CST公司。
1.8外周血神经元特异性烯醇化酶(NSE)及S-100β蛋白表达 治疗前后,自大鼠眼球取血,高速离心取上清,以酶标仪采用酶联免疫吸附(ELISA)法测定NSE及S-100β水平,严格按照试剂盒说明书操作,NSE及S-100β试剂盒均购于R&D公司。
1.9统计学方法 应用SPSS17.0统计软件进行t检验。
2 结 果
2.1各组治疗前后的神经功能评分 治疗前,与假手术组比较,模型组及普拉格雷组神经功能评分较治疗前显著升高(P<0.05),治疗后,普拉格雷组神经功能评分较治疗前显著降低(P<0.05),与模型组比较,普拉格雷组神经功能评分明显降低(P<0.05),见表1。
2.2各组脑组织病理学比较 假手术组脑组织细胞结构完整;模型组细胞排列紊乱,水肿严重,血管充血;与模型组比较,普拉格雷组脑组织结构较完整,且坏死及水肿程度降低,见图1。

表1 各组治疗前后的神经功能评分分)
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05;下表同
2.3各组脑Caspase-3及PDCD-5表达 假手术组未见Caspase-3 和PDCD-5阳性细胞,模型组见大量Caspase-3〔32例(80.00%)〕和PDCD-5阳性细胞〔35例(87.50%)〕(χ2=53.333,62.222,均P=0.000);与模型组比较,普拉格雷组Caspase-3 和PDCD-5阳性率〔17例(42.50%)、15例(37.50%)〕明显降低(χ2=8.717,P=0.003 0;χ2=21.333,P=0.000 0),见图2。
2.4各组治疗前后外周血SOD及MDA水平比较 治疗前,与假手术组比较,模型组及普拉格雷组SOD显著降低(P<0.05),MDA显著升高(P<0.05);治疗后,较治疗前普拉格雷组SOD显著增高(P<0.05),MDA显著降低(P<0.05);与模型组比较,普拉格雷组SOD显著增高(P<0.05),MDA显著降低(P<0.05),见表2。
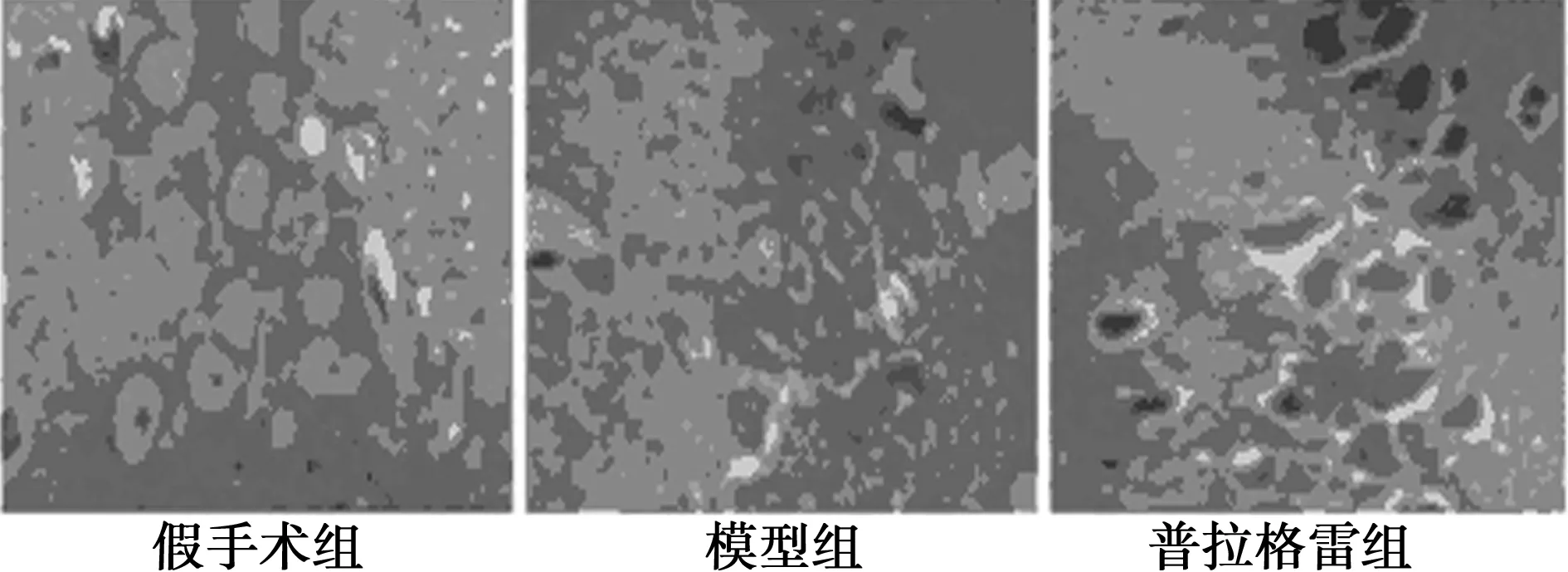
图1 各组脑组织的HE染色(×400)
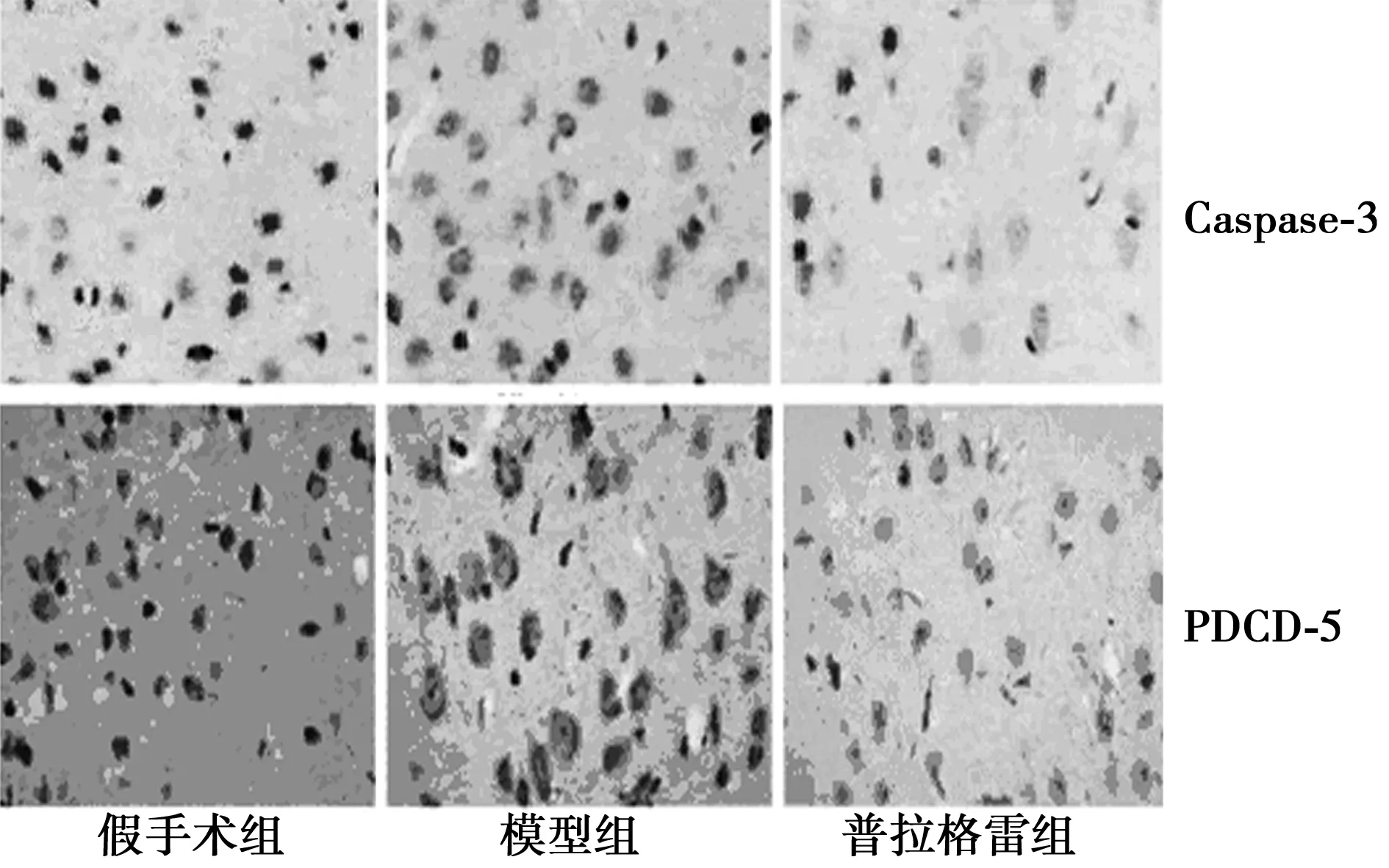
图2 各组脑组织Caspase-3及PDCD-5表达(×400)
2.5各组治疗前后外周血NSE及S-100β水平比较 治疗前,与假手术组比较,模型组及普拉格雷组NSE及S-100β显著增高(P<0.05);治疗后,普拉格雷组NSE及S-100β显著降低(P<0.05),与模型组比较,普拉格雷组NSE及S-100β显著降低(P<0.05),见表3。

表2 各组治疗前后外周血SOD及MDA水平比较分)

表3 各组治疗前后外周血NSE及S-100β水平比较分)
3 讨 论
脑梗死发生机制不明,但脑组织缺血缺氧导致的细胞凋亡及氧自由基增高,促使多种脑组织损伤特异性蛋白,如NSE及S-100β分泌增多,诱导脑组织神经功能的损伤。NSE多由神经元细胞分泌,是中枢神经系统(CNS)特异性蛋白,生理状态下的血清水平较低,难以被检测到,但当颅内缺血缺氧时,胞质内的NSE即进入血液循环,外周血增高的NSE可作为颅内损伤的标志物〔4~7〕;S-100β可在多种脑内细胞内表达,但表达受限,参与脑细胞的多种代谢过程,被认为是脑损伤的特异性标记蛋白〔8~10〕。
脑梗死发病的重要因素之一是细胞凋亡,细胞凋亡受多种基因调控,线粒体凋亡通路、内质网凋亡途径和死亡受体通路均可干预凋亡,这三种通路均需要激活下游Caspase-3和PDCD-5等凋亡蛋白才能发挥诱发细胞程序性死亡的作用。Caspase-3为通路中的关键因子,是启动凋亡的重要分子〔11〕。PDCD-5具有早期及始动性的功能,参与线粒体凋亡通路〔12〕。本文结果提示脑梗死大鼠脑部存在明显的细胞凋亡。
生理条件下,机体具有清除体内多余自由基的功能,然而在缺血缺氧的情况下,氧自由基聚集,损伤脑组织。SOD作为最主要的抗氧化酶,可有效清除体内氧自由基;而MDA与线粒体膜的稳定性相关,两者的含量可反映机体氧自由基情况〔13,14〕。本文结果提示脑梗死大鼠的氧自由基代谢紊乱。
普拉格雷作为一种新型的抗血小板药物,是一种前体药物,可在体内活化为活性物质,与血小板受体结合从而发挥更有效的抗血小板聚集的效果。研究多认为普拉格雷具有较好的预防和改善心脑血管疾病发生发展的功能〔15,16〕。
本文说明普拉格雷可以明显降低脑梗死大鼠颅内凋亡程度。普拉格雷可以显著减轻脑梗死大鼠氧自由基的分泌。普拉格雷可以降低脑特异性损伤蛋白的分泌,参与脑梗死的修复。既往研究〔13〕显示,抗血小板疗法可诱发大脑皮层发生依赖性神经功能重组的变化,使脑梗死恢复期患者大脑皮层发生功能重组变化,使患肢运动功能得到恢复。普拉格雷疗法可以通过减轻颅内凋亡程度、氧自由基分泌状况及脑损伤蛋白的合成改善脑梗死大鼠的神经功能障碍,然而有关其深入机制的研究仍需后续实验。
1李秀芹,高 勇.阿托伐他汀联合尤瑞克林对急性脑梗死患者临床疗效及内皮素水平的影响〔J〕.中国老年学杂志,2016;36(9):2146-8.
2吴禹蒙,程荔春,梁 晶,等.替格瑞洛对比普拉格雷对血小板反应性影响的Meta分析〔J〕.中国药房,2016;27(15):2083-6.
3张贯石,贾芙蓉,王 辉,等.脐血单个核细胞治疗大脑中动脉闭塞性脑梗塞大鼠后行为学及胆碱能变化〔J〕.中国免疫学杂志,2014;30(9):1186-8,1194.
4于玉娟,高成杰,王晓鹏,等.帕瑞昔布钠对脑肿瘤切除术患者炎症反应的影响及脑保护作用〔J〕.山东大学学报(医学版),2016;54(6):65-8,86.
5陈晓梅,陈广福.右美托咪定对颅内肿瘤手术患者血流动力学的影响及脑保护作用〔J〕.临床麻醉学杂志,2015;31(1):15-7.
6程奎山,戴益斌,谢军朋,等.脑梗塞再灌注患者血清NSE及S-100β蛋白变化及丁苯酞的干预作用〔J〕.海南医学,2016;27(19):3102-4.
7邹 斌,张兆辉.尤瑞克林联合曲克卢丁对急性脑梗塞患者凝血功能及神经功能的影响〔J〕.海南医学院学报,2015;21(6):841-3,846.
8谢小娟,李前辉,宋绍团,等.右美托咪定复合芬太尼及七氟烷对幕上脑肿瘤患者血清NSE、S-100β、SOD和MDA含量及脑氧供需平衡的影响〔J〕.华中科技大学学报(医学版),2017;46(1):76-9,93.
9尚 云,马慧敏,郭喜霞,等.促红细胞生成素对宫内感染致脑损伤早产新生大鼠神经胶质酸性蛋白和S-100β表达的影响〔J〕.中国儿童保健杂志,2014;22(10):1047-50.
10童世君,金利明,李 祥.外源性硫化氢对大鼠心肺复苏后大脑中动脉血流、血清神经元特异性烯醇化酶及S-100β蛋白的影响〔J〕.中国老年学杂志,2017;37(8):1843-5.
11郭映辉,冯志山,邵智利,等.新生儿缺氧缺血性脑病血清IL-18和Caspase-3及S-100B蛋白水平检测及临床意义〔J〕.中华检验医学杂志,2014;37(4):276-80.
12曲贝贝,左金华,朱玉红,等.Survivin和 PDCD5在黏液表皮样癌组织中的表达及临床意义〔J〕.实用口腔医学杂志,2016;32(2):225-9.
13Choudhary R,Bodakhe SH.Magnesium taurate prevents cataractogenesis via restoration of lenticular oxidative damage and ATPase function in cadmium chloride-induced hypertensive experimental animals〔J〕.Biomed Pharmacother,2016;8(84):836-44.
14Hedayati Kashka R,Zavareh S,Lashkarbolouki T.Augmenting effect of vitrification on lipid peroxidation in mouse preantral follicle during cultivation:modulation by coenzyme Q10〔J〕.Syst Biol Reprod Med,2016;62(6):1-11.
15树 源,黄家卓.普拉格雷在行经皮冠状动脉介入治疗的急性冠脉综合征患者中的应用效果〔J〕.实用心脑肺血管病杂志,2016;24(5):109-12.
16洪 峰,马青青.普拉格雷治疗冠状动脉粥样硬化的疗效观察〔J〕.现代实用医学,2016;28(6):781-2.
R743.3
A
1005-9202(2017)24-6038-04;
10.3969/j.issn.1005-9202.2017.24.015
浙江省自然科学基金资助项目(No.LY12H09006)
李景琦(1964-),男,主任医师,主要从事脑损伤意识障碍康复研究。
刘克洪(1983-),男,主治医师,主要从事神经损伤康复研究。
〔2016-11-29修回〕
(编辑 苑云杰)

