基于高光谱技术的燕麦β-葡聚糖含量测定方法研究
李 靖,王春光
(内蒙古农业大学 机电工程学院,呼和浩特 010018)
0 引言
燕麦一般分为皮燕麦和裸燕麦两种[1],是一种粮、饲多用途世界性栽培作物,分布于世界各地的42个国家[2],在小麦、水稻、玉米、大豆、燕麦等粮食作物中,燕麦总产量居第五位[3],是人们生活中不可或缺的营养保健食品。我国主要种植裸燕麦,其产量占燕麦总产量的90%以上[4],主要在内蒙古、山西、甘肃、河北、青海等地区种植,内蒙古的种植面积达到全国总面积的35%以上[5]。燕麦富含水分、蛋白质、脂肪及膳食纤维等营养物质,特别是膳食纤维中含有丰富的β-葡聚糖[6]。1997年,美国食品药品监督管理局(FDA)认定β-葡聚糖具有防止心血管疾病,降低胆固醇的功效[7]。目前,燕麦中β-葡聚糖含量的化学测定方法有刚果红法[8]、国际标准酶法[9]、改进酶法[10]、荧光法[11]及苯酚-硫酸法[12]等,前两种方法应用较为广泛。这些传统的方法具有测量精度高的优点,但存在检测速度慢、测量成本高、样品预处理及破坏样品等不足,无法做到对燕麦β-葡聚糖含量的快速、准确、无损检测。因此,探索一种快速、准确、无损检测燕麦β-葡聚糖含量的方法是非常必要的。
近几年,高光谱技术发展迅速,该技术将一维光谱技术和二维图像技术完美结合,可以提取出被测样本的外观信息和内部品质信息,具有不破坏样本、不需预处理样本、多组分同时分析、分析速度快及操作简便等优点,结合化学计量学方法可实现样本组分快速、无损的分析检测,目前已广泛应用于农畜产品品质、食品安全检测等领域,成为一个研究热点[13-16]。周青梅[17]等利用近红外光谱法测定麦芽中的β-葡聚糖含量,化学测定值与预测值之间的决定系数R2达到0.827;田海清[18]等基于漫反射高光谱成像技术建立了马铃薯干物质含量预测模型。然而,国内外学者利用高光谱成像技术对燕麦β-葡聚糖含量检测的相关研究报道较少。本文利用高光谱系统采集燕麦的光谱信息,结合化学计量学方法研究燕麦光谱信息和β-葡聚糖含量之间的定量关系模型,探索一种快速、准确、无损的燕麦β-葡聚糖含量测定方法,对燕麦的品质检测有很好的实际应用价值。
1 材料与方法
1.1材料与设备
实验以内蒙古农业大学农学院提供的5种燕麦作为研究对象,将燕麦籽粒去壳、去杂清理干净后,从完整、未发芽、无霉变的燕麦籽粒中挑选饱满、大小基本一致的籽粒装袋密封,存放到温度在3~5℃的冰柜里,以防其变质或水分含量改变而影响实验结果。
实验用到的主要设备如下:
1)采集燕麦光谱的高光谱系统。由V10E-QE成像光谱仪、CCD相机、光源、移位载物平台及计算机等组成,如图1所示。

1.CCD相机 2.成像光谱仪 3.移位载物平台 4.计算机 5.光源图1 高光谱系统
高光谱系统主要的技术参数如下:光谱波长范围380~1 030nm,光谱分辨率2.8nm,CCD相机像素长宽大小为1 392×1 040像素。
2)测定燕麦β-葡聚糖的仪器。由分光光度计、漩涡混合器、恒温水浴器、离心机、粉碎机以及沸腾水浴器等组成。
1.2试验方法
1.2.1样本的制备与划分
由于燕麦籽粒间存在着一定的个体差异,因此在装样前需进行充分的搅拌均匀,然后再从中随机取出一定数量的燕麦,装满到直径为10cm、厚度为1 cm 的培养皿中,且用平板由上而下轻轻挤压培养皿中的燕麦,使燕麦籽粒间空隙较小,并保持培养皿中的燕麦与培养皿上表面在同一水平面上;5个品种中,每个品种装30个样本,共制备150个样本并编号。采用随机抽样法(RS法)对样本进行划分,将样本随机分成100个建模集和50个预测集,如表1所示。每个燕麦样本在进行光谱数据采集后均保持独立样本进行β-葡聚糖含量的生化测定。

表 1 燕麦样本表

续表1
1.2.2高光谱数据采集
在采集燕麦高光谱数据前,首先将仪器开启预热0.5h,使光源和采集系统达到稳定。然后设置相机曝光时间、平台移动速度及镜头到样本上表面之间的距离,使采集到的图像大小合适、清晰、不变形失真。经过反复调试和比对,最终确定镜头高度设置为32cm,曝光时间设置为144ms,平台移动速度设置为2.1mm/s。最后,将制备好的样本按一定顺序将其分别放到移位载物平台上进行高光谱数据采集,如图2所示。在采集过程中要关闭暗箱以避免外界光线的干扰,并将每次采集完的高光谱数据分别命名保存到计算机中。

图2 高光谱数据采集图
由于各波段光源强度分布不均匀及仪器中暗电流存在,使光强分布较弱的波段噪声较大,因此在采集光谱图像前必须进行黑白标定,以消除部分噪声影响[19]。首先,对标准白板进行扫描获得全白标定图像IW;然后,盖上镜头盖进行扫描获得全黑标定图像ID;最后,依据公式R=(IR-ID)/(IW-ID)计算校正后的图像R。其中,R为校正后的图像;IR为原始图像;IW为白板校正图像;ID为黑板校正图像。
1.2.3反射光谱预处理
由于燕麦籽粒间有缝隙且燕麦籽粒表面不平整,所以样本的每个点的光谱信息不一样。为了使每个样本的光谱更具有代表性,从采集到的燕麦样本表面上选取尽量大的区域(300×300像素点的矩形区域)作为样本的感兴趣区域,以该区域中所有像素点光谱的平均值作为该样本的光谱。
为了消除样本的不均匀性、表面不平整性和光线散射等因素和仪器噪声的影响,采用多元散射校正(MSC)法对原始光谱进行预处理。由于仪器误差,光谱曲线在首尾端有较大的噪声,去掉前后各30个波段,取400~1 000nm范围内的反射光谱数据进行分析研究,如图3所示。

图3 燕麦光谱曲线图
1.2.4燕麦β-葡聚糖含量的化学测定
首先,对燕麦样本籽粒经脱壳、粉碎后过孔径为0.2mm 筛;然后,采用国标法酶法(试剂盒法)测定燕麦β-葡聚糖成分含量。重复测定两次,取其平均值,结果以干基(%)表示。两个平行测定的相对误差,不超过2%,将测定值与光谱数据一一对应记录保存。
2 结果与分析
2.1燕麦β-葡聚糖含量的统计分析
对采用国标法酶法(试剂盒法)测定的燕麦β-葡聚糖含量进行统计分析,分析结果如表2所示。
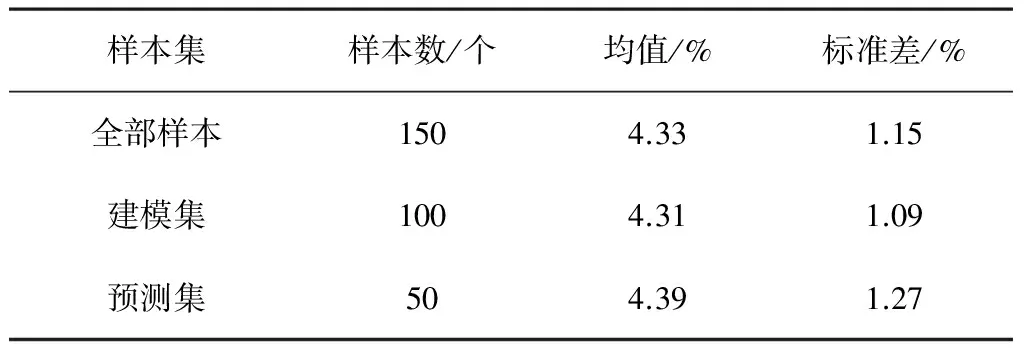
表2 燕麦β-葡聚糖含量的统计学分析
由表2可知:经由酶法(试剂盒法)实验测定的燕麦样本β-葡聚糖成分含量在建模和估算数据集中有较好的一致性。
2.2高光谱数据特征波长的提取
采集的全波段(400~1 000nm)高光谱数据因维数高、数据量大,且样本的有些区域光谱信息比较弱,与样本的组成间缺乏相关关系,直接采用全波段光谱数据作为神经网络输入层的变量个数显然不合适,因此使用基于分段线性回归[20-21]的参数化数值分析方法对提取出的光谱数据进行降维处理, 定量提取了样本观测曲线中的特征光谱的波长及反射率值,进而能够在不降低准确度的情况下提高网络识别的速度。该方法的原理如公式(1)所示,即
yi=gi(xi)+ei
gi=g(xi,βi) (αj1≤xi≤αj2)
(1)
其中,yi为使用观测序列拟合的不同分段结果,gi(xi)为与观测序列xi条件相关联的特征数值区间并由分段拟合算法确定。其优势在于:可充分利用观测序列的多个观测样本,并基于统计规律获得直接定量的分段拟合结果;既可以分析观测序列的动态变化趋势也可获得序列的特征拐点,也可给待估算或测定目标提供关键驱动信息。
使用该算法对光谱按全波段(可划分1段)、200nm(可划分3段)、100nm(可划分6段)间隔进行分段划分,分别求得各段光谱的拐点波长和反射率。不同分段的拐点特征波长和反射率统计信息如表3~表5所示。
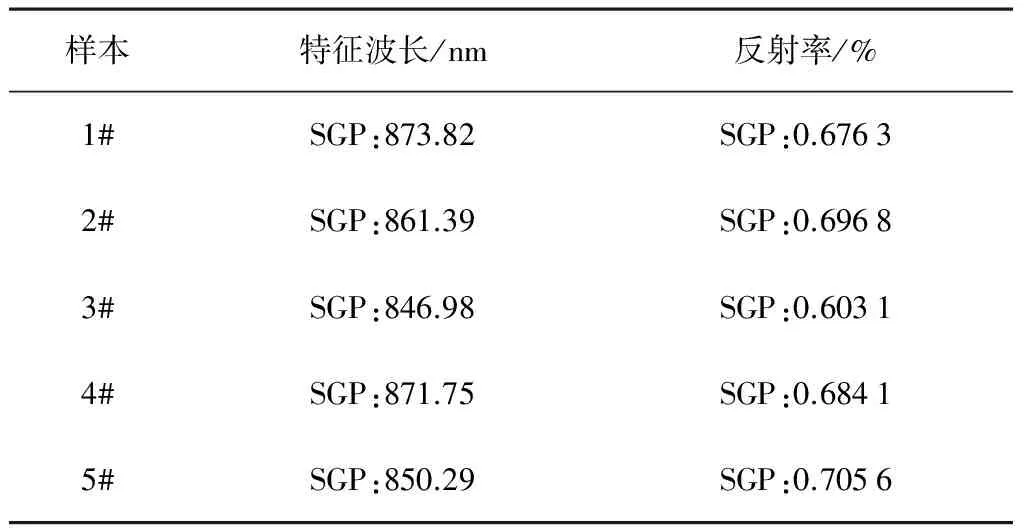
表3 燕麦样品全波长特征值
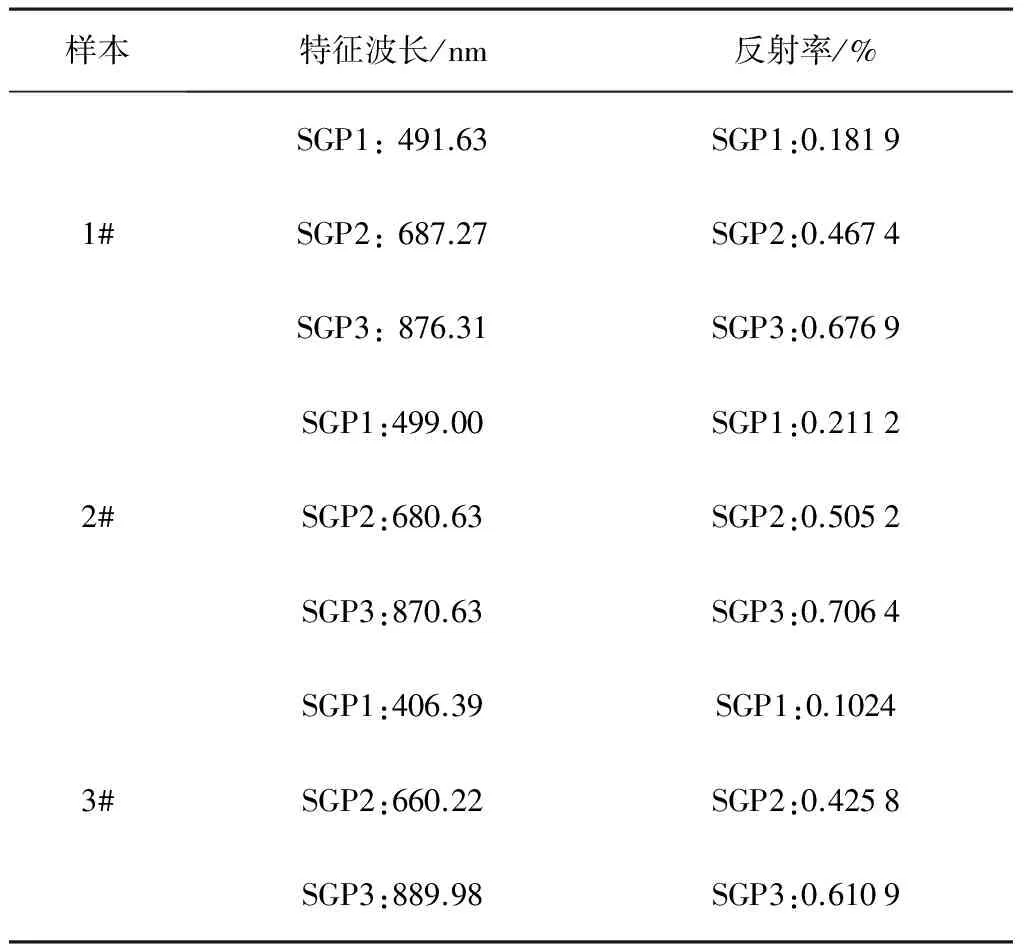
表4 燕麦样品200nm间隔特征值
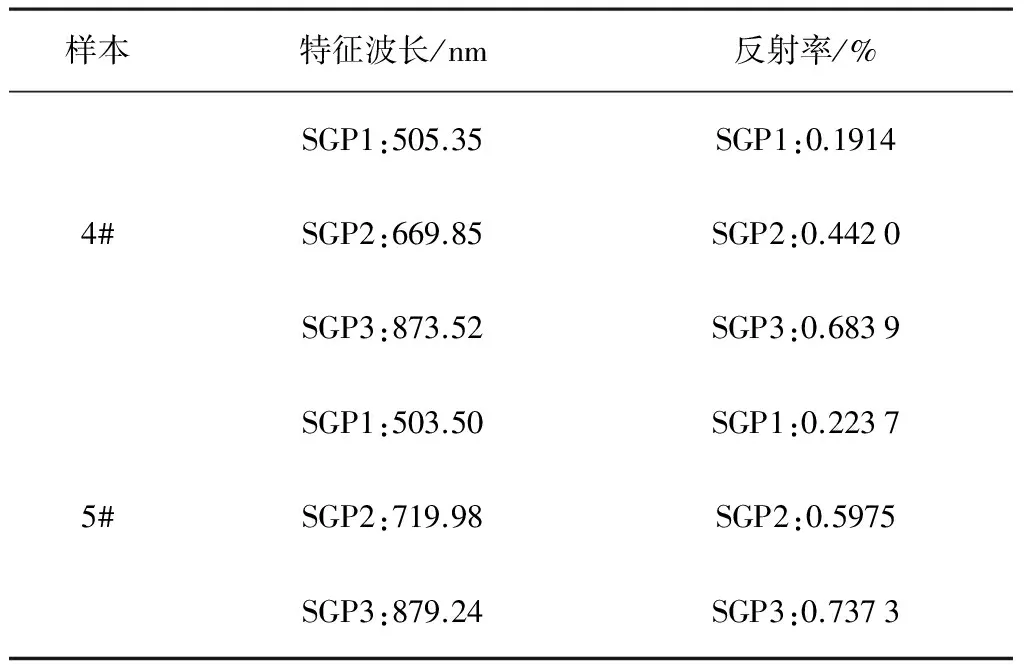
续表4

表5 燕麦样品100nm间隔特征值

续表5
2.3建立BP神经网络的燕麦β-葡聚糖含量预测模型
建立包含3层网络结构的神经网络预测模型, 输入层数据向量采用经分段线性回归方法得到的10个特征拐点波长对应的反射率值,中间计算隐含层神经元的传递函数采用S型正切函数logsig,输出向量是一维目标向量, 即β-葡聚糖含量。目前,隐含层节点数的选择还没有一个比较明确的理论来指导,只能结合样本的实际情况进行尝试性的选择,再逐步优化确定隐含层节点数。输出层神经元传递函数采用函数logsig(Wp+b)计算获得,其中Wp为不同特征光谱信息的加权计算权重,b为数值计算残差。神经网络的训练算法函数选用Levevberg-Marquardt方法进行寻优建模,最大训练次数为1 000,目标误差设为0.000 04,学习速率设为0.01。
经过反复对模型进行训练试验,最终得到BP神经网络预测模型结构为10-9-1。将该模型的输出结果(估算值)与用国标法测定燕麦β-葡聚糖含量的观测值进行相关性分析,其分析结果如图4所示。

图4 估算值与测量值的相关性分析
由图4可知:采用BP神经网络模型的估算值与国标法测定的观测值间的决定系数R2为0.6。这说明,采用BP神经网络方法建立的燕麦β-葡聚糖含量估算模型具有较强的拟合能力,可以较为准确地估算未知燕麦β-葡聚糖的含量,具有可行性。
2.4β-葡聚糖与光谱特征值的相关性分析
由于选取的特征值为高光谱的反射率,其反射率大小反映了燕麦品种间生理生化指标差异,因此对10个特征值和β-葡聚糖生理指标进行相关性分析,来确定β-葡聚糖的敏感波段范围,结果如表6所示。
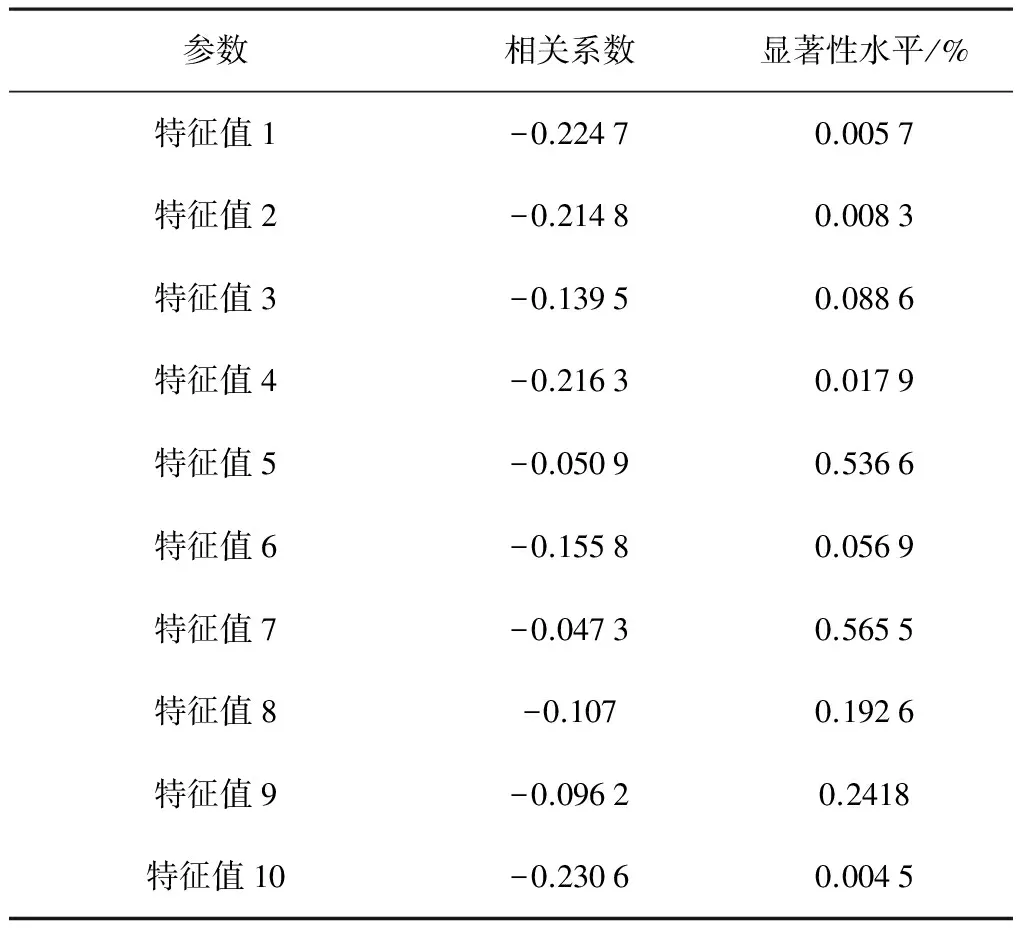
表6 β-葡聚糖与光谱特征值的相关性
由表6可知:β-葡聚糖与特征值1、特征值2、特征值10存在极显著地相关性(P<0.01)。所以,特征值对应的波长在492、874、930nm附近的范围是β-葡聚糖的敏感波段。
2.5预测结果的检验
使用所建模型对预测集燕麦样本β-葡聚糖含量进行估算, 具体估算值、预测集样本的测定值及它们间的绝对误差如表7所示。
表7燕麦β-葡聚糖含量的测定值和估算值
Table 7Measured and estimated of β-glucan content in Oat %
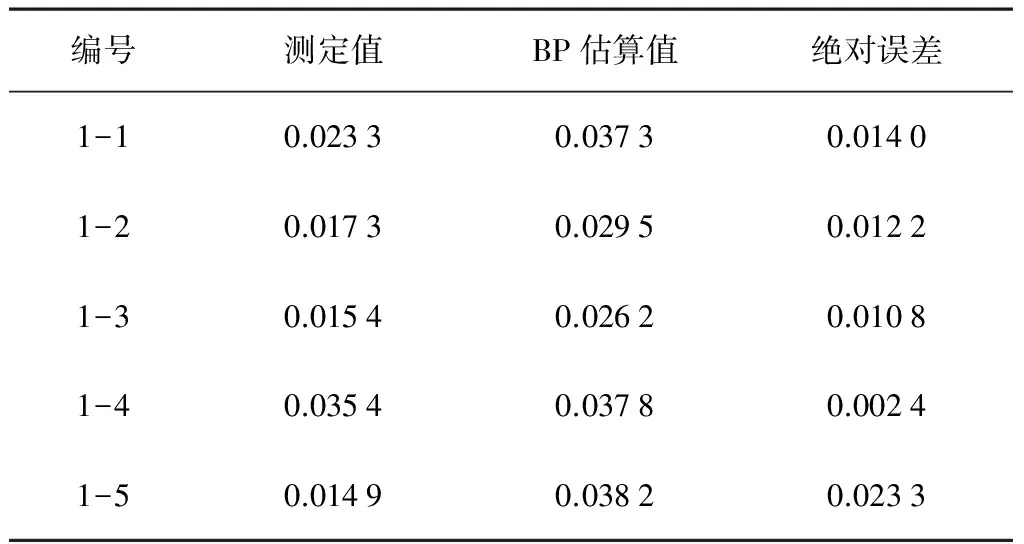
编号测定值BP估算值绝对误差1-10.02330.03730.01401-20.01730.02950.01221-30.01540.02620.01081-40.03540.03780.00241-50.01490.03820.0233

续表7

续表7
由表7可知: 采用BP神经网络模型对燕麦β-葡聚糖含量的估算值与用国标法测定值的平均绝对偏差为±1%之内,模型的预测均方根误差(RMSEP)为0.010 5。可见,估算值与观测值之间的相关性比较高,误差水平在1%以内。由此说明,采用BP神经网络方法建立的燕麦β-葡聚糖含量估算模型具有较强的拟合能力,可以较为准确地估算未知燕麦β-葡聚糖的含量,具有可行性。
3 结论
本研究应用高光谱成像技术,结合成熟的BP神经网络这一化学计量学方法和统计学方法,开展了对燕麦β-葡聚糖含量无损检测方法的研究。通过研究燕麦品质的检测机理和方法,找到燕麦光谱特征信息与燕麦品质的相关关系,建立一种快速、准确、简便和无损的燕麦β-葡聚糖检测方法来替代常规的检测方法,具有很好的理论研究意义和实际应用价值。高光谱技术具有多波段、高分辨率和图谱合一的特点,能同时快速、高效、无损地检测燕麦的不同组分含量;而常规化学检测方法费时费力,破坏样品,操作复杂,已不能满足当前对检测精度、速度和自动化的需求。
本文通过高光谱系统采集了400~1 000nm范围的燕麦高光谱数据,采用分段线性回归分析方法对高光谱数据进行降维处理,利用BP神经网络建立了燕麦β-葡聚糖含量的预测模型,并得出以下结论:
1) 燕麦β-葡聚糖含量的敏感波段范围为492、874、930nm附近。
2) 燕麦β-葡聚糖含量的预测值与国标测定值之间的决定系数R2为0.75。
3) 燕麦β-葡聚糖含量的预测值与国标测定值之间的预测均方根误差(RMSEP)为0.009 8。
结果表明:燕麦β-葡聚糖含量的预测值与国标测定值之间有着较强的相关关系。因此,利用高光谱成像技术可以简单、快捷、无损、稳定地对燕麦β-葡聚糖含量进行测定,而且为大批量燕麦β-葡聚糖含量的快速检测提供便捷技术支持。
参考文献:
[1]杨海鹏,孙泽民.中国燕麦[M].北京:中国农业出版社,1989:10-15.
[2]张向前,刘景辉,齐冰洁,等.燕麦种质资源主要农艺性状的遗传多样性分析[J].植物遗传资源学报,2010,11(2):168-174.
[3]李进.燕麦的营养价值与保健功效[J].新疆农业科技,1993(5):38-39.
[4]李芳,刘刚,刘英,等.燕麦的综合开发与利用[J].武汉工业学院学报,2007,26(1):23-25.
[5]路长喜,周素梅,王岸娜.燕麦的营养与加工[J].粮油加工,2008(1):89-92.
[6]邓胜国,邓泽元.燕麦麸中β-葡聚糖的提取、测定及其在面条中的应用[J].食品科学,2004,25(11):204-206.
[7]胡新中,魏益民,任长忠.燕麦品质与加工[M].北京:科学出版社,2009.
[8]张娟,杜先锋,饶砚琴.刚果红法测定燕麦中β-葡聚糖含量的研究[J].安徽农业大学学报,2007,34(1):23-26.
[9]连喜军,鲁晓翔,蔡保松,等.国际标准酶法测定β-葡聚糖含量的研究[J].粮油食品科技,2006,14(6):27-29.
[10]郑殿升,吕耀昌,田长叶,等.中国裸燕麦β-葡聚糖含量的鉴定研究[J].植物遗传资源学报,2006,7(1):54-58.
[11]林伟静,吴广枫,王强,等. 燕麦及其制品β-葡聚糖含量测定方法比较[J].食品工业科技,2011(6):143-147.
[12]连喜军,鲁晓翔,林旭辉.苯酚-硫酸法测定β-葡聚糖含量研究[J].粮食与油脂,2005(10):39-43.
[13]Ariana D,Lu R,Guyer D E.Hyperspectral reflectance imaging for detection of bruises on pickling cucumbers[J].Computers and Electronics in Agriculture,2006,53(1):60-70.
[14]Qiao J,Ngadi M O,Wang N,et a1.Pork quality classification using a hyperspectral imaging system and neural network[J].International Journal of Food Engineering,2007,3(1):1-12.
[15]Xing J,Symons S,Shahina M,et a1.Detection of sprout damage in Canada Western Red Spring wheat with multiple wavebands using visible/near-infrared hyperspectral imaging[J].Biosystems Engineering,2010,106(2):188-194.
[16]Wallays C,Missotten B,Baerdemaeker J De,et a1.Hyperspectral waveband selection for on-line measurement of grain cleanness[J].Biosystems engineering,2009(104):1-7.
[17]周青梅,郭立芸,林智平.近红外光谱法测定麦芽中的β-葡聚糖[J].食品与发酵工业,2013(10):223-226.
[18]田海清,王春光,郝敏,等.基于光谱微分滤波及多元校正的马铃薯干物质含量快速检测[J].内蒙古农业大学学报,2013,34(5):93-97.
[19]赵杰文,刘剑华,陈全胜,等.利用高光谱图像技术检测水果轻微损伤[J].农业机械学报,2008,39(1):106-109.
[20]L H Liew, B Y Lee.Rectification of aerial images using piecewise linear transformation [J].Earth and Environmental Science ,2014 (18):1-6.
[21]Miguel A.Garcia,F.Rodriguez An Iterative Algorithm for Automatic Fitting of Continuous Piecewise Linear Models[J].Wseas Transactions on Signal Processing,2008(4):474-483.

