妊娠期高果糖膳食对子代胰岛素抵抗的影响
肖子义,贺 娟,梁 惠,赵 婷,吴若男,马爱国,韩 磊
(1青岛大学公共卫生学院,山东青岛 266021;2青岛大学附属医院,山东青岛 266021)
妊娠期糖尿病(gestational diabete mellitus,GDM)是妊娠期发生或首次发现的不同程度的葡萄糖耐量异常[1-2]。Zhu等[3]一项多中心研究表明,采用IADPSG诊断标准,2010年1月—2012年2月期间,中国GDM发病率占全部妊娠的17.5%。一项研究表明,妊娠期糖尿病的发生与孕期水果的摄入量密切相关[4]。文献报道,妊娠期每日果糖的摄入量由原来的16~20g升至现在的60~150g[5]。
研究表明,大量摄入果糖与以胰岛素抵抗为基础,中心性肥胖、脂质代谢异常为表现形式的大型综合征的发生发展密切相关[6-9]。但对于孕妇过量摄入果糖而引起的宫内不良环境对子代胰岛素抵抗的相关性研究较少。因此,本研究通过模拟孕妇摄入果糖情况,给予雌性大鼠不同剂量果糖,旨在观察妊娠期高果糖摄入对子代胰岛素抵抗的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 选择10w龄wistar雌性大鼠(SPF级)30只、雄性大鼠15只(SPF级),体重250±20g,购自济南朋悦实验动物繁育有限公司,生产合格证号SCXK(鲁)20140003。
1.1.2 主要试剂及仪器 D-果糖,美国Amresco公司,纯度>99%;蔗糖,美国Amresco公司,纯度>99%;电子天平,奥豪斯仪器(上海)有限公司;低温离心机,美国Sigma公司。ELx808型酶标仪,美国BioYek公司;胰岛素ELISA检测试剂盒,武汉基因美生物科技有限公司。
1.2 方法
1.2.1 动物分组与饲养 将30只雌性大鼠适应性喂养1w后,按照雌雄2∶1合笼,次日晨检发现阴栓或阴道涂片发现精子者即记为孕0d,标记为怀孕雌鼠,合笼2w后未受孕雌鼠弃之。孕鼠随机分为5组,每组6只,每日通过灌胃的方式连续干预3w。正常对照组(BC组)(2mL蒸馏水)、正常剂量果糖组(NF组)(2g/kg果糖溶液)、高剂量果糖组(HF组)(6g/kg果糖溶液)、超高剂量果糖组(SHF组)(18g/kg果糖溶液)、超高剂量蔗糖组(SHS组)(18g/kg蔗糖溶液)。各组娩出仔鼠随机选择9只基础饲料喂养。
1.2.2 观察指标和检测方法 (1)体重的测量:动物实验中心提供的电子称普通称量法。(2)FBS的测定:禁食12h,次日清晨针扎鼠尾取周围毛细血管血,用快速血糖仪测量。(3)OGTT试验:禁食12h,次日清晨针扎鼠尾取周围毛细血管血,用快速血糖仪测量。随后50%葡萄糖溶液灌胃(2g/kg),1、2h分别用快速血糖仪测量。(4)FINS的测定:禁食12h,次日腹主动脉取血,分离血清,按照试剂盒说明采用酶联免疫吸附法检测。
1.3 统计学分析
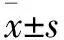
2 结果
2.1 妊娠期高果糖摄入对仔鼠体重的影响
HF组、SHF组娩出仔鼠体质量低于BC组娩出仔鼠体质量(P<0.05)(表1)。

表1 各组娩出仔鼠体质量比较
注:a表示于对照组有差异
2.2 妊娠期高果糖摄入对娩出仔鼠血糖的影响
HF组、SHS组娩出仔鼠空腹血糖与BC组和NF组娩出仔鼠空腹血糖相比差异无统计学意义(P>0.05),SHF组娩出仔鼠空腹血糖较BC组娩出仔鼠空腹血糖有所升高,差异有统计学意义(P<0.05)(表2)。
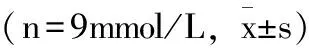
表2 各组娩出仔鼠血糖水平比较
注:a表示于对照组有差异
2.3 各组子代葡萄糖耐量试验结果
不同剂量果糖摄入组的娩出仔鼠在第8周进行OGTT试验。由表3、附图可见,在30min左右血糖吸收达到高峰,在30min处,HF组、SHF组、SHS组的血糖值较BC组、NF组相比,均有所升高,差异有统计学意义(P<0.05)。在120min处,HF组、SHF组、SHS组的血糖值较BC组相比升高,差异由统计学意义(P<0.05);SHF组、SHS组的血糖值较NF组相比,差异有统计学意义(P<0.05)。另外,在120min时,BC组和NF组血糖值基本恢复至初始血糖值,而HF组、SHF组、SHS组血糖值始终高于初始值。
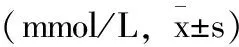
表3 各组子代葡萄糖耐量结果
注:a表示与对照组有差异;b表示与正常剂量果糖组有差异
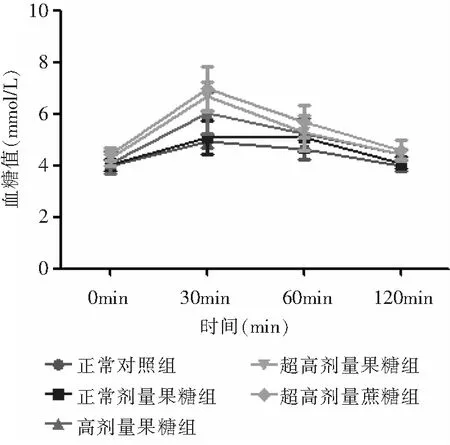
附图 葡萄糖耐量试验结果
2.4 妊娠期不同剂量果糖摄入对子代胰岛素水平及IR程度影响
SHF组、SHS组空腹血糖值显著高于BC组,差异有统计学意义(P<0.05)。HF组、SHF组、SHS组血清胰岛素含量显著高于BC组、NF组,差异有统计学意义(P<0.05)。HF组、SHF组、SHS组HOMA-IR值显著高于BC组、NF组,差异有统计学意义(P<0.05)(表4)。
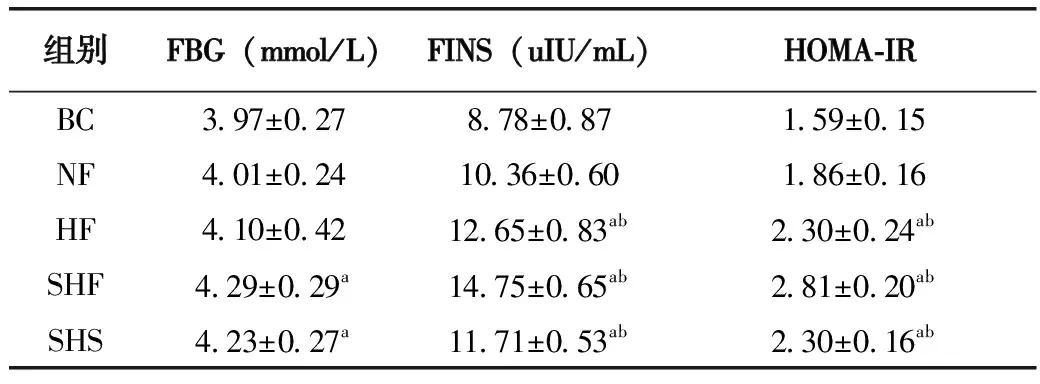
表4 不同剂量果糖摄入对子代胰岛素水平及IR程度影响
注:a表示与对照组有差异,b表示与正常剂量果糖组有差异
3 讨论
胎儿起源学说认为,如果在胚胎发育的重要阶段发生危害,则组织或细胞的生长会发生改变来弥补损伤,即发生生物学程序化[10]。孕期的营养不良及代谢紊乱已被证实与其子代的生长发育密切相关[11],同时也有研究指出,在妊娠阶段的不合理饮食将使后代成年后发生胰岛素抵抗及高血压、糖尿病、冠心病、卒中等疾病的风险明显增高[12]。现在越来越多的人将因为生命前期不良环境引起的自身变化以及远期影响用“编程”理论来阐述,因此,依据“编程学说”,可以解释在成年阶段患慢性非传染性疾病如糖尿病、高血压、血脂异常以及以胰岛素抵抗为基础的代谢综合征都与其生命早期宫内不良环境有关系,因为不良宫内环境产生的不良因素促使胎儿发生适应性调整或者永久改变[13]。这也在一定程度上解释了胰岛素抵抗和代谢综合征发病率迅速升高的原因。目前,胎儿起源学说已经成为研究热点,很多研究证实,在妊娠阶段胎儿营养不良或过剩都会对其成长造成影响,增加其在成年后IR的发病率[14-16]。
果糖的来源大致分为两类:一类是添加果糖的软饮料,约占70%;另一类为以水果的形式摄入,约占30%。妊娠期高果糖膳食的主要摄入方式为第二种。以往关于高果糖膳食的研究都是减少碳水化合物的摄入、增加果糖的供能比来研究高果糖膳食对机体健康的营养。本研究以模拟孕妇妊娠期水果摄入的方式,通过人与大鼠剂量等效换算方式[17],采用果糖灌胃的方式以不同剂量干预妊娠期雌鼠,来观察妊娠期不同剂量高果糖摄入与子代胰岛素抵抗之间的关系。
本研究显示,HF组、HS组娩出仔鼠空腹血糖与对照组和正常剂量果糖组娩出仔鼠空腹血糖相比,差异无统计学意义(P>0.05),SHF组娩出仔鼠空腹血糖较对照组娩出仔鼠空腹血糖有所升高,差异有统计学意义(P<0.05),这与之前研究结果一致[18]。妊娠期摄入大量果糖会导致子代血糖升高。最初,果糖被广泛应用于2型糖尿病患者的饮食中,是因为果糖的体内代谢不依赖胰岛素[5],但是有研究表明,摄入过多果糖会导致血糖的升高及胰岛素抵抗的发生发展[19]。
本研究显示,妊娠期高果糖摄入的子代FBS、FINS均有所升高,差异有统计学意义(P<0.05),这说明妊娠期高果糖膳食会引起子代糖代谢异常,这与之前的研究结果一致[20]。HF组、SHF组娩出仔鼠体质量低于BC组娩出仔鼠体质量,差异有统计学意义(P<0.05)。这与Seghieri等[21]的研究结论一致:宫内不良环境易导致子代低出生体重,同时低出生体重增加子代胰岛素抵抗的发生风险。子代糖代谢异常会增加许多慢性疾病发生的风险,有研究认为,妊娠期摄入过多果糖,会导致宫内的环境发生改变[22],这会刺激仔鼠胰岛细胞受损,子代出生后,胰腺经过一段凋亡和重组的时期,虽然在子代成年期胰岛数量已经恢复,但是存在分泌不足和胰岛素抵抗,这与本研究所得结论一致。
综上所述,本实验展示了妊娠期高果糖摄入对子代糖代谢产生了严重影响,从而进一步揭露高果糖膳食对子代引发的危害,为人群每日合理、安全摄入果糖提供一定的参考价值,尤其要对妊娠期高果糖膳食加以正确指导,合理摄入果糖,从而降低子代产生不良结局的风险。◇
[1]Young V J,Brown J K,Saunders P T K,et al.The role of the peritoneum in the pathogenesis of endometriosis[J].Human Reproduction Update,2013,19(5):558.
[2]Group G D.Diagnostic criteria and classification of hyperglycaemia first detected in pregnancy[J].World Health Organization,2013:63.
[3]Zhu W,Yang H,Wei Y,et al.Evaluation of the value of fasting plasma glucose in the first prenatal visit to diagnose gestational diabetes mellitus in China[J].Diabetes Care,2013,36(3):586-590.
[4]李青,吴晓敏,杨顺玉,等.饮食习惯对广东地区孕妇血糖的影响[J].南方医科大学学报,2015(5):772-776.
[5]Dornas W C,De Lima W G,Pedrosa M L,et al.Health implications of high-fructose intake and current research[J].Advances in Nutrition,2015,6(6):729-737.
[6]Correia M,Barroso,Barroso M F,et al.Contribution of different vegetable types to exogenous nitrate and nitrite exposure[J].Food Chemistry,2010,120(4):960-966.
[7]Zhang Z,Wang Z,Zhen Y,et al.A novel mice model of metabolic syndrome:the high-fat-high-fructose diet-fedICR mice[J].Experimental Animals,2015,64(4):435-442.
[8]Poudyal H,Panchal S,Brown L.Comparison of purple carrot juice and β-carotene in a high-carbohydrate,high-fat diet-fed rat model of the metabolic syndrome[J].British Journal of Nutrition,2010,104(9):1322-1332.
[9]T W,H K,Y M,et al.Spironolactone improves glucose and lipid metabolism by ameliorating hepatic steatosis and inflammation and suppressing enhanced gluconeogenesis induced by high-fat and high-fructose diet[J].Endocrinology,2010,151(5):2040-2049.
[10]朱毓纯,杨慧霞.妊娠期糖皮质激素对后代的远期影响[J].中国医刊,2006,41(12):27-30.
[11]施长春.宫内环境不良与生命早期糖脂代谢指标的前瞻性队列研究[D].浙江大学,2017.
[12]Barker D J,Eriksson J G,Fors N T,et al.Fetal origins of adult disease:strength of effects and biological basis[J].International Journal of Epidemiology,2002,31(6):1235.
[13]Nathanielsz P W,Poston L,Taylor P D.In utero exposure to maternal obesity and diabetes:animal models that identify and characterize implications for future health[J].Obstetrics & Gynecology Clinics of North America,2007,34(2):201-212.
[14]Bispham J,Gopalakrishnan G S,Dandrea J,et al.Maternal endocrine adaptation throughout pregnancy to nutritional manipulation:consequences for maternal plasma leptin and cortisol and the programming of fetal adipose tissue development[J].Endocrinology,2003,144(8):3575-3585.
[15]Benyshek D C,Johnston C S,Martin J F.Post-natal diet determines insulin resistance in fetally malnourished,low birthweight rats(F1)but diet does not modify the insulin resistance of their offspring(F2)[J].Life Sciences,2004,74(24):3033-3041.
[16]Symonds M E,Pearce S,Bispham J,et al.Timing of nutrient restriction and programming of fetal adipose tissue development[J].Proc Nutr Soc,2004,63(3):397-403.
[17]陈群,高洁,夏琰.2型糖尿病大鼠气阴两虚夹瘀证动物模型的建立对大鼠肾脏功能的影响[J].河南中医,2016,36(10):1722-1724.
[18]LI T,LU X,SUN Y,et al.Effects of spinach nitrate on insulin resistance,endothelial dysfunction markers and inflammation in mice with high-fat and high-fructose consumption[J].Food & Nutrition Research,2016,60(320):10.
[19]Elliott S S,Keim N L,Stern J S,et al.Fructose,weight gain,and the insulin resistance syndrome[J].American Journal of Clinical Nutrition,2002,76(5):911.
[20]Malcolm J.Through the looking glass:gestational diabetes as a predictor of maternal and offspring long-term health[J].Diabetes Metab Res Rev,2012,28(4):307-311.
[21]Petry C J,Dorling M W,Pawlak D B,et al.Diabetes in old male offspring of rat dams fed a reduced protein diet[J].Int J Exp Diabetes Res,2001,2(2):139.
[22]Scaglia L,Cahill C J,Finegood D T,et al.Apoptosis participates in the remodeling of the endocrine pancreas in the neonatal rat[J].Endocrinology,1997,138(4):1736-1741.
[23]赵迪迪,韩磊,贺娟,等.孕期高果糖摄入对胚胎发育和胎盘血管因子的研究[J].中国食物与营养,2017,23(3):54-58.
——控制性脐带牵引法预防第三产程产后出血的有效性研究:多中心随机对照试验

