核桃多肽对高糖诱导HepG2胰岛素抵抗模型的影响
李丽琪,徐华容,刘 阳,李 潇,蔡 依,阮金兰
(1武昌理工学院生命科学院/生物多肽糖尿病药物湖北省协同创新中心,武汉 430223;2武汉工程大学化工与制药学院,武汉 430073)
骨骼肌和肝脏是葡萄糖摄取的主要靶器官[1-5],当骨骼肌和/或肝脏对葡萄糖的使用发生异常时,胰岛素抵抗的发生机率将提高[6],所以探究HepG2用于建立体外胰岛素抵抗模型探索核桃多肽促葡萄糖吸收以及改善胰岛素抵抗的机制具有重要的意义。
1 试验材料
1.1 试验材料
L6细胞、HepG2细胞,中南民族大学药学院药理实验室;HT多肽、HT-1、HT-2,武昌理工学院生物多肽糖尿病药物湖北省协同创新中心自制(HT多肽批号:20141218;HT-1批号:20150816;HT-2批号:20150816)。
1.2 试验试剂
MEM-α培养基、胎牛血清,美国Hyclone公司;SDS-PAGE蛋白上样缓冲液,碧云天生物技术研究所;葡萄糖摄取细胞的测定试剂盒、葡萄糖摄取细胞的测定试剂盒、ECL化学发光检测试剂盒,Amersham-Pharmacia,Piscataway,USA;甘油、过氧硫铵、Tris-HCl、无菌PBS溶液、二甲亚砜,国药集团化学试剂有限公司;聚偏氟乙烯膜,Pall Corporation,Washington,USA;RIPA组织/细胞裂解液,北京阳光生物科技有限公司;BCA蛋白含量测定试剂盒,美国Abgent公司;门冬胰岛素注射液,丹麦诺和诺德公司;IRS-1抗体、p-IRS-1抗体、IRβ抗体、GLUT2抗体、β-actin抗体、Anti-rabbit IgG、Anti-mouse IgG,美国Cell Signaling公司;胰酶,美国GIBCO公司;双抗溶液,上海suer生物科技有限公司;丙烯酰胺、十二烷基硫酸钠、甘氨酸、四甲基已二胺、溴酚蓝、二硫代苏糖醇、甲醇、氨基丁三醇,美国Tedia公司。
1.3 试验仪器
Bio-RAD凝胶成像系统,美国Bio-Rad公司;Gel Image系统,APLEGEN,INC,USE;超净台,郑州宏朗仪器有限公司;CO2培养箱,上海博讯实业有限公司;XSM-20生物显微镜,宁波顺宇仪器有限公司;酶标仪,美国Thermo Fisher Scientific公司;WH-1微型漩涡混合仪,江苏盛蓝仪器制造有限公司;电泳仪,北京六一仪器厂;YXQ-LS-100 S II高温高压蒸汽灭菌锅,济南思卓医疗仪器制造有限公司。
2 试验方法
2.1 HT蛋白、HT多肽、HT-1、HT-2活性筛选
2.1.1 GLUT4转膜活性筛选[7]含有pIRAP-mOrange cDNAs的质粒通过lipofectamineTM 2000转染入L6细胞,转染操作依照试剂盒说明进行。将稳定表达IRAP-mOrange(L6 IRAP-mOrange)的L6细胞培养于含10%胎牛血清和1%双抗的α-MEM培养液中,隔天换液,于细胞培养箱中37℃、5%CO2条件下进行培养。实验前,细胞于48孔板中按照15 000个细胞/孔培养至融合状态,然后无血清饥饿培养4h。分别加入100 nmol的胰岛素和待筛选50μg/mL的HT多肽、HT-1、HT-2(胰岛素作为阳性对照药,每个样品重复3次),在0~30min之间,每5min拍摄1张,采用激光共聚焦扫描显微镜下观察IRAP-mOrange的转运上膜变化,实验中采用不加入Ca2+的观测模式,采用555 nm的激光通道。以细胞膜上荧光强度作为测量指标,用SPSS和Excel统计软件进行数据整理和统计,多组间显著性差异比较。
2.1.2 L6肌管细胞葡萄糖摄取活性筛选[8-9]L6成纤维细胞在含有10%胎牛血清、青霉素100 kU/L、链霉素100mg/L的高糖DMEM培养基中,置于CO2培养箱(37℃、5% CO2)培养,细胞长至80%左右传代。换用2%胎牛血清、青霉素100 kU/L、链霉素100mg/L的α-MEM培养基中进行分化,每48h换液1次。至第7天成纤维细胞90%以上分化为肌管细胞。将细胞接种于96孔板中,待其100%铺满孔底,换用无糖、无血清培养基饥饿2h。配置含100μg/mL浓度HT多肽、HT-1、HT-2的α-MEM培养基(胰岛素作为阳性对照给药浓度为100nmol)备用。L6细胞饥饿完成后,将每孔中培养基吸出,换用含药物培养基,每孔加入100μL配置好的给药培养基,孵育12h。随后按照葡萄糖氧化酶试剂盒的说明方法,分别取各孔上清培养液加2μL加入200μL反应试剂中,37℃恒温箱孵育30min,用酶标仪在波长为505 nm下检测各孔吸光度,细胞葡萄糖摄取率=[(空白组OD-给药组OD)/(空白组OD-未给药组OD)]*100%。
2.2 HT多肽、HT-1、HT-2对高糖诱导HepG2细胞 模型的影响[10]
2.2.1 细胞培养 配制培养基100mL(90%+10%胎牛血清+1mL双抗),复苏HEPG2细胞至培养瓶中,于5%CO2、37℃、95%空气饱和湿度培养箱中培养,观察细胞形态,待细胞完全贴壁后更换培养液,每3d按1∶3进行细胞传代,取对数生长期的细胞用于实验。当细胞长满80%时,用1mL胰酶消化,消化完全后,加入5mL培养液终止消化,反复吹打均匀并吸取2mL于10mL EP管中,用普通DMEM培养基稀释5倍,均匀接种于96孔板,每孔150μL,24 h后弃去上清液。
2.2.2 高糖培养基的配制 配制120mmol/L的高糖培养基为母液,精密称取171.2mg溶于10mL新鲜含酚红培养基中,用0.22μm滤头过滤除菌。分别配制0、30、40、50、60、70、80、90、100、120mmol/L高糖培养基。
2.2.3 高糖培养基的诱导 吸取掉废弃培养基,换新配制的高糖培养液,每个浓度6个复孔,每孔15μL,普通DMEM培养基为对照,放置培养箱中培养24h后,吸取掉高糖培养基,为防止酚红对结果的影响,用新鲜无酚红培养基清洗1遍,并点板,每孔100μL,放置培养箱24h。
2.2.4 GOD-POD法测葡萄糖吸收 从培养板中取2μL细胞培养液与200μL工作液于另一个96孔板混合,没有细胞的无酚红培养基为空白对照,在37℃反应30min,用酶标仪在505nm处测定吸光度,吸光度值越大,含糖量越高,选用葡萄糖消耗量最大时的葡萄糖添加量为最佳浓度的高糖培养基。
2.2.5 细胞给药 以2.2.4中得到的最佳效果的溶度建立模型,配制高糖培养基15mL,按2.1.1培养细胞,精密称取HT多肽冻干粉、HT-1、HT-2各1.0mg溶于10μL DMSO中,用无酚红培养基稀释,配制浓度为100μg/mL的培养液1mL,分别给药点板,每孔100μL,设置6个复孔,以5μg/mL的小檗碱为对照,高糖培养基为对照组,放置培养箱中培养24h。吸取掉高糖培养基,用新鲜无酚红培养基清洗1遍,并点板,每孔100μL,放置培养箱24h,新鲜无酚红培养基为空白对照,按2.1.4测葡萄糖吸收。选择给药效果最好的样品,设置3个浓度梯度,重复实验。
2.3 蛋白质印迹分析[11]
2.3.1 高糖、低胰岛素刺激诱导HepG2-IR细胞模型的建立 配制培养基200mL(90%普通培养基+10%胎牛血清+2mL双抗),培养细胞,待长满80%~90%时,从培养瓶中取4mL,用普通DMEM培养基稀释至10mL,于6孔板点板,每孔2mL,培养24h后,实验组为优选出的最佳浓度高糖培养液培养,对照组仍用普通DMEM培养基培养,24h后用室温预热的PBS冲洗2遍后,用含100nmol/L胰岛素的普通DMEM培养基孵育10min(放置5%CO2,37℃培养箱)。
2.3.2 细胞给药 选用3.3.2中效果最佳的样品精密称取1.0mg,用10μL DMSO超声使充分溶解后,于普通DMEM培养基稀释,分别配制终浓度为50、100μg/mL的含药培养基2mL,以5μg/mL的小檗碱为对照组,空白对照孔仍用普通DMEM培养基,每孔2mL,培养24h。
2.3.3 Westernblot检测蛋白表达
实验步骤:润洗→检漏→上分离胶→除气泡→封满静置使凝胶→上浓缩胶→插梳→静置使凝胶→拔梳→上样→跑胶→转膜→封膜→敷一抗→敷二抗→显影
BCA法绘制蛋白标准曲线图:按50体积BAC试剂A加1体积BAC试剂(50∶1)配制适量的BCA工作液,充分混匀(室温24h使用完)。完全溶解的蛋白标准品,取10μL用PBS稀释100μL,使终浓度为0.5mg/mL,将标准品按0、1、2、4、8、12、16、20μL加到96孔板中,加PBS稀释到20μL,各孔再加BCA工作液200μL,37℃放置30min。用酶标仪检测波长562nm吸光度,绘制蛋白标准曲线。
药物干预24h后,弃去培养液,用PBS将细胞洗3遍,分别转入2mL EP管中,放入离心机2 000r离心10min,去掉上清液留底部细胞,每孔加入100μL裂解液用枪吹打数下,使裂解液和细胞充分接触,置冰上40min,期间每隔10min用振荡仪振荡1次。充分裂解后,12 000r离心10min,取上清液即为细胞总蛋白,根据标准曲线检测蛋白浓度,剩余蛋白经缓冲液处理、蛋白变性。
2.3.4 十二烷基硫酸钠聚丙烯酰胺凝胶电泳实验 选择1.5cm的制胶板,清洗干净晾干后组装好垂直电泳板,去离子水润洗并加满检漏,20min后液面没有下降,倒掉去离子水,每边用移液枪加入8%分离胶1 000μL*6,缓慢加入200μL异丙醇除气泡,去离子水封满,静置30min,倒掉制胶器中液体,加满浓缩胶,迅速插入样梳,将整个制胶器放入透明槽内,加满1*Running Buffer,静置30min拔梳,去除蛋白样品,温水浴解冻,取等量蛋白样品30μg上样(根据蛋白标准曲线换算为体积),插上电极,在80V电压下跑胶40min,切换电压120V,跑胶2h。
2.3.5 转膜 电泳结束后,采用湿转法将蛋白转移至NC膜上,用含5%脱脂奶粉的TBST溶液室温摇床30r封闭2h封膜,将切割大小与凝胶大小一致的PVDF膜置于无水甲醇中浸泡3min,将泡好的PVDF膜及滤纸放于转移缓冲液中,约30~60min,排净膜上空气,按3层滤纸、PVDF膜、凝胶、3层滤纸的顺序从下到上放入转膜仪中,恒定电流300mA下电转1.5h。
2.3.6 封闭 转膜结束后,将PVDF膜浸泡于5%脱脂牛奶中封闭液,完全排除气泡后,低速摇床30r室温封闭2 h,封闭完成后洗膜。
2.3.7 蛋白抗体的孵育 将封闭后的PVDF膜浸没于相应蛋白的一抗(1∶2 000)4℃摇床低速30r孵育1夜,p-IRS-1抗体孵1天2夜,β-actin 2 h,孵育结束后,弃去封闭液,用TBST室温震摇洗膜,将PVDF膜浸于用适量TBST按1∶5 000稀释的二抗溶液中,在室温下孵育1h。结束孵育后,用TBST洗液室温振摇洗膜3次,每次10min。
2.3.8 显影 将含蛋白面的PVDF膜置朝上放置洁净的玻璃皿上,并将ECL化学发光试剂A液和B液等体积充分混合均匀,用移液枪吸取滴于PVDF膜蛋白面上,完全浸湿,室温反应1min,于ECL化学发光仪中曝光,曝光时间由目的蛋白的荧光强弱而定。印迹条带利用Odyssey双色红外荧光成像系统对目的条带进行扫描,然后用Image软件进行条带分析。
3 结果与讨论
HT多肽、HT-1和HT-2在降糖生物活性上都有一定的作用,其中HT-2的降糖效果最为显著。
3.1 GLUT4转膜活性筛选
由图1可知,HT多肽、HT-1、HT-2均有一定的促GLUT4活性,但是量效曲线分布趋势不相同,其中趋势分布较好的为HT-2,随着时间延长,促GLUT4转膜效应逐渐增加,核桃多肽促GLUT4上膜效应很快,5min即达峰值,HT-2促GLUT4上膜效应较慢,15min开始响应,30min达峰值。胰岛素(100nmol)和小檗碱(BBR,5μg/mL)作为阳性对照药,均显示很强的促GLUT4转膜活性,转膜提升倍数分别为2.66、2.46倍,说明选择的系统和构建的模型成功;HT多肽、HT-1、HT-2以50μg/mL给药均具有一定的促GLUT4转膜活性(图2)。运用基于L6细胞GLUT4荧光标记和转染的促GLUT4转位上膜筛选方法对HT多肽、HT-1、HT-2进行了筛选,结果显示,核桃多肽富集部位HT-2具有良好的促GLUT4转位上膜活性,在25min细胞膜上GLUT4增加1倍(图3)。
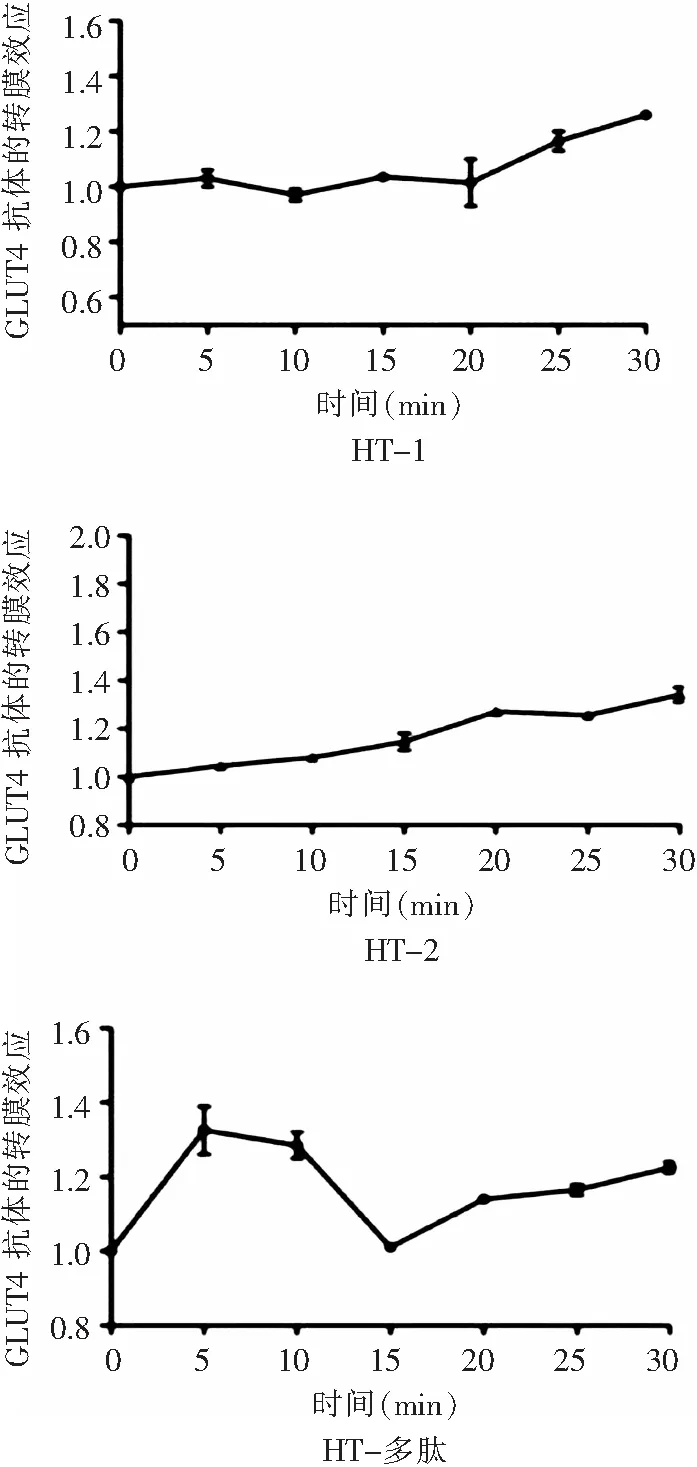
图1 HT多肽、HT-1、HT-2对GLUT4转膜的时间效应
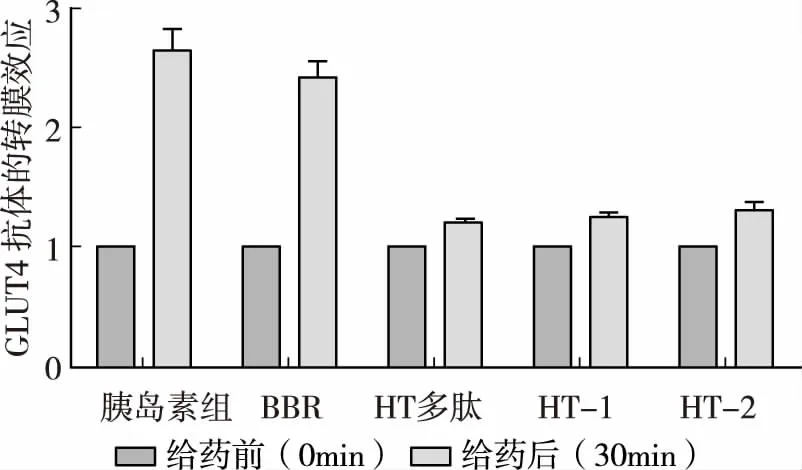
图2 HT多肽、HT-1、HT-2对GLUT4转膜的促进作用

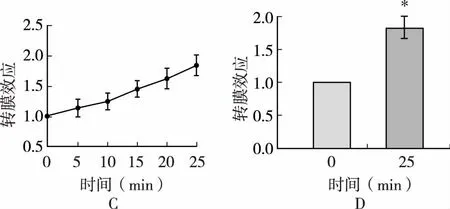
图3 HT-2对L6细胞中GLUT4转位的影响注:A给药前L6细胞中GLUT4的分布情况;B给药25min后L6细胞中GLUT4的分布情况;C给药25min内荧光值的变化;D给药前和给药25min后荧光值的变化;*P≤0.05,与给药前相比较
3.2 L6肌管细胞葡萄糖摄取(消耗)活性筛选
由图4可知,胰岛素(100nmol)和小檗碱(BBR,5μg/mL)作为阳性对照药,在L6细胞上均显示很强的葡萄糖摄取活性,摄取率分别为2.38、1.78,说明选择的系统和构建的模型成功;HT-多肽、HT-1和HT-2均有一定的葡萄糖摄取活性,摄取率分别为1.16、1.06和1.36。

图4 HT蛋白、HT-1、HT-多肽和HT-2葡萄糖摄取活性
3.3 不同浓度高糖诱导的HepG2葡萄糖消耗量的影响
与对照组相比,实验组的葡萄糖吸光度均有明显的下降,综合考虑葡萄糖用量,选用50mmol/L高糖诱导建立胰岛素抵抗细胞模型(图5)。
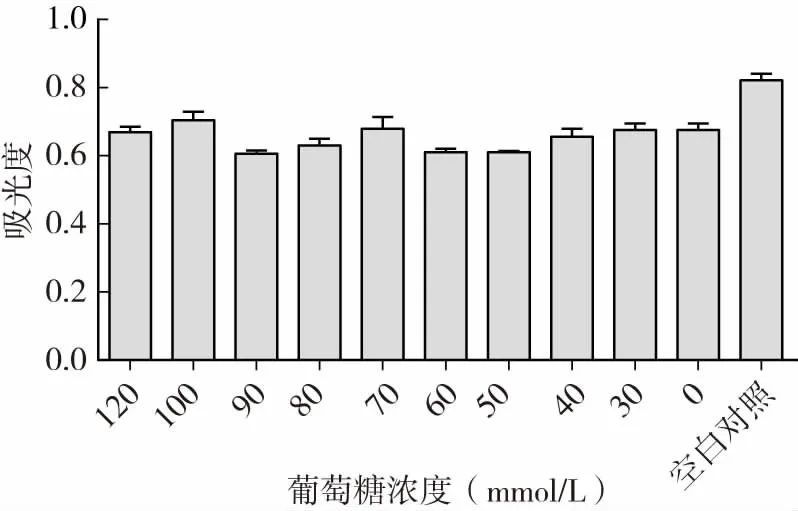
图5 不同浓度高糖培养基诱导的HepG2细胞葡萄糖消耗量的影响
3.4 HT多肽、HT-1、HT-2对高糖诱导的HepG2葡萄糖消耗量的影响
50mmol/L的高糖培养基诱导后,不同组分的核桃多肽(100μg /mL)对HepG2细胞葡萄糖消耗量的影响,与空白对照组相比,实验组的吸光度均有一定的降低,阳性组小檗碱有良好的降糖效果,实验组中HT-2效果相对较好(图6)。
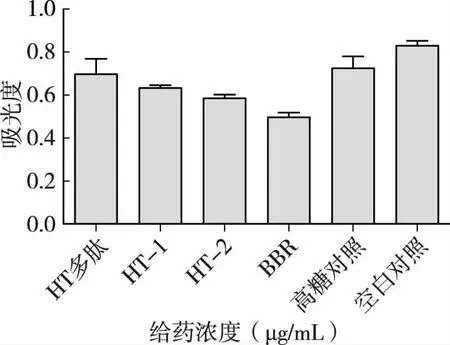
图6 核桃多肽对高糖诱导的HepG2细胞葡萄糖消耗量的影响
3.5 HT-2对高糖诱导的HepG2葡萄糖消耗量的影响
与对照组和空白对照组相比,HT-2有一定的降糖作用,且随着给药浓度的加大,葡萄糖消耗量增加,即降糖作用与HT-2的浓度呈依赖性增加(图7)。

图7 不同浓度HT-2高糖诱导的HepG2细胞葡萄糖消耗量的影响
3.6 Westernblot检测蛋白表达结果
蛋白标准曲线图见附表、图8。本研究通过蛋白印迹进行HT-2改善脂质代谢的体内分子机制的研究,用一定浓度的HT-2处理胰岛素抵抗的HepG2细胞,评估HT-2对IRβ、IRS-1、P-IRS-1、GLUT2的影响,与空白对照组相比,IRβ、IRS-1蛋白、GLUT2蛋白的表达水平呈浓度依赖性增加,图9表明,HT-2通过胰岛素信号传导途径改善葡萄糖代谢。

附表 标准蛋白吸光度数据
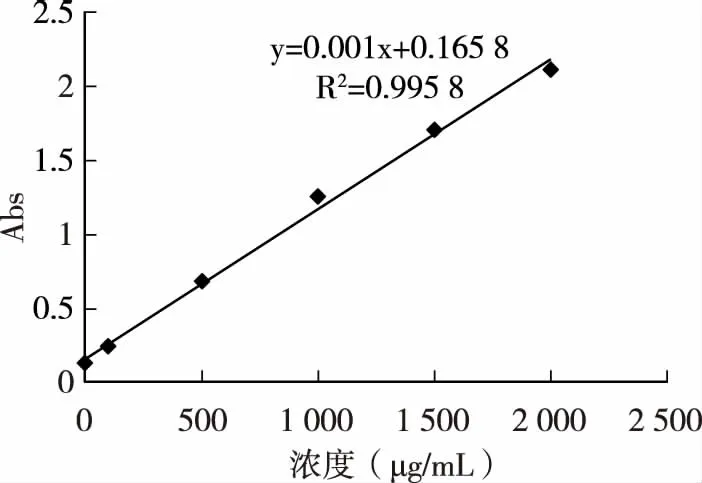
图8 蛋白标准曲线


图9 HT-2对高糖诱导HepG2细胞胰岛素受体蛋白、磷酸化胰岛素受体蛋白、GLUT2蛋白表达水平的影响注:与正常组比较,+++P<0.001、++P<0.01、+P<0.03,与模型组比较,+++P<0.001、++P<0.01、+P<0.03
4 结论
根据GLUT4转膜活性筛选和L6肌管细胞葡萄糖摄取活性筛选结果,HT多肽、HT-1和HT-2均显示有一定的生物活性,其中HT-2转膜活性和葡萄糖摄取活性相对较好;并且在高糖诱导HepG2细胞检测葡萄糖摄取实验中,HT-2的降糖效果也较HT多肽、HT-1的显著。肝脏是用于储存和释放碳水化合物的主要组织,GLUT2存在于肝脏组织中,并且GLUT2易位可刺激葡萄糖的摄取,因此GLUT2在肝脏葡萄糖和脂质代谢的调节中起着关键的作用,在蛋白质印迹结果中可发现,HT-2可以上调糖尿病小鼠肝脏组织GLUT2蛋白水平,并对IRβ、IRS-1蛋白的表达水平具有一定的增强效果,表明HT-2对高糖诱导的胰岛素抵抗HEPG2细胞具有有益作用,即通过胰岛素信号通路改善肝脏糖脂代谢,包括改善葡萄糖耐量,降低高血糖并恢复胰岛素水平。◇
[1]Qi SY,Zhang ZW,Zhao K,et al.Evaluation of walnut by terahertz nondestructive technology[J].Guang Pu Xue Yu Guang Pu Fen Xi,2012,32(12):3390-3393.
[2]孙树杰,王兆华,宋康,等.核桃营养价值及功能活性研究进展[J].中国食物与营养,2013,19(5):72-74.
[3]孙一.核桃多肽的抗氧化活性研究[D].长春中医药大学,2013.
[4]郭世彪,程春梅.抗糖尿病药物的研究现状与展望[J].中国药物与临床,2014(8):1066-1068.
[5]Bastien-Dionne PO,Valenti L,Kon N,et al.Glucagon-like peptide 1 inhibits the sirtuin deacetylase SirT1 to stimulate pancreatic beta-cell mass expansion[J].Diabetes,2011,60(12):3217-3222.
[6]黄建华.2型糖尿病相关的代谢组学和生物信息学研究[D].中南大学,2014.
[7]张远远.AMPK基因在2型糖尿病发病中的作用[D].北京协和医学院,2011.
[8]She S,Liu W,Li T,et al.Effects of puerarin in STZ-induced diabetic rats by oxidative stress and the TGF-beta1/Smad2 pathway[J].Food Funct,2014,5(5):944-950.
[9]余华辉,张延洁.肌腱细胞培养方法的研究进展[J].中国细胞生物学学报,2016(3):312-321.
[10]李秀丽,贺嵩敏,朱莹,等.HepG2细胞胰岛素抵抗模型的建立与鉴定[J].中国实验方剂学杂志,2013,19(5):203-207.
[11]万春平,魏雅改,李晓雪,等.胡椒碱对HepG2细胞胰岛素抵抗模型糖代谢AMPK信号通路上游靶点干预机制的研究[J].中国中药杂志,2017,42(3):542-547.

