CYP46A1过表达对阿尔茨海默病转基因模型小鼠的认知改善和抗炎症作用
赵敏,孔彦莹,严华成,刘乐斌,苏建新,周志坚,于德宪,彭秋菊,谢丽
阿尔茨海默病(Alzheimer's disease,AD)是一种以记忆减退和认知功能障碍为特征的中枢神经退行性疾病,其病理学特征包括神经元外大量β-淀粉样蛋白(β-amyloid protein,Aβ)沉积形成的老年斑、皮质神经元内τ蛋白异常聚集形成的神经原纤维缠结、胶质细胞增生以及脑内炎性浸润等[1]。该疾病是最常见的一种痴呆类型,发病率随年龄的增长而增加,但其病因及发病机制目前尚不清楚。
大量研究表明,脑内的胆固醇水平与AD的发病密切相关[2-3]。由于胆固醇不能通过血脑屏障,只有依靠其代谢产物才能保持在脑内的动态平衡[4],因此,胆固醇的主要代谢酶细胞色素P450 46A1(CYP46A1)[5-6]的表达水平及功能状态直接影响其细胞内水平。此外,病例对照研究发现,不同人种的CYP46A1基因多态性均能显著增加AD的发病风险[7],如果把CYP46A1的表达阻断,小鼠脑内会出现更多的Aβ沉积或神经元死亡[8]。以上研究提示,CYP46A1可能在AD的发生发展中发挥重要作用,但CYP46A1对于AD的治疗作用目前尚未见文献报道。本研究以AD转基因小鼠模型作为研究对象,通过慢病毒体系转染使小鼠脑内过表达人源CYP46A1基因,检测其行为学表现、Aβ沉积情况、星形胶质细胞数量、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-1β(interleukin-1 beta,IL-1β)表达水平等评价指标,研究CYP46A1基因过表达对AD模型小鼠的治疗作用。
1 材料与方法
1.1 实验动物 5XFAD转基因小鼠(雄性,3月龄,20~25g)由南方医科大学神经生物学教研室赠予,共表达5种家族性AD基因突变[APP K670N/M6 71L(Swedish)+716V(Florida)+V717I(London)和PS1 M146L+L286V]的APP/PS1双转基因小鼠[9]。小鼠饲养于标准的实验室环境内,温度23±1℃、白天-黑夜循环(12h:12h)、鼠笼大小300mm×170mm×120mm,自由摄食。
1.2 实验分组及处理 实验一:5XFAD转基因小鼠的功能检测实验。分别选取3月龄的5XFAD转基因小鼠和野生型小鼠各12只,进行Morris水迷宫检测,实验结束后,每组随机挑取3只小鼠进行ELISA检测,另每组挑取6只小鼠进行免疫组化染色。实验二:CYP46A1过表达干预实验。选取3月龄的5XFAD转基因小鼠24只,其中12只在双侧海马注入含CYP46A1的慢病毒作为实验组,另外12只则注射空载体作为对照组,感染2个月后,先进行T迷宫检测,再进行Morris水迷宫检测,行为学评价完成后,每组随机选取6只取脑组织进行免疫组化染色,观察脑内Aβ的沉积以及星形胶质细胞的表达情况;另外每组随机挑选3只,通过ELISA法检测海马组织中Aβ40、Aβ42、TNF-α以及IL-1β的表达水平。
1.3 主要仪器和试剂 立体定位仪(Stoelting公司),Morris水迷宫(上海吉量软件科技有限公司);RNAiso plus试剂和RT-PCR检测试剂盒购自TaKaRa公司;抗CYP46A1抗体购自Proteintech公司;抗Aβ抗体购自Covance公司;抗GFAP 抗体购自Abcam公司;小鼠源性Aβ40ELISA试剂盒(KMB3481)、小鼠源性Aβ42ELISA试剂盒(KMB3411)购自Invitrogen公司;小鼠源性TNF-α ELISA试剂盒(EK0527)和小鼠源性IL-1β ELISA试剂盒(EK0394)购自武汉博士德生物工程有限公司;免疫组化染色试剂盒(SP法)购自中杉金桥公司。
1.4 5XFAD转基因小鼠的鉴定 剪取出生后1周的待鉴定小鼠组织(按标记部位剪取:尾巴3mm左右,耳朵米粒大小,前肢或后肢取1根脚趾),提取组织DNA,基因鉴定的PCR扩增条件如下:94℃ 2min;94℃ 30s,54℃ 1min,72℃ 1min,共45个循环。引物序列如下:App5为目的片段,上游引物为5'-AATAGAGAACGGCAGGAGCA-3',下游引物为5'-GCCATGAGGGCACTAATCAT-3',基因扩增产物为608bp;对照基因的上游引物为5'-CTAGGCCACAGAATTGAAAGATCT-3',下游引物为5'-GCCATGAGGGCACTAATCAT-3',基因扩增产物为324bp。PCR产物加入1.5%琼脂糖凝聚电泳进行分析,若只出现324bp位置的条带,则判定为野生型;若在324bp以及608bp这两个位置均有条带,则判定为5XFAD基因携带小鼠。图1A为基因鉴定图片。
1.5 病毒包装及处理 常规方法制备CYP46A1过表达的慢病毒,滴度为3×108TU/ml。通过立体定位仪将病毒定位注射到3月龄的雄性5XFAD小鼠双侧海马组织中(n=12),对照组(n=12)则注射空载体到相应的部位,通过RT-PCR、Western blotting实验验证CYP46A1的过表达效果。2个月后,采用T迷宫实验以及Morris水迷宫评价小鼠的认知状况,通过免疫组化法观察脑内Aβ的沉积以及星形胶质细胞的表达情况,通过ELISA法检测海马Aβ及炎症因子的表达水平。
1.6 RT-PCR检测CYP46A1基因mRNA的表达Trizol法提取海马总RNA。反转录和PCR扩增均按照TaKaRa公司的试剂盒的说明书进行操作,CYP46A1基因引物序列如下:CYP2J2为目的片段,上游引物为5'-AGAAGTATGGTCCTGTTGTA-3',下游引物为5'-ACATTCAGACACCAAGCC-3',基因扩增产物为212bp;18S rRNA作为内参,上游引物为5'-GATCTGGCACCACACCTT-3',下游引物为5'-TACAGGGACAGCACAGCCT-3',基因扩增产物为177bp。PCR扩增条件为:94℃ 1min;94℃ 30s,55℃ 30s,72℃ 1min,35个循环;72℃ 2min,4℃保持。
1.7 ELISA检测 参照文献[10]的方法,用10%水合氯醛深度麻醉小鼠,断头取脑,快速分离海马,并加入2ml/g的蛋白裂解缓冲液(137mmol/L NaCl,20mmol/L Tris,1% NP-40,10%甘油,1mmol/L苯甲基磺酰氟,10μg/ml胰蛋白酶抑制剂,0.5mmol/L钒酸钠)。研磨匀浆,4℃下2500r/min离心15min,收集上清,按照TNF-α(或IL-1β、Aβ40、Aβ42)的ELISA试剂盒操作说明书进行检测,最后用酶标仪测定450nm处吸光度(OD)值,计算出对应的浓度。
1.8 免疫组织化学染色 参照文献[10]的方法,用10%水合氯醛深度麻醉小鼠,剪开胸腔暴露心脏,用4%多聚甲醛经主动脉灌注固定后取脑,放入30%蔗糖溶液中24~48h,沉底后行40μm厚冰冻切片,按照标准的SP法步骤行免疫组织化学染色。一抗分别为小鼠源性抗Aβ抗体(SIG-39220-200)和兔源性抗GFAP抗体(ab7260),1:400稀释;二抗分别为山羊抗小鼠IgG-HRP和Alexa Fluor 488标记的山羊抗兔IgG,1:1000稀释。Aβ抗体通过DAB染色,在普通显微镜下观察,GFAP抗体直接在荧光显微镜下观察。
1.9 Morris水迷宫检测 参照文献[11]的方法,简述如下:每次训练分4个步骤进行,每步均从新的入水点放入,入水前令小鼠面向池壁,记录小鼠从入水到爬上平台的时间(潜伏期),如果小鼠在90s内未找到平台,则由实验者将其引导上平台,并记作90s,小鼠爬上平台后休息30s后再进行下一次实验,取4次训练成绩的算术平均数记为当天的潜伏期时间。经过4d训练之后,第5天时将平台撤掉,让小鼠在水池里游泳90s并记录其轨迹,分析每只小鼠在平台所在的象限内游泳时间及路程占总时间和总路程的百分比。为排除感觉、视觉或运动功能障碍对空间学习记忆的影响,实验结束后,让平台位置露出水面2cm,并贴上黄色胶带,其余操作同隐蔽平台试验,即可视平台试验(cued test)。
1.10 T迷宫检测 检测方法[12-13]简述如下:首先将小鼠放置在T迷宫的起始臂,让其自由探索;当小鼠进入其中一侧目标臂(以四肢均进入为标准)时,马上关闭闸门,记录首次进入的目标臂(左侧或右侧);关闭25s后,将小鼠放回鼠笼,打开所有闸门;再次将小鼠放入起始臂,让其自由探索;记录小鼠第2次所进入的目标臂,然后将其放回鼠笼。如果测试小鼠第2次进入了一个不同的目标臂,计得分正确1次,否则为错误。每只小鼠训练2次/d,连续10d。最后计算各组小鼠在20次训练中的平均正确率。
1.11 统计学处理 采用SPSS 13.0软件进行统计分析。Morris水迷宫训练中的逃避潜伏期以及游泳平均速度进行重复测量数据的方差分析,并使用LSD-t法或Tamhane'sT2法进行两两比较。其余数据的比较采用Student'st检验。所有实验结果均采用表示。P<0.05为差异有统计学意义。
2 结 果
2.1 5XFAD转基因小鼠的鉴定及功能检测 图1A为基因鉴定时的示意图,5XFAD转基因小鼠在电泳图中显示有2条带,而野生型小鼠则仅1条带。Morris水迷宫检测发现,与野生型小鼠相比,3月龄的5XFAD转基因小鼠在隐蔽平台训练中的逃避潜伏期显著延长(P<0.01,n=12,图1B),而在可视平台试验中的潜伏期并无明显差异,提示该组小鼠的学习记忆能力明显下降。行为学检测结束后,每组各随机选取3只小鼠取其脑组织进行ELISA检测,另各取6只小鼠进行大脑切片并行免疫组化染色。结果发现,3月龄的5XFAD转基因小鼠脑内TNF-α(P<0.001,n=3,图1C),IL-1β(P<0.01,n=3,图1C),Aβ(P<0.01,n=6)表达水平以及星形胶质细胞的数量(P<0.01,n=6,图1D)均比野生型小鼠有显著上调。
2.2 脑内过表达CYP46A1对5XFAD转基因小鼠认知障碍的改善作用 RT-PCR和Western blotting检测结果显示,过表达人源CYP46A1(pLV-CYP46A1)的5XFAD转基因小鼠,其海马组织中CYP46A1 mRNA和蛋白表达水平均明显高于对照组(图2A、B)。T迷宫实验显示,pLV-CYP46A1组小鼠的平均正确率比对照组显著增高(P<0.05,图2C)。Morris水迷宫实验显示,pLV-CYP46A1组小鼠在获得性训练期间找到平台的潜伏期比对照组小鼠显著缩短(P<0.05,图2D),而两组小鼠的游泳速度以及可视平台试验的潜伏期比较差异均无统计学意义(P>0.05,图2E);在探查训练期间,pLV-CYP46A1组小鼠在目标象限的时间和路程占总时间(P<0.05,图2F)及总路程的百分比(P<0.05,图2G)均明显高于对照组,而其穿越的平台次数虽比对照组有增多的趋势,但差异无统计学意义(P=0.079,图2H)。
此外,Aβ免疫组化染色以及斑块面积统计显示,pLV-CYP46A1组小鼠海马区的淀粉样斑块面积显著减少(P<0.01,图3A、B);ELISA实验发现,该小鼠海马区的Aβ40(P<0.05)及Aβ42的表达(P<0.01,图3D)均明显下降。

图1 5XFAD转基因小鼠的基因鉴定及各项指标检测Fig. 1 Genetic identification and functional detection of 5XFAD transgenic mice
2.3 过表达CYP46A1对5XFAD转基因小鼠脑内星形胶质细胞数量及炎症浸润的影响 免疫组化染色发现,pLV-CYP46A1组小鼠海马区域的星形胶质细胞数量比对照组相应部位显著减少(P<0.05,图3A,C);ELISA实验发现,pLV-CYP46A1组小鼠海马区域的IL-1β和TNF-α表达水平也比对照组显著下降(P<0.05,图3E)。
3 讨 论
AD病情呈进行性发展,但由于其病因及发病机制尚不清楚,因而尚无特效的治疗药物或方法,患者通常在确诊的3~9年死亡,是本世纪危害人类健康的最严重疾病之一。
大脑是体内胆固醇含量最高的组织,其胆固醇占机体总量的23%,而脑重量只占体重的2.1%。此外,胆固醇为合成神经细胞膜所必需,在髓鞘内含量很高,并形成脂质筏,后者是装配β和γ分泌酶,以及将淀粉样前体蛋白(amyloid precursor protein,APP)加工为Aβ的平台[14]。当酯化胆固醇过多时,膜脂转运减少,可致Aβ生成和聚集增多而清除减少,导致AD发生。在脑内,CYP46A1是胆固醇代谢的主要酶[5-6],由于胆固醇不能通过血脑屏障,它只能依靠CYP46A1将其代谢为24s-羟基胆甾醇,然后再由后者透过血脑屏障来保持其在脑内的动态平衡[4]。在正常大脑中,CYP46A1主要表达在额叶皮质的椎体神经元上,而在AD患者中,此区域的神经元大量丢失或萎缩,推测血浆24s-羟基胆甾醇的减少很有可能是由于此处含CYP46A1神经元的死亡造成的[15]。
此外,AD的发生发展通常伴随着星形胶质细胞的激活以及慢性炎症反应,前者表现为星形胶质细胞数量增加、体积增大以及能动性增强,而后者则是神经元死亡的重要原因[16]。研究发现,在AD患者大脑的皮质和皮质下结构,存在着广泛的星形胶质细胞激活[17],而激活的星形胶质细胞能够分泌多种炎症因子,包括IL、TNF、干扰素(interferons,IFN)、一氧化氮(nitric oxide,NO)等,它们大部分(如IL-1β、IL-6、TNF-α等)对神经细胞具有毒性作用,进而可引起神经细胞的凋亡或坏死[19-20]。
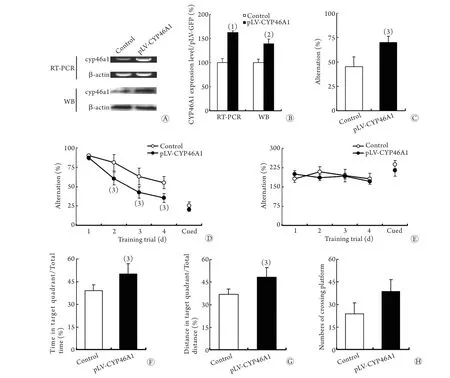
图2 脑组织过表达CYP46A1对5XFAD转基因小鼠认知障碍的改善作用Fig. 2 Overexpression of CYP46A1 in brain tissue improved the cognitive impairment in 5XFAD transgenic mice
本研究采用5XFAD转基因小鼠作为AD模型小鼠,该小鼠携带3个APP 突变基因和2个PS1突变基因[9]。本研究结果显示,3月龄的5XFAD转基因小鼠即出现学习记忆能力下降、脑内老年斑块、胶质细胞增生以及IL-1β和TNF-α等炎症因子表达升高(图1B–D),提示该转基因小鼠与AD具有相似的功能学及病理变化特征。此外,本研究还发现,过表达人源CYP46A1后,5XFAD转基因小鼠的认知障碍得到显著改善(图2),其海马区域的Aβ斑块面积及星形胶质细胞数量显著减少(图3A–C),同时,Aβ40、Aβ42、IL-1β和TNF-α的表达水平也均出现显著下降(图3D,E),提示CYP46A1在AD的发生发展过程中具有重要作用,其机制可能与减少Aβ沉积、降低脑内炎症反应水平有关。本研究的结果与国内外在CYP46A1基因多态性增加AD的发病风险[7]以及阻断CYP46A1的表达可加重AD的相关症状[8]等研究结果一致,并进一步证实了CYP46A1对于AD的治疗价值。本研究结果为揭示AD的发生机制奠定了基础,并为AD的预防和治疗提供了理论基础和新的靶点。
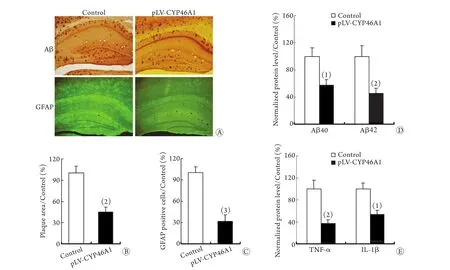
图3 过表达CYP46A1对5XFAD转基因小鼠脑内Aβ沉积及炎症浸润的影响Fig. 3 Overexpression of CYP46A1 ameliorated the Aβ deposition and inflammatory infiltration in 5XFAD transgenic mice
【参考文献】
[1]Minter MR, Taylor JM, Crack PJ. The contribution of neuroinflammation to amyloid toxicity in Alzheimer's disease[J].J Neurochem, 2016, 136(3): 457-474.
[2]Allinquant B, Clamagirand C, Potier MC. Role of cholesterol metabolism in the pathogenesis of Alzheimer's disease[J]. Curr Opin Clin Nutr, 2014, 17(4): 319-323.
[3]Maulik M, Westaway D, Jhamandas JH,et al. Role of cholesterol in APP metabolism and its significance in Alzheimer's disease pathogenesis[J]. Mol Neurobiol, 2013, 47(1): 37-63.
[4]Papassotiropoulos A, Lutjohann D, Bagli M,et al. Plasma 24S-hydroxycholesterol: a peripheral indicator of neuronal degeneration and potential state marker for Alzheimer's disease[J]. Neuroreport, 2000, 11(9): 1959-1962.
[5]Mast N, Charvet C, Pikuleva IA,et al. Structural basis of drug binding to CYP46A1, an enzyme that controls cholesterol turnover in the brain[J]. J Biol Chem, 2010, 285(41): 31783-31795.
[6]Russell DW, Halford RW, Ramirez DM,et al. Cholesterol 24-hydroxylase: an enzyme of cholesterol turnover in the brain[J]. Annu Rev Biochem, 2009, 78: 1017-1040.
[7]Garcia AN, Muniz MT, Souza e Silva HR,et al. Cyp46 polymorphisms in Alzheimer's disease: a review[J]. J Mol Neurosci, 2009, 39(3): 342-345.
[8]Djelti F, Braudeau J, Hudry E,et al. CYP46A1 inhibition, brain cholesterol accumulation and neurodegeneration pave the way for Alzheimer's disease[J]. Brain, 2015, 138(Pt 8): 2383-2398.
[9]Oakley H, Cole SL, Logan S,et al. Intra-neuronal beta-amyloid aggregates, neurodegeneration, and neuron loss in transgenic mice with five familial Alzheimer's disease mutations: potential factors in amyloid plaque formation[J]. J Mol Neurosci, 2006,26(40): 10129-10140.
[10]Yan HC, Qu HD, Sun LR,et al. Fuzi polysaccharide-1 produces antidepressant-like effects in mice[J]. Int J Neuropsychopharmacol, 2010, 13(5): 623-633.
[11]Vorhees CV, Williams MT. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc, 2006, 1(2): 848-858.
[12]Deacon RM, Rawlins JN. T-maze alternation in the rodent[J].Nat Protoc, 2006, 1(1): 7-12.
[13]Senior SL, Ninkina N, Deacon R,et al. Increased striatal dopamine release and hyperdopaminergic-like behaviour in mice lacking both alpha-synuclein and gamma-synuclein[J]. Eur J Neurosci, 2008, 27(4): 947-957.
[14]Ehehalt R, Keller P, Haass C,et al. Amyloidogenic processing of the Alzheimer beta-amyloid precursor protein depends on lipid rafts[J]. J Cell Biol, 2003, 160(1): 113-123.
[15]Dutheil F, Beaune P, Loriot MA. Xenobiotic metabolizing enzymes in the central nervous system: Contribution of cytochrome P450 enzymes in normal and pathological human brain[J]. Biochimie, 2008, 90(3): 426-436.
[16]Zhu L, Jie X, Liu AT,et al. Response of NG2 positive cells and other glial cells in the microenvironment of facial nucleus after facial nerve axotomy[J]. Med J Chin PLA, 2017, 42(3): 196-201. [朱鴷, 结祥, 刘安堂, 等. 面神经离断伤后核团微环境中NG2阳性细胞及各类胶质细胞的反应[J]. 解放军医学杂志,2017, 42(3): 196-201.]
[17]Holmes C. Review: systemic inflammation and Alzheimer's disease[J]. Neuropath Appl Neuro, 2013, 39(1):51-68.
[18]Carter SF, Scholl M, Almkvist O,et al. Evidence for astrocytosis in prodromal Alzheimer disease provided by11C-deuterium-L-deprenyl: a multitracer PET paradigm combining 11C-Pittsburgh compound B and 18F-FDG[J]. J Nucl Med, 2012, 53(1): 37-46.
[19]Medeiros R, LaFerla FM. Astrocytes: conductors of the Alzheimer' disease neuroinflammatory symphony[J]. Exp Neurol, 2013, 239: 133-138.
[20]Liu JJ, Cao N, Di JL,et al. Role of bone marrow mesenchymal stem ceils in repair of neural cell injury induced by okadaic acid[J]. Med J Chin PLA, 2017, 42(5): 377-382. [刘嘉婧, 曹宁,翟晶磊, 等. 骨髓间充质干细胞对冈田酸致神经细胞损伤的修复作用[J]. 解放军医学杂志, 2017, 42(5): 377-382.]

