YAF2靶向cyclin D1表达促进肿瘤细胞增殖
侯丛丛,马晓骊,陈 虹,黄秉仁,陈 等
(中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系, 北京 100005)
癌严重威胁人类的健康。目前手术、放疗及化疗等治疗手段的疗效并不理想。因此寻找高效的药物靶点成为当前癌研究亟待解决的难题。YY1相关因子2(YY1 associated factor 2,YAF2)参与多梳蛋白复合物(polycomb group,PcG)的组成,该复合物在调控胚胎干细胞的增殖和分化、抑制发育相关基因表达等方面发挥重要作用[1-3]。此外,YAF2参与肿瘤的发生发展。原癌基因MycN在晚期神经母细胞瘤中高表达,而YAF2与MycN的E-box相互作用,促进MycN依赖的转录[4]。YAF2也与PDCD5相互作用,激活p53诱导的细胞增殖[5]。本实验室前期研究发现YAF2促进肿瘤细胞的增殖,但具体的分子机制尚不清楚。
细胞周期蛋白D1(cyclin D1)在多种肿瘤组织中存在基因扩增或表达水平增高,促进肿瘤细胞增殖、DNA损伤修复和侵袭转移等[6-9],是一个重要的原癌基因。本研究就YAF2是否调节cyclin D1的表达、可能的分子机制及生物学意义进行探究,进而对YAF2在肿瘤生物学中的功能有更深入的认识。
1 材料与方法
1.1 材料
1.1.1 细胞系:永生化人正常肝细胞系IHH(法国图卢兹癌症研究中心馈赠);人肝癌细胞系SK-Hep-1、Huh7及Hep-3B(中国科学院上海生命科学院细胞中心);人胚肾细胞系HEK 293T和结肠癌细胞系HCT116(中国医学科学院细胞中心)。
1.1.2 试剂:YAF2、GFP和β-actin抗体(Sigma公司);cyclin D1抗体(CST公司);人源YAF2/cyclin D1单基因siRNA套装(广州锐博公司);PrimeSTAR HS DNA聚合酶和qPCR试剂盒(宝生物工程有限公司);Lipo3000及Trizol(Invitrogen公司);GoScriptTMReverse Transcription System和双荧光素酶报告基因试剂盒(Promega公司);BCA蛋白定量试剂盒及ECL试剂盒(Thermo Scientific公司);引物由上海生工生物工程股份有限公司合成,测序由北京擎科新业生物技术有限公司完成。
1.2 方法
1.2.1 克隆cyclin D1启动子区:以HEK 293T细胞的基因组DNA为模板,PCR扩增cyclin D1启动子区(-2 303 bp~+75 bp),正向引物:5′-GGGGTACC CGGCTCTTTACGCTCGCTAA-3′,反向引物:5′-CCCA AGCTTGTCGTTGAGGAGGTTGGCAT-3′。用KpnⅠ和HindⅢ于37 ℃过夜酶切PCR扩增产物及pGL3-Basic载体,产物纯化后16 ℃连接3 h,转化,涂板,37 ℃倒置培养过夜。挑取单克隆进行菌落PCR和酶切鉴定,并送公司测序确认克隆序列的正确性。
1.2.2 细胞培养:细胞用含10%胎牛血清和双抗(100 U/mL青霉素和0.1 g/L的链霉素)的DMEM高糖培养基培养。细胞培养条件为37 ℃、5% CO2。
1.2.3 细胞转染:用Opti-MEM稀释质粒和Lipo3000,将质粒稀释液与转染试剂稀释液等体积混匀,室温放置5 min,逐滴加入至细胞培养液。
1.2.4 蛋白免疫印记:收集细胞,加入NP40裂解液于4 ℃裂解,离心取上清,进行蛋白质浓度定量。取30 μg蛋白进行SDS-PAGE凝胶电泳,转膜,脱脂奶粉封闭,一抗4 ℃孵育过夜。次日,二抗孵育,显影检测目的蛋白表达。
1.2.5 RT-qPCR:Trizol裂解细胞,按说明书操作提取总RNA,用微量分光光度计测定RNA浓度及纯度。用Promega公司试剂盒按说明书进行反转录和qPCR实验(引物序列见表1)。

表1 qPCR引物序列Table 1 qPCR primer sequence
1.2.6 双荧光素酶报告基因实验:将细胞种至24孔板,次日,转染细胞,24 h(过表达实验)或72 h(敲低实验)后裂解细胞,按照试剂盒说明书测定报告基因活性,以海肾荧光素酶荧光强度为标准化依据。
1.2.7 流式细胞仪分析细胞周期:转染细胞48 h后,收集细胞,弃上清,预冷的70%乙醇4 ℃固定过夜。用PBS洗涤细胞,加入适量0.1 g/L的碘化丙啶,避光染色30 min,流式细胞仪检测细胞周期。
1.2.8 克隆形成:选取对数增殖期的细胞,调整细胞至5×103/mL,接种于6孔板。次日,实验组中转染pFlag-YAF2及sicyclin D1,对照组转入pFlag或sicontrol。37 ℃、5% CO2培养两周后,结晶紫染色,统计集落数目。
1.3 统计学分析
2 结果
2.1 pGL3-cyclin D1报告基因载体构建
PCR扩增cyclin D1启动子区(-2 303 bp~+75 bp),目的片段约2 400 bp(图1A)。用KpnⅠ和HindⅢ双酶切PCR扩增产物及pGL3-Basic空载体,胶回收确定回收效果(图1B)。构建目的克隆,挑取单菌落扩增培养,提取质粒,双酶切鉴定,琼脂糖凝胶电泳在~4 700 bp及~2 400 bp处各有一条目的带,分别为pGL3-Basic和 cyclin D1启动子片段(图1C)。测序质粒,结果显示pGL3-cyclin D1克隆构建成功。
2.2 YAF2对cyclin D1蛋白质水平的影响
在Huh7(图2A)和Hep3B(图2B)细胞中过表达pEGFP-YAF2,内源性cyclin D1蛋白质水平明显升高;但在IHH(图2C)和SK-Hep-1细胞(图2D)敲低YAF2时,内源性cyclin D1蛋白质水平明显下降。
2.3 YAF2正向调节cyclin D1的mRNA水平
在IHH、SK-Hep-1和HCT116细胞中,用针对不同靶点的siYAF2-#1和siYAF2-#2敲低YAF2,提取总RNA,RT-qPCR检测YAF2和cyclin D1的mRNA水平。与对照组相比,IHH(图3A)、SK-Hep-1(图3B)和HCT116细胞(图3C)敲低YAF2后,cyclin D1的mRNA水平均明显下降(P<0.05)。
2.4 YAF2促进cyclin D1的启动子活性
转染pGL3-Basic的IHH细胞,与对照组相比,过表达pFlag-YAF2不能诱导cyclin D1的启动子活性,但在pGL3-cyclin D1转染的IHH细胞中,同时过表达pFlag-YAF2显著促进cyclin D1的启动子活性(P<0.05)(图4A);与过表达pFlag-YAF2的结果相反,在转染pGL3-cyclin D1的IHH细胞中同时敲低YAF2则显著下调cyclin D1启动子活性(P<0.05)(图4B)。
2.5 YAF2通过调节cyclin D1影响细胞周期分布
在HCT116细胞中,与对照组(图5A)相比,单独敲低YAF2(图5B)后G0/G1期细胞比例明显增加(约13%),S期比例明显减少(约8%)(表2);而与单独过表达cyclin D1(图5C)相比较,敲低YAF2同时过表达cyclin D1(图5D)后,G0/G1期(约增加9%)及S期(约减少5.5%)的变化幅度均减少(表2)。

A:agarose gel electrophoresis of PCR amplified product of human cyclin D1 promoter region, M.DNA marker, 1.PCR product;B:agarose gel electrophoresis of double restriction enzyme digested PCR and pGL3-Basic products,M.DNA marker, 1.PCR product digested withKpnⅠ andHindⅢ, 2.pGL3-Basic digested withKpnⅠ andHindⅢ; C:agarose gel electrophoresis of recombinant pGL3-cyclin D1 plasmid cut byKpnⅠ andHindⅢ,M.DNA marker, 1.recombinant plasmid digested withKpnⅠ andHindⅢ
图1pGL3-cyclinD1报告基因载体的构建与鉴定
Fig1ConstructionandidentificationofpGL3-cyclinD1clone
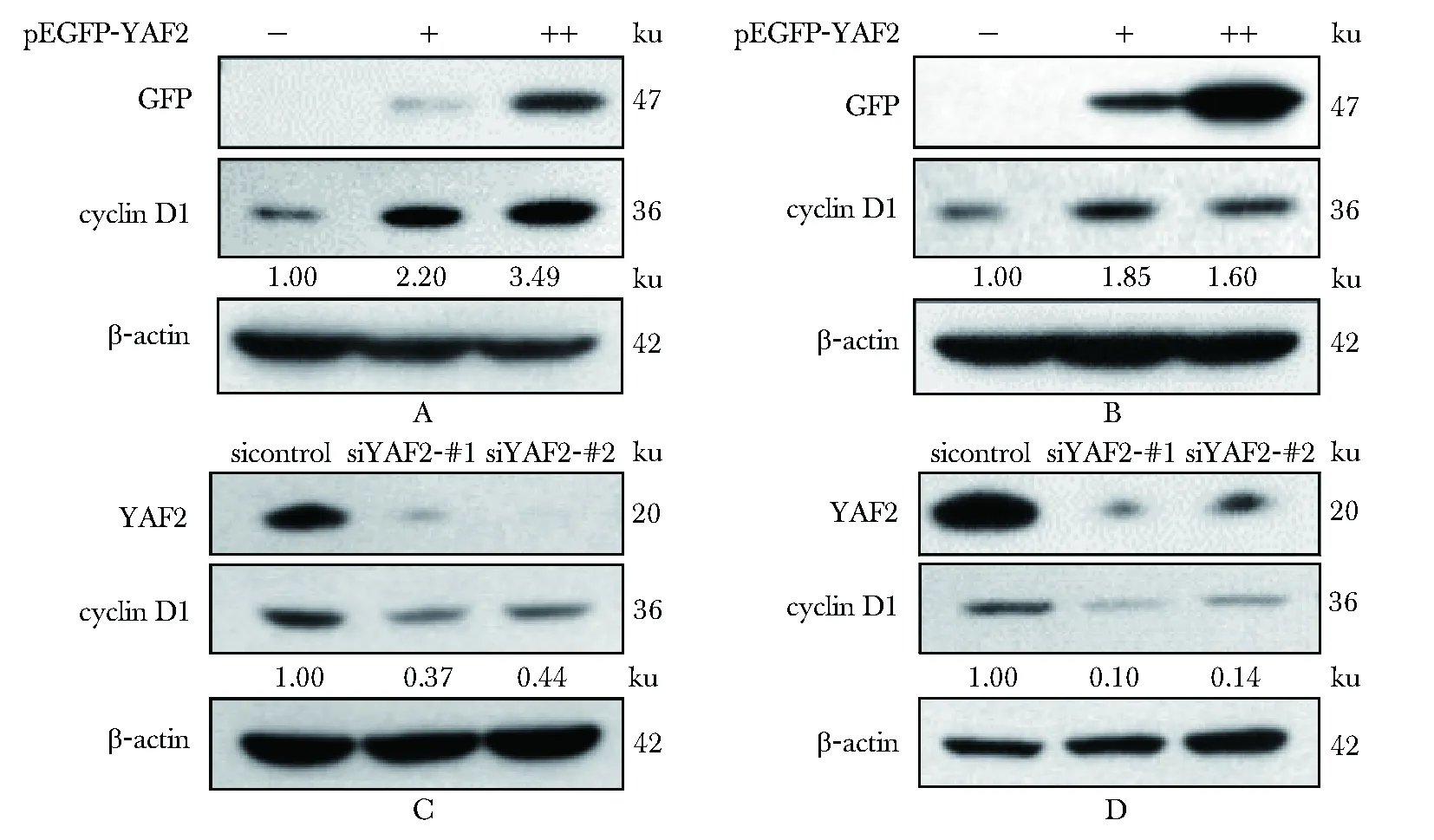
pGFP-YAF2 overexpression upregulated cyclin D1 protein level in Huh7 (A) and Hep3B (B); YAF2 silencing downregulated cyclin D1 protein level in IHH (C) and SK-Hep-1 (D)
图2YAF2上调cyclinD1蛋白水平
Fig2YAF2upregulatescyclinD1proteinlevel

YAF2 silencing downregulated cyclin D1 mRNA level in IHH (A), SK-Hep-1 (B) and HCT116 (C);*P<0.05 compared with sicontrol
图3YAF2正向调节cyclinD1mRNA水平

A.promoter activity of cyclin D1 after overexpression of pFlag-YAF2 in IHH cells;*P<0.05 compared with pFlag; B.promoter activity of cyclin D1 after YAF2 silencing in IHH cells;#P<0.05 compared with sicontrol

表2 不同YAF2和cyclin D1表达水平时细胞周期分布Table 2 Cell cycle distributions under different YAF2 and cyclin D1 expression n=3)
**P<0.01 compared with sicontrol/pFlag;#P<0.05 compared with sicontrol/pFlag-cyclin D1.
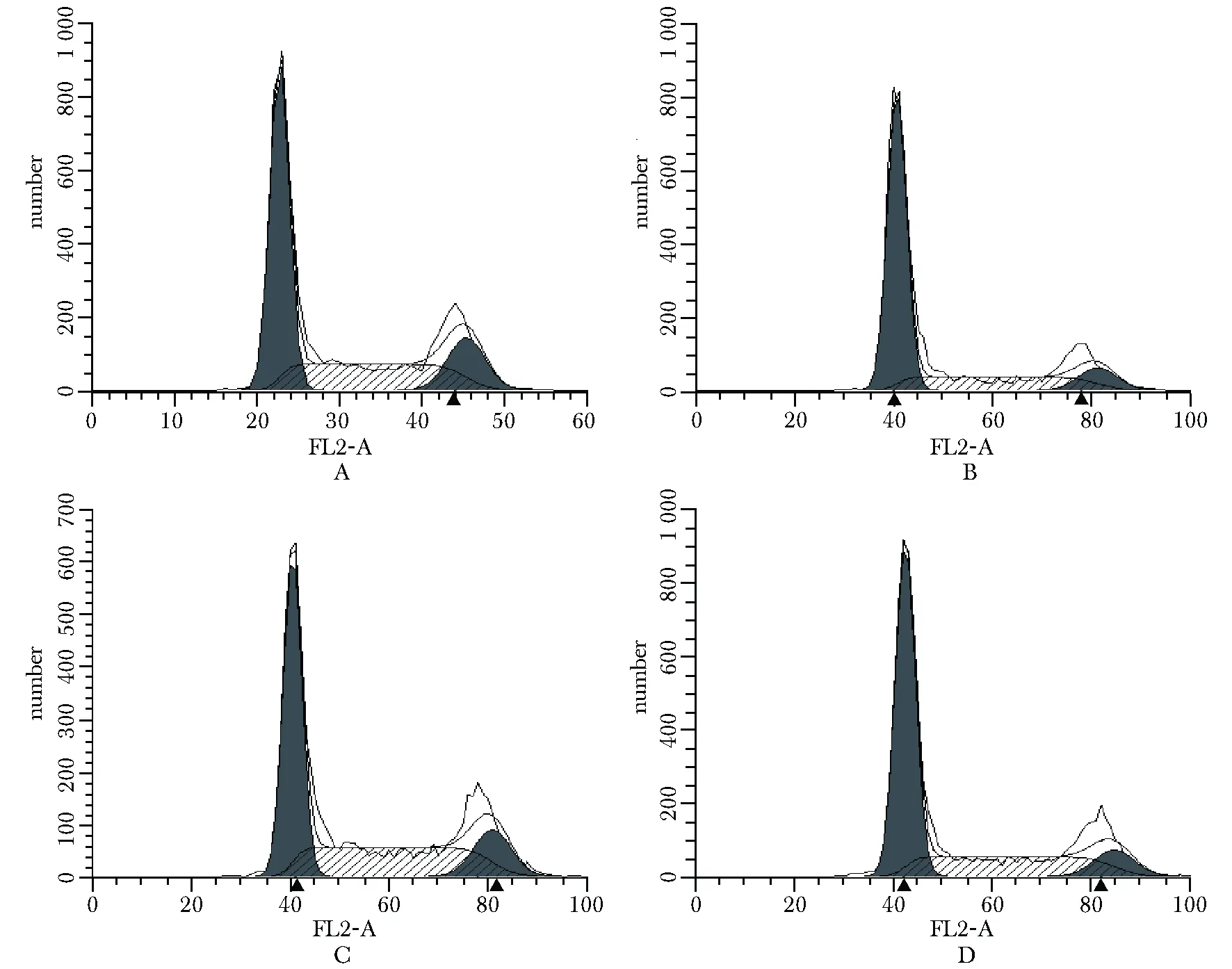
HCT116 cells were transfected with either sicontrol/pFlag (A), siYAF2-#1/pFlag (B), sicontrol/pFlag-cyclin D1 (C), or siYAF2-#1/pFlag-cyclin D1 (D), and cell cycle distributions in G0/G1and S phases were detected by flow cytometry assay
图5流式细胞计量术分析不同YAF2和cyclinD1表达水平对细胞周期分布的影响
Fig5CellcycledistributionsunderdifferentYAF2andcyclinD1expressionlevelsbyflowcytometryassay
2.6 YAF2过表达促进细胞增殖
与空对照(pFlag/sicontrol)相比,在HCT116细胞中单独过表达pFlag-YAF2后细胞克隆形成数目明显增加(P<0.05);与单独敲低cyclin D1相比,过表达pFlag-YAF2同时敲低cyclin D1(sicyclin D1)的细胞克隆形成数目增加不明显,无显著差异(图6A,B)。
3 讨论
细胞周期异常是肿瘤发生发展的一个重要标志性事件。Cyclin D1与周期素依赖的蛋白激酶CDK4/CDK6形成复合物, 磷酸化视网膜母细胞瘤蛋白(retinoblastoma protein,Rb),使其释放转录因子E2Fs,从而缩短细胞由G1期进入S期的时间,促进细胞增殖[10-11]。YAF2属于RYBP(ring1 and YY1 binding protein)蛋白质家族成员。研究发现,YAF2通过抑制caspase-8介导的细胞凋亡调节斑马鱼胚胎发育[12]。在晚期神经母细胞瘤中YAF2与MycN相互作用,促进MycN依赖的转录[4]。此外,YAF2通过稳定PDCD5激活p53功能,抑制结肠癌细胞增殖[5]。但截至目前,YAF2在肿瘤发生发展中的作用及机制仍然研究不多。

A, B.numbers of colony formation of HCT116 cells transfected with either pFlag/sicontrol, pFlag-YAF2/sicontrol, pFlag/sicyclin D1, or pFlag-YAF2/sicyclin D1;*P<0.05 compared with pFlag/sicontrol
图6克隆形成分析检测不同YAF2和cyclinD1表达水平对细胞增殖的影响

前期实验发现,YAF2在肝癌细胞系Huh7和Hep3B中的表达水平相对较低,在IHH和SK-Hep-1中的表达水平相对较高,因此本研究用Huh7和Hep3B进行过表达实验,在IHH和SK-Hep-1中进行敲低实验。总体来说,本研究过表达、敲低结合Western blot和报告基因的实验发现,YAF2结合cyclin D1的启动子区,在转录水平上调节cyclin D1的表达,这一结果与YAF2正性调节hGABP转录的研究相类似[13]。有研究发现,YAF2与转录因子YY1相互作用,募集PcG复合物至染色质[14],提示YAF2可能通过参与PcG复合物,调节cyclin D1的转录,但具体的分子机制仍需进一步的探究。功能性实验的结果表明,在HCT116细胞中,敲低YAF2促进cyclin D1依赖的细胞周期G0/G1期阻滞、降低S期细胞的数目,而YAF2过表达促进cyclin D1依赖的细胞克隆形成,提示在结肠癌细胞中YAF2可能具有原癌基因活性,这与YAF2抑制HCT116细胞中p53依赖的细胞增殖的结果不一致[5],因此,YAF2在结肠癌细胞中的功能仍需进一步的研究。
综上所述,本研究首次发现,肿瘤细胞中YAF2结合cyclin D1启动子,在转录水平上调cyclin D1的表达,加快肿瘤细胞由G1期进入S期,促进细胞增殖,提示至少在本研究的肝癌和结肠癌细胞中YAF2具有原癌基因功能,为将来靶向YAF2-cyclin D1的抗肿瘤新药研究奠定基础。
:
[1] Levine SS, Weiss A, Erdjument-Bromage H,etal. The core of the polycomb repressive complex is compositionally and functionally conserved in flies and humans[J]. Mol Cell Biol, 2002, 22: 6070-6078.
[2] Kerppola TK. Polycomb group complexes—many combinations, many functions[J]. Trends Cell Biol, 2009, 19: 692-704.
[3] Wilkinson F, Pratt H, Atchison ML. PcG recruitment by the YY1 REPO domain can be mediated by Yaf2[J]. J Cell Biochem, 2010, 109: 478-486.
[4] Bannasch D, Madge B, Schwab M. Functional interaction of Yaf2 with the central region of MycN[J]. Oncogene, 2001, 20: 5913-5919.
[5] Park SY, Choi HK, Jo SH,etal. YAF2 promotes TP53-mediated genotoxic stress response via stabilization of PDCD5[J]. Biochim Biophys Acta, 2015, 1853: 1060-1072.
[6] Yuan C, Zhu X, Han Y,etal. Elevated HOXA1 expression correlates with accelerated tumor cell proliferation and poor prognosis in gastric cancer partly via cyclin D1[J]. J Exp Clin Cancer Res, 2016, 35:1-16.
[7] Marampon F, Gravina GL, Ju X,etal. Cyclin D1 silencing suppresses tumorigenicity, impairs DNA double strand break repair and thus radiosensitizes androgen-independent prostate cancer cells to DNA damage[J]. Oncotarget, 2016, 7: 5383-5400.
[8] Noel EE, Yeste-Velasco M, Mao X,etal. The associa-tion of CCND1 overexpression and cisplatin resistance in testicular germ cell tumors and other cancers[J]. Am J Pathol, 2010, 176: 2607-2615.
[9] Yu Z, Wang L, Wang C,etal. Cyclin D1 induction of Dicer governs microRNA processing and expression in breast cancer[J]. Nat Commun, 2013, 4: 1-20.
[10] Kato J, Matsushime H, Hiebert SW,etal. Direct binding of cyclin D to the retinoblastoma gene product (pRb) and pRb phosphorylation by the cyclin D-dependent kinase CDK4[J]. Genes Dev, 1993, 7: 331-342.
[11] Arber N, Gammon MD, Hibshoosh H,etal. Overexpression of cyclin D1 occurs in both squamous carcinomas and adenocarcinomas of the esophagus and in adenocarcinomas of the stomach[J]. Hum Pathol, 1999, 30: 1087-1092.
[12] Stanton SE, McReynolds LJ, Evans T,etal. Yaf2 inhibits caspase 8-mediated apoptosis and regulates cell survival during zebrafish embryogenesis[J]. J Biol Chem, 2006, 281: 28782-28793.
[13] Sawa C, Yoshikawa T, Matsuda-Suzuki F,etal. YEAF1/RYBP and YAF-2 are functionally distinct members of a cofactor family for the YY1 and E4TF1/hGABP transcription factors[J]. J Biol Chem, 2002, 277: 22484-22490.
[14] Basu A, Wilkinson FH, Colavita K,etal. YY1 DNA binding and interaction with YAF2 is essential for Polycomb recruitment[J]. Nucleic Acids Res, 2014, 42: 2208-2223.

