羧胺三唑抑制佐剂性关节炎大鼠腹腔巨噬细胞产生细胞因子
朱 蕾,段梦园,张晓娟,李 娟,鞠 瑞,郭 磊,卢 珊,叶菜英
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系, 北京 100005)
类风湿关节炎(rheumatoid arthritis, RA)是一种以多关节进行性破坏为主要特征的慢性、系统性的自身免疫性疾病,目前尚无有效控制疾病发展的理想药物[1]。羧胺三唑(carboxyamidotriazole, CAI)是一种正处于临床研究中的非细胞毒性抗肿瘤药物,在体外和体内均有一定的抗肿瘤增殖和转移的作用[2- 3]。本课题组在深入研究CAI药理作用的过程中发现,CAI不仅具有抗癌作用,还具有较强的抗炎镇痛作用,能够显著抑制多种急、慢性炎性反应模型以及免疫炎性反应的病理过程。进一步研究发现,CAI对大鼠佐剂性关节炎(adjuvant arthritis, AA)具有明显的治疗作用,能够降低AA大鼠的关节炎指数并改善关节放射学和病理组织学损伤,提示CAI对RA可能有一定的治疗作用[4- 6]。本研究在此基础上,以AA大鼠腹腔巨噬细胞为靶细胞,研究CAI体外对AA大鼠腹腔巨噬细胞产生细胞因子的影响,以期对其治疗作用的部分机制进行探讨。
1 材料与方法
1.1 材料
1.1.1 动物:清洁级雄性Lewis大鼠,体质量180~210 g [北京维通利华实验动物技术有限公司,SCXK(京)2006- 0009]。
1.1.2 药品及试剂:CAI(中国医学科学院药物研究所合成),纯度(HPLC)达99%以上。卡介苗(北京生物制品研究所);DMEM高糖培养基(中国医学科学院基础医学研究所细胞资源中心);胎牛血清(Gibco公司); LPS脂多糖(lipopolysaccharide, LPS)和DMSO(Sigma公司);总RNA提取试剂盒(北京百泰克生物技术有限公司);反转录试剂盒(北京全式金生物技术有限公司);SYBR Green Ⅰ荧光PCR试剂盒(杭州博日科技有限公司);TNF-α、IL- 1β和IL- 6的mRNA引物(上海基康生物技术有限公司);TNF-α、IL- 1β和IL- 6 ELISA试剂盒(上海依科赛生物制品有限公司);核蛋白提取和TransAMTMNF-κB 活性检测试剂盒(Active Motif公司)。
1.2 方法
1.2.1 大鼠AA模型的建立[6]:将卡介苗于80 ℃、1 h灭活后,以高压灭菌的液体石蜡配成10 mg/mL的乳剂,充分研磨、混匀,即得弗氏完全佐剂(Freund’s complete adjuvant, FCA),于每鼠尾根部2~3点皮内注射0.1 mL FCA致炎。给对照组大鼠注射等体积的液体石蜡。
1.2.2 大鼠腹腔巨噬细胞的制备[7]:将大鼠颈椎脱臼处死,腹腔注射预冷的PBS液15 mL,轻揉腹部后剪开腹腔,吸出腹腔洗液,1 000 r/min离心5 min,PBS液洗1次,用含10%胎牛血清的DMEM培养液重悬细胞。以5×107个细胞/皿接种至10 cm培养皿中(用于核蛋白提取),以1×107个细胞/孔接种至6孔板中(用于总RNA提取),以1×106个细胞/孔接种至24孔板中(用于收集培养上清),在37 ℃、5% CO2培养箱培养2 h,弃去上清,并用PBS液洗2次以除去非黏附细胞,获单层巨噬细胞。依次作如下分组:正常组、AA组、AA+DMSO组、AA+CAI 10 μmol/L组、AA+CAI 20 μmol/L组、AA+CAI 40 μmol/L组。
1.2.3 上清中TNF-α、IL- 1β和IL- 6水平的检测:按上述分组进行给药处理,同时各组细胞加入LPS(终浓度4 mg/L)进行刺激,18 h后收集上清液,-20 ℃保存,采用ELISA法检测上清中TNF-α、IL- 1β和IL- 6含量,操作按照试剂盒说明书进行。
1.2.4TNF-α、IL- 1β和IL- 6的mRNA检测:按上述分组进行给药处理,同时各组细胞加入LPS(终浓度4 mg/L)对细胞进行刺激,培养6 h后弃去上清,按照总RNA提取试剂盒说明书提取总RNA,然后按照反转录试剂盒操作说明反转录合成cDNA,最后按照SYBR Green Ⅰ荧光PCR试剂盒操作说明,在Bio-Rad公司IQ5上测定TNF-α、IL-1β和IL-6的mRNA。所用引物序列为TNF-α上游引物:5′-CTGG GCAGCGTTTATTCT-3′,下游引物:5′-TTGCTTCTTCC CTGTTCC-3′);IL- 1β上游引物:5′-TGGACAGAAC ATAAGCCAACA-3′, 下游引物:5′-TAGATTCTTCC CCTTGAGGC-3′;IL-6上游引物: 5′-AGCCAGAGT CATTCAGAGCAA-3′, 下游引物:5′-GAAGTTGGGGT AGGAAGGACT-3′;β-actin上游引物:5′-CGAGTAC AACCTTCTTGCAGC-3′, 下游引物:5′-G CCCACGT AGGAGTCCTTC-3′。
1.2.4 核蛋白的提取和NF-κB的活性测定:按上述分组进行给药处理,1 h后加入LPS(终浓度4 mg/L)继续培养30 min,提取核蛋白并根据TransAM试剂盒说明书检测NF-κB的活性,方法简述如下:96孔板中固定NF-κB p65的保守结合位点(5′-GGGACTTCC-3′),加入核蛋白提取液,封板,室温孵育,洗涤;依次加入抗NF-κB p65抗体及HRP标记的二抗孵育,洗涤。 最后加入显色剂,室温避光孵育2~10 min 终止反应(由蓝色变为黄色),5 min内450 nm波长测其吸光度值。
1.3 统计学分析:
2 结果
2.1 CAI对AA大鼠腹腔巨噬细胞中TNF-α、IL- 1β和IL- 6分泌的影响
AA大鼠腹腔巨噬细胞培养上清中TNF-α、IL- 1β和IL- 6的水平显著高于正常组(P<0.01),CAI(20、40 μmol/L)可明显降低其TNF-α、IL- 1β和IL- 6的增高水平(P<0.01)(表1)。
2.2 CAI对AA大鼠腹腔巨噬细胞中TNF-α、IL- 1β和IL- 6的mRNA影响
AA大鼠腹腔巨噬细胞中TNF-α、IL- 1β和IL- 6的mRNA水平显著高于正常组(P<0.01);CAI(20、40 μmol/L)可明显降低其TNF-α、IL- 1β和IL- 6 mRNA的增高水平(P<0.05,P<0.01)(图1)。
2.3 CAI对AA大鼠腹腔巨噬细胞中NF-κB活性的影响
AA大鼠腹腔巨噬细胞中NF-κB p65的DNA结合活性显著高于正常组(P<0.01),CAI(20、40 μmol/L)对NF-κB p65活性的增强具有明显抑制作用(P<0.01)(图2)。
3 讨论
大鼠AA模型是一种免疫性炎性反应模型, 是筛选和研究治疗RA药物的常用模型[6]。巨噬细胞是调节炎性反应的重要效应细胞,在免疫系统受到自身抗体或特殊抗原刺激时,巨噬细胞活化产生大量的促炎细胞因子,如TNF-α、IL- 1β和IL- 6等,这些细胞因子相互作用,形成的细胞因子网络在RA的病理生理过程起着重要作用[8- 9]。其中以TNF-α和IL- 1β最为重要。它们相互作用,诱导产生更多细胞因子,放大炎性反应;增强内皮细胞黏附分子表达,协助炎性细胞迁徙至关节腔;促进滑膜成纤维细胞和软骨细胞生成基质金属蛋白酶和前列腺素,导致软骨基质降解; 促进破骨细胞的分化和成熟,引起骨质破坏等。另外, IL- 6也是引起RA滑膜炎性反应和骨质损伤的重要促炎细胞因子[10- 11]。本研究选用能反映全身炎性免疫状态的AA大鼠腹腔巨噬细胞作为研究对象,结果显示,浓度为20和40 μmol/L的CAI能够明显降低LPS刺激的 AA大鼠腹腔巨噬细胞中TNF-α、IL- 1β和IL- 6的mRNA水平,抑制TNF-α、IL- 1β和IL- 6的分泌,提示CAI的抗关节炎作用可能与其抑制细胞因子的产生有关。

表1 CAI对AA大鼠腹腔巨噬细胞中TNF-α、IL- 1β和IL- 6分泌的影响Table 1 Effects of CAI on the secretions of TNF-α, IL- 1β and IL- 6 in the peritoneal macrophages of
#P<0.01 compared with normal group;*P<0.01 compared with DMSO-treated AA group.
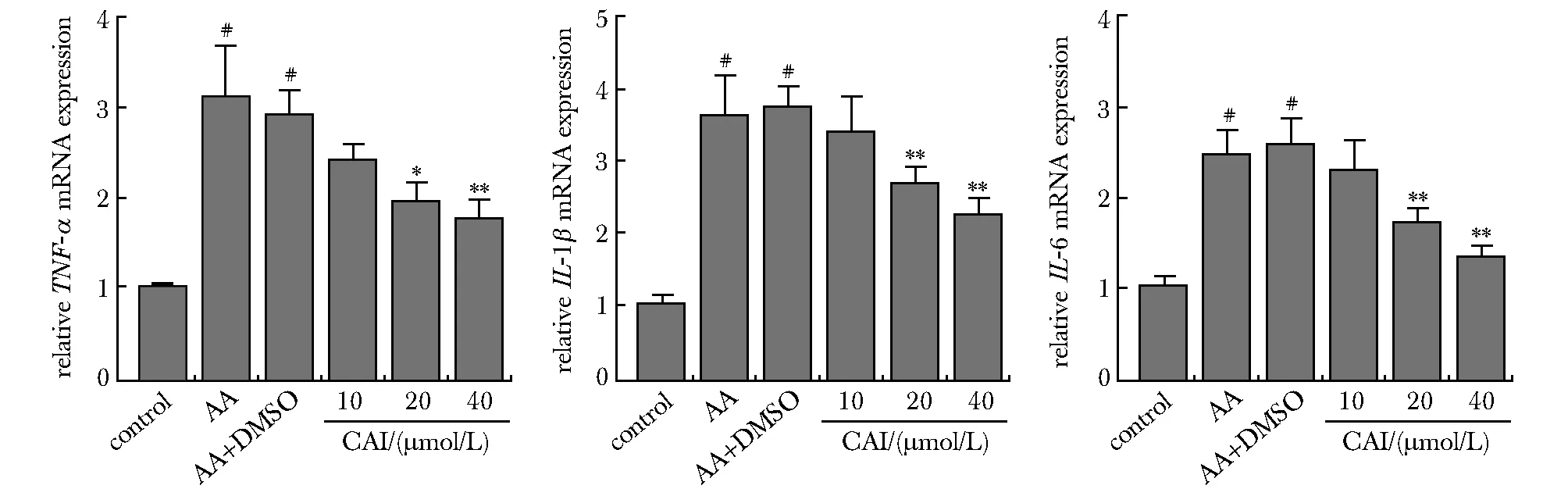
#P<0.01 compared with normal group; *P<0.05, **P<0.01 compared with DMSO-treated AA group图1 CAI对AA大鼠腹腔巨噬细胞中TNF-α、IL- 1β和IL- 6的 mRNA影响Fig 1 Effects of CAI on the mRNA expressions of TNF-α, IL- 1β and IL- 6 in the peritoneal macrophages of

#P<0.01 compared with normal group; *P<0.01 compared with DMSO-treated AA group
NF-κB信号级联途径是 LPS引起炎性反应的重要通路。NF-κB是重要的核内转录因子,主要以p50/p65异源二聚体形式存在。静息状态下,p50/p65与其抑制蛋白ΙκB结合,形成无活性的复合物而存在于细胞质中。受LPS刺激后,ΙκB被降解,释放出有活性的p50/p65二聚体,活化的二聚体进入细胞核,通过与相应的炎性因子靶基因启动子区的κB位点相结合而导致炎性因子基因的过度表达。因此,阻断NF-κB的活化有望缓解RA[12- 13]。本研究结果显示,CAI可明显降低AA大鼠腹腔巨噬细胞中NF-κB p65的DNA结合活性的增强,NF-κB的活性变化和下游细胞因子的产生水平一致。提示抑制NF-κB的活性可能是CAI降低细胞因子产生的重要作用靶点,但具体机制尚待进一步研究。
综上所述,巨噬细胞是CAI发挥作用的靶细胞之一,CAI可能通过下调巨噬细胞中NF-κB的活化,干预NF-κB信号通路的某些环节,从而减少TNF-α、IL- 1β和IL- 6等促炎细胞因子的产生。CAI的抗关节炎作用可能与上述机制有关。
:
[1] Scott DL, Wolfe F, Huizinga TW. Rheumatoid arthritis [J]. Lancet, 2010, 376: 1094- 1108.
[2] Moody TW, Chiles J, Moody E,etal. CAI inhibits the growth of small cell lung cancer cells [J]. Lung Cancer, 2003, 39: 279- 288.
[3] Wasilenko WJ, Palad AJ, Somers KD,etal. Effects of the calcium influx inhibitor carboxyamido-triazole on the proliferation and invasiveness of human prostate tumor cell lines [J]. Int J Cancer, 1996, 68: 259- 264.
[4] 朱蕾,李娟,武丹威,等. 羧胺三唑对角叉菜胶诱导急性炎症的抗炎作用 [J]. 中国临床药理学与治疗学,2013, 18: 601- 606.
[5] 朱蕾,李娟,郭磊,等. 羧胺三唑对大鼠佐剂性关节炎的治疗作用[J].中国医学科学院学报,2016, 38: 17- 22.
[6] Zhu L, Li J, Guo L,etal. Activation of NALP1 inflammasomes in rats with adjuvant arthritis; a novel therapeutic target of carboxyamidotriazole in a model of rheumatoid arthritis [J]. Br J Pharmacol, 2015, 172: 3446- 3459.
[7] 郑茹,郝晓健,郭磊,等. 羧胺三唑抑制大鼠腹腔巨噬细胞iNOS表达和NF-κB活化[J]. 基础医学与临床, 2010, 30: 466- 470.
[8] Davignon JL, Hayder M, Baron M,etal. Targeting monocytes/macrophages in the treatment of rheumatoid arthr-itis [J]. Rheumatology (Oxford), 2013, 52: 590- 598.
[9] Udalova IA, Mantovani A, Feldmann M. Macrophage heterogeneity in the context of rheumatoid arthritis [J]. Nat Rev Rheumatol, 2016, 12: 472- 485.
[10] Brzustewicz E, Bryl E.The role of cytokines in the pathogenesis of rheumatoid arthritis—Practical and potential application of cytokines as biomarkers and targets of personalized therapy [J]. Cytokine, 2015, 76: 527- 536.
[11] Siebert S, Tsoukas A, Robertson J,etal. Cytokines as therapeutic targets in rheumatoid arthritis and other inflammatory diseases [J]. Pharmacol Rev, 2015, 67: 280- 309.
[12] Baldwin AS Jr. The NF-kappa B and I kappa B proteins: new discoveries and insights [J]. Annu Rev Immunol, 1996, 14: 649- 683.
[13] Noort AR, Tak PP, Tas SW. Non-canonical NF-κB signaling in rheumatoid arthritis: Dr Jekyll and Mr Hyde? [J]. Arthritis Res Ther, 2015, 17:15.

