原核表达及一步法制备可溶性白喉毒素突变体CRM197
高宇辉,邓唯唯
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病原学系, 北京 100005)
CRM197(cross-reacting material 197)是白喉毒素(diphtheria toxin)的一种突变体,其第52位甘氨酸突变为谷氨酸,使得白喉毒素酶活性及毒性大大降低,但仍保留白喉毒素的免疫原性,利用这一特性,CRM197作为一种安全的载体广泛用于结合疫苗研究[1]。近年来,CRM197也应用于肿瘤治疗[2- 3]、结核病防治[4]和阿尔茨海默病[5]等多个领域的研究。由于对CRM197开发有着潜在的临床应用前景以及巨大商业价值,研究者尝试在白喉杆菌、沙门氏菌、枯草芽孢杆菌、荧光假单孢菌等系统中表达CRM197重组蛋白,但是这些表达系统存在着工艺复杂、技术难度高、重组蛋白得率低、人力及物力成本昂贵等不足,不适合推广应用。
大肠杆菌因其易于培养、操作技术成熟、重组蛋白得率高等优点,是目前应用最为广泛的异源蛋白表达系统。在大肠杆菌中以包涵体方式实现带有His标签的CRM197重组蛋白的过表达,通过蛋白质复性等过程得到了纯度较高的活性蛋白[6]。研究者也尝试将CRM197与Trx以融合表达的方式,在共表达的伴侣蛋白Tf(trigger factor)协助下成功在大肠杆菌胞质中表达出可溶性的融合蛋白TRX-CRM197,纯化后的重组蛋白使用肠激酶切掉TRX标签,才能得到游离的CRM197活性蛋白。
为避免在制备过程中从融合表达蛋白前体水解释放游离的CRM197蛋白而必须使用昂贵的商品化蛋白酶,以及避开蛋白复性技术等难度较高的复杂纯化过程,本研究尝试建立一种新颖的大肠杆菌表达体系,以简化获得可溶性CRM197重组蛋白的工艺,并降低制备成本。
1 材料与方法
1.1 材料
pET-32a(+)、大肠杆菌Origami B (DE3) 感受态细胞(Merck公司);限制性内切酶NdeⅠ、HindⅢ、BamHⅠ、BglⅡ及lambda DNA(NEB公司);引物合成和测序(Invitrogen公司);全基因合成(北京奥科鼎盛生物科技有限公司);IPTG、L-arabinose(生工生物工程有限公司);谷胱苷肽巯基转移酶(GST)-HRV3C蛋白酶融合蛋白表达质粒ppase(清华大学韩志富教授馈赠);CRM197 抗体sc- 80474(Santa Craz公司);GST-Tag抗体(华兴博创公司);Ni-NTA琼脂糖(Qiagen公司);咪唑(Sigma-Aldrich公司);HRP标记的山羊抗小鼠IgG、DAB试剂盒(中杉金桥生物技术有限公司);Pierce BCA Protein Assay Kit(Thermo公司)。
1.2 方法
1.2.1 CRM197序列优化合成与表达载体构建:按照GenBank数据公布的CRM197氨基酸序列(accession No. AMV91693.1),使用DNAWorks工具(https://hpcwebapps.cit.nih.gov/dnaworks/),参照大肠杆菌偏爱密码子表对CRM197编码序列进行优化,并在5′端和3′端分别加入BamHⅠ和HindⅢ酶切位点。利用同尾酶技术,将CRM197全长序列经BamHⅠ和HindⅢ酶切后连入pET-32a(+)质粒的BglⅡ/HindⅢ位点,构建pET32a-CRM197;人工合成含有HRV3C蛋白酶识别区(rs)的核酸片段5′-CTGGGTACCCTGGAAGTTCTGTTCCAGGGGCCCCAT CATCACCATCACCATAGGGATCCGCG-3′,经KpnⅠ/BamHⅠ酶切连入pET-32a(+)载体,然后使用BamHⅠ/HindⅢ酶切CRM197全长序列,连入相应位点构建pETrxn-CRM197;以ppase为模板,使用上游引物5′-CACCATATGTCCCCTATACTAGGTTATT G-3′和下游引物5′-CCCAAGCTTTCATTGTTTCTCT ACAAAATATTG-3′将GST- 3C表达框(1.26 kb)通过NdeⅠ/HindⅢ连入表达载体pGArasd的araBAD启动子下游的多克隆位点(pGArasd由本研究室构建,p15A origin,氯霉素抗性),构建HRV3C蛋白酶表达载体pGArasd-GST-3C。所有质粒经测序验证无误。各载体构建示意图(图1)。
1.2.2 诱导表达重组CRM197蛋白: 42 ℃热击转化法将不同的质粒组合导入Origami B (DE3)感受态细胞。共转化质粒分组: pET32a-CRM197+pGArasd-GST-3C、pETrxn-CRM197+pGArasd、pETrxn-CRM197+pGArasd-GST-3C。转化菌涂布于含有氨苄青霉素(50 μg/mL)、 氯霉素(20 μg/mL)、 卡那霉素(15 μg/mL)和四环素(12.5 μg/mL)的LB琼脂糖固体培养平板进行筛选。挑取单克隆菌落,接种到5 mL含4种抗生素LB液体培养基中,37 ℃摇动培养至OD600≈0.4时冷却至15 ℃,加入终浓度0.4 mmol/L IPTG和0.05 mg/mL L- 阿拉伯糖,15 ℃诱导6~48 h。

图1 原核表达载体构建示意图Fig 1 Schematic representation of the constructed prokaryotic expression vectors
1.2.3 重组蛋白电泳及Western blot检测:离心收集诱导前与诱导后菌体,加蛋白上样缓冲液煮沸10 min,取5 μL菌体总蛋白裂解液进行SDS-PAGE电泳,并使用AlphaEase® FC软件(Alpha Innotech公司)根据电泳条带灰度值(gray scale value)计算诱导蛋白占总蛋白比例。蛋白电泳后转印至硝酸纤维素膜上,以CRM197抗体(1∶2 000)或GST-Tag抗体(1∶1 000)为一抗,以HRP标记的山羊抗小鼠IgG(1∶10 000)为二抗孵育,采用DAB显色或化学发光(ECL)显影进行检测。
1.2.4 CRM197重组蛋白纯化:收集15 ℃培养24 h的诱导菌液200 mL,菌体沉淀重悬于20 mL裂解缓冲液(50 mmol/L Tris-HCl pH 8.0,500 mmol/L NaCl,0.1 mg/mL溶菌酶,1% Triton X- 100, 1 mmol/L PMSF),置于冰上超声破碎(350 W,超声10 s间隔15 s,共20次)。4 ℃ 12 000×g离心15 min,分别收集上清和沉淀,沉淀用等体积含有6 mol/L尿素的裂解缓冲液重悬,取样分析。超声上清液使用His亲和柱纯化,按Ni-NTA琼脂糖纯化手册操作,使用250 mmol/L咪唑溶液洗脱结合蛋白。洗脱的蛋白4 ℃透析过夜,经超滤浓缩后使用Pierce BCA Protein Assay Kit进行蛋白质定量分析。
1.2.5 CRM197重组蛋白核酸酶活性分析: 分别将总量1.820 μg(30.46 pmol)、0.910、0.455、0.227、0.114、0.057、0 μg纯化CRM197重组蛋白加入含有0.5 μg lambda DNA(16.72 pmol/L)的20 μL反应体系中(10 mmol/L Tris-HCl pH 7.6, 2.5 mmol/L CaCl2, 2.5 mmol/L MgCl2),37 ℃反应16 h,加入2 μL 50 mmol/L EDTA终止反应,琼脂糖凝胶电泳分析。
2 结果
2.1 大肠杆菌表达CRM179重组蛋白
诱导后,pETrxn-CRM197+pGArasd-GST-3C共转化菌样品均出现His-CRM197蛋白预测分子量59.8 ku大小一致的蛋白条带(图2),而pETrxn-CRM197+pGArasd共转化菌样品出现73.1 ku,pET32a-CRM197+pGArasd-GST-3C共转化菌出现74.7 ku大小的条带(图2),分别符合预测的未经切割TRX-rs-hisCRM197以及Trx-His-cs-Stag-CRM197完整融合蛋白分子的大小(图1)。
诱导6、12、24、36和48 h的pETrxn-CRM197+pGArasd-GST-3C共转化菌样品中,His-CRM197蛋白的表达量分别大肠杆菌总蛋白的9.7%、18.5%、22.3%、21.4%、17.6%(图2)。
2.2 Western blot分析目的蛋白表达
检测到符合GST-HRV3C 蛋白酶融合蛋白的大小(46.4 ku)特异条带(图3A);使用CRM197检测抗体可以明显识别诱导后出现的Trx-His-cs-Stag-CRM197蛋白(74.7 ku)、TRX-rs-hisCRM197(73.1 ku)和的His-CRM197蛋白(59.8 ku)(图3B)。
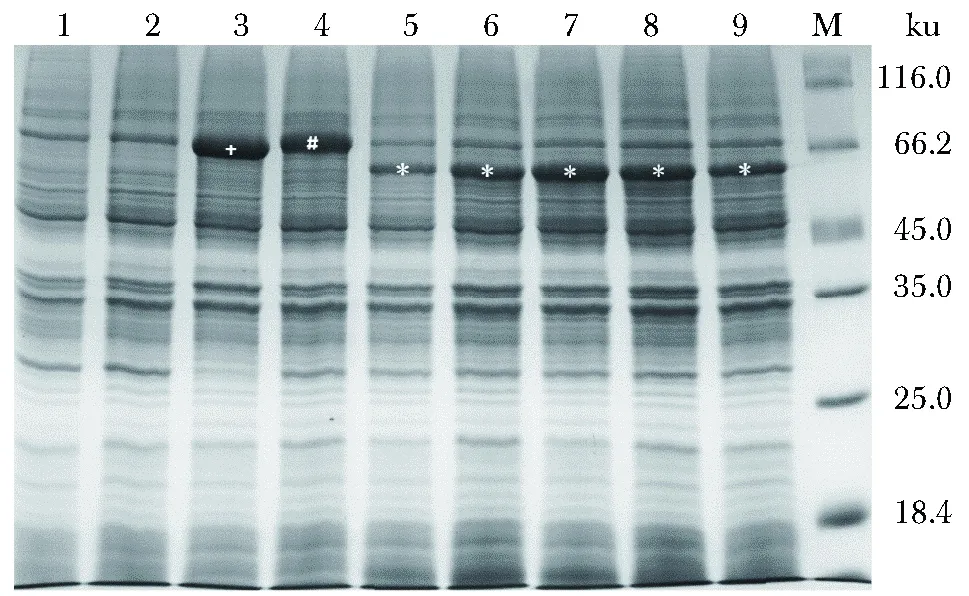
1.non-induced pET32a-CRM197+pGArasd-GST-3C co-transfected E. coli; 2.non-induced pETrxn-CRM197+pGArasd-GST-3C co-transfected E. coli; 3.induced pETrxn-CRM197+pGArasd co-transfected E. coli for 20 hours; 4.induced pET32a-CRM197+pGArasd-GST-3C co-transfected E. coli; 5~9.induced pETrxn-CRM197+pGArasd-GST-3C co-transfected E. coli for 6,12,24,36,48 hours respectively; M.protein marker; +.TRX-rs-hisCRM197; #Trx-His-cs-Stag-CRM197; *His-CRM197
2.3 His-CRM197重组蛋白纯化
电泳显示CRM197重组蛋白主要存在于细胞上清中。纯化产物经过SDS-PAGE及凝胶扫描灰度分析,纯度达到94.7%(图4)。

M.protein marker; 1.total E. coli protein after induced; 2.supernatant of induced E. coli; 3.insoluble fractions; 4.effluent fraction; 5~9.eluent fraction of tubes No. 1, 3, 6, 11 and 18; 10.final production after dialysis and ultrafiltration
根据BCA法对纯化蛋白的定量分析,本研究条件下可以获得(90.98±12.63)mg/L的His-CRM197纯化蛋白。
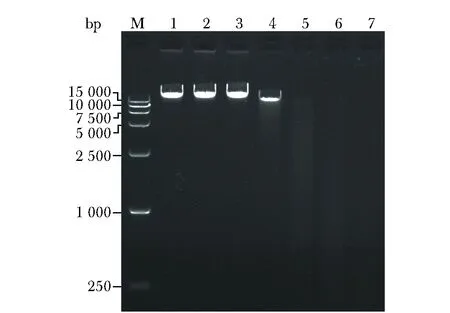
M.DNA marker DL 15 000; 1~7.concentration of His-CRM197 recombinant proteins incubated with lambda DNA are 0, 0.057, 0.114,0.227,0.455,0.910,1.820 μg respectively
2.4 核酸酶活性分析
反应体系中纯化His-CRM197蛋白含量为0.227 μg(3.80 pmol)时即可明显降解lambda DNA,当His-CRM197蛋白达到30.46 pmol可完全降解体系中浓度为16.72 pmol/L底物DNA(图5)。
3 讨论
CRM197序列中含有4个半胱氨酸,其折叠及活性有赖于这4个半胱氨酸形成正确的二硫键[7],CRM197在大肠杆菌胞质中如果无法形成正确的二硫键时,蛋白不能正确折叠而不可溶[6]。CRM197与Trx以融合蛋白形式构建的重组质粒转化Origami B (DE3)宿主菌,在37℃培养诱导,并在伴侣蛋白Tf的协助下,可以显著增加重组蛋白Trx-His-CRM197可溶性部分的表达量[8]。然而作者发现,在诱导温度降低至15℃时,共表达伴侣蛋白的作用并不明显,即在没有外源Tf蛋白的参与,15℃低温环境下诱导,上清中可溶性重组蛋白Trx-His-CRM197也可以达到相同的表达量[8],究其原因可能与以下因素有关: Trx蛋白作为融合表达标签,本身可以提供外源蛋白所需的还原环境,帮助重组蛋白折叠,阻止其在大肠杆菌胞质中聚集,从而提高与之融合的外源蛋白的可溶性;较低的诱导温度下,大肠杆菌代谢变得缓慢,使得外源蛋白有充分的时间进行折叠;在低温条件下,大肠杆菌为维持其生物活性,会自主增加胞内Tf的表达[9]。虽然采用Trx融合蛋白表达方式获得了CRM197融合蛋白可溶性表达,避免了纯化过程中蛋白质复性等繁琐耗时的操作,然而仍需要在体外使用昂贵的蛋白酶切去Trx标签以获得游离的可溶性His-CRM197[8],增加了纯化的成本。
用自动切割(autocleavage)技术,将HIV- 1蛋白酶编码序列、烟草花叶病毒(TEV)蛋白酶的识别位点和TEV蛋白酶编码序列串联排列,在大肠杆菌中以融合蛋白方式表达。当可溶性重组蛋白表达后,TEV蛋白酶即识别并切割其与HIV- 1蛋白酶之间的特异酶切位点,释放出游离的HIV- 1蛋白酶[10]。
本研究尝试采用类似的方法,以简化获得大肠杆菌表达可溶性CRM197重组蛋白的工艺。然而,具体到本研究,上述自动切割技术方案可能存在一些弊端。首先,用于自动切割的蛋白酶与目标蛋白融合,在大肠杆菌中表达外源蛋白过大,不利于折叠形成正确的构象,进而可能影响所融合的蛋白酶功能,降低识别酶切位点的能力及切割效率;其次,病毒来源的这类蛋白酶通常对大肠杆菌宿主有一定的毒性,难以获得高水平的活性可溶蛋白酶表达,与蛋白酶融合表达有可能会降低与之融合的蛋白表达水平。
本研究改进了自动切割技术设计,即将CRM197基因克隆于pET载体,而HRV3C蛋白酶编码序列则克隆在与pETrxn-CRM197具有相容性的pGArasd质粒上进行表达,二者采用不同的诱导物诱导,有效避免了蛋白酶与目标蛋白融合而可能对目标蛋白表达造成的影响;采用低浓度L-阿拉伯糖诱导,控制HRV3C蛋白酶在较低水平表达,降低对宿主的负担和毒性作用;使用Origami B (DE3)大肠杆菌作为宿主菌,因其存在硫氧还蛋白还原酶和谷胱甘肽还原酶双重缺陷(trxB-/gor-),有利于重组蛋白形成正确二硫键结构,表达可溶性的活性蛋白;15 ℃低温环境下诱导,有利于重组蛋白充分折叠。
实验结果表明本研究所采用的表达策略是有效的,在大肠杆菌胞内初始表达的TRX-rs-hisCRM197融合蛋白能被伴随表达的HRV3C蛋白酶有效切割,并释放出His-CRM197重组蛋白。
进一步对超声破碎后分离出的上清和沉淀中的蛋白进行分析,His-CRM197重组蛋白主要存在于上清中,说明在低温环境下温和诱导并在Trx的辅助和宿主菌还原环境下,初始以TRX-rs-hisCRM197融合蛋白形式表达的重组蛋白能够正确折叠,CRM197蛋白未受与之融合的Trx以及蛋白酶识别序列的影响,能够形成天然构象;且折叠后的重组蛋白能充分暴露出蛋白酶识别区域,进而被HRV3C蛋白酶特异性识别和切割。纯化的His-CRM197与lambda DNA共孵育实验表明,本研究所获得的His-CRM197具有脱氧核糖核酸酶活性[11],是具有生物活性的重组蛋白。
综上所述,本研究构建的新型CRM197大肠杆菌表达系统,后续纯化步骤操作简单,一步法即可得到纯度约95%的有活性的重组蛋白,避免了蛋白质复性或体外蛋白酶水解等复杂的纯化过程,简化了大肠杆菌表达可溶性CRM197重组蛋白的工艺,降低了制备成本。本研究为今后以CRM197为基础开展疫苗和肿瘤等疾病研究奠定了基础;同时本研究建立的大肠杆菌自动切割重组蛋白表达系统,也为其他在原核系统中难以可溶性表达的外源蛋白表达纯化研究提供了有益的参考。
:
[1] Findlow H, Borrow R. Interactions of conjugate vaccines and co-administered vaccines [J]. Hum Vaccin Immunother, 2016, 12: 226- 230.
[2] Yotsumoto F, Fukagawa S, Miyata K,etal. HB-EGF is a promising therapeutic target for lung cancer with secondary mutation of EGFRT790M[J]. Anticancer Res, 2017, 37: 3825- 3831.
[3] Miyamoto S, Yotsumoto F, Ueda T,etal. BK-UM in patients with recurrent ovarian cancer or peritoneal cancer: a first-in-human phase-I study [J]. BMC Cancer, 2017, 17: 89. doi:10.1186/s12885- 017- 3071- 5.
[4] Hu S, Yu W, Hu C,etal. Conjugation of the CRM197-inulin conjugate significantly increases the immunogenicity ofMycobacteriumtuberculosisCFP10-TB10.4 fusion protein [J]. Bioorg Med Chem, 2017, 25: 5968- 5974.
[5] Vingtdeux V, Zhao H, Chandakkar P,etal. A modification-specific peptide-based immunization approach using CRM197 carrier protein: Development of a selective vaccine against pyroglutamate Abeta peptides [J]. Mol Med, 2016, 22: 841- 849.
[6] Stefan A, Conti M, Rubboli D,etal. Overexpression and purification of the recombinant diphtheria toxin variant CRM197 inEscherichiacoli[J]. J Biotechnol, 2011, 156: 245- 252.
[7] Malito E, Bursulaya B, Chen C,etal. Structural basis for lack of toxicity of the diphtheria toxin mutant CRM197 [J]. Proc Natl Acad Sci U S A, 2012, 109: 5229- 5234.
[8] Mahamad P, Boonchird C, Panbangred W. High level accumulation of soluble diphtheria toxin mutant (CRM197) with co-expression of chaperones in recombinantEscher-ichiacoli[J]. Appl Microbiol Biotechnol, 2016, 100: 6319- 6330.
[9] Kandror O, Goldberg AL. Trigger factor is induced upon cold shock and enhances viability ofEscherichiacoliat low temperatures [J]. Proc Natl Acad Sci U S A, 1997, 94: 4978- 4981.
[10] Nguyen HL, Nguyen TT, Vu QT,etal. An efficient procedure for the expression and purification of HIV- 1 protease from inclusion bodies [J]. Protein Expr Purif, 2015, 116: 59- 65.
[11] Bruce C, Baldwin RL, Lessnick SL,etal. Diphtheria toxin and its ADP-ribosyltransferase-defective homologue CRM197 possess deoxyribonuclease activity [J]. Proc Natl Acad Sci U S A, 1990, 87: 2995- 2998.

