单纯C3沉积的感染后肾小球肾炎与C3肾小球肾炎比较
徐 峰 张明超 朱小东 谌达程 梁少姗 梁丹丹 曾彩虹 刘志红
C3肾小球肾病(C3G)是近年来重新分类的一种疾病,定义为肾组织主要是肾小球仅C3沉积或伴有免疫球蛋白和(或)C1q弱阳性沉积的一类肾脏疾病,包括C3肾小球肾炎(C3GN)和致密物沉积病(DDD)[1]。由于缺少补体经典途径和凝集素途径相关成分(如免疫球蛋白、C4、C1q等)的沉积,提示C3G与补体旁路途径的异常激活有关。部分C3G患者体内发现的针对补体旁路途径C3转化酶C3bBb和补体调节蛋白的抗体,以及补体相关基因突变的检出进一步证实了以上观点[2-3]。最初C3GN的组织表型包括膜增生性肾小球肾炎(MPGN)Ⅰ型和Ⅲ型中仅C3沉积的部分[4],随着C3G定义的提出,C3GN的组织学表型越来越丰富,除MPGN外,还包括肾小球弥漫增生性病变、肾小球毛细血管内增生性病变、肾小球系膜增生性病变、局灶节段性肾小球硬化、肾小球节段坏死性病变等[5]。
感染后肾小球肾炎(PIGN)是常见的肾小球肾炎之一,临床可表现为急性肾炎综合征,血尿、水肿、高血压及一过性肾功能减退,典型病理即毛细血管内增生性病变,上皮侧可见“驼峰”形成。与MPGN相似,其免疫表型也包括2类,一类为典型的PIGN,即肾小球免疫球蛋白IgG(或IgA)和C3沉积(Ig+C3-PIGN),另一类为肾小球单纯C3沉积(C3-PIGN)。C3-PIGN和C3GN具有相同的免疫病理特点,两者之间的鉴别诊断成为一个难点[1]。C3-PIGN具有哪些临床病理特点,C3-PIGN和C3GN在临床、病理和发病机制中有何不同,能否进行鉴别。本研究回顾性分析了C3-PIGN的临床、病理特点和肾脏预后,并与同期的C3GN进行比较。
材料与方法
研究对象2009年1月至2015年12月在南京总医院国家肾脏疾病临床医学研究中心行肾活检的患者,根据临床表现、实验室检查及肾穿刺病理诊断为PIGN 89例,C3GN 52例,排除冷球蛋白血症、系统性红斑狼疮(SLE)、乙型或丙型肝炎病毒感染、甲状腺相关疾病及恶性肿瘤等。石蜡荧光IgG染色排除IgG假阴性病例。
临床资料与相关定义记录患者性别、年龄、基线肾脏病病程、首发症状、肾外损害的症状体征及肾活检时实验室检查:24 h尿蛋白定量、镜下血尿、血红蛋白、血清肌酐(SCr)、血清白蛋白、球蛋白、抗链球菌溶血“O”(ASO)、补体 C3和C4。并且记录患者治疗、随访时间和肾脏生存情况等。
未成年人定义为年龄<18周岁。肾活检时肾脏病病程定义为从发现肾脏病至行肾活检的时间。成人高血压定义为静息状态下收缩压≥140 mmHg和(或)舒张压≥90 mmHg。未成年人正常血压的计算公式:收缩压=(年龄×2)+80 mmHg;舒张压=2/3收缩压。未成年人高血压定义为静息状态下收缩压(或)舒张压超过正常值20%以上。随访时间定义为从病理诊断至进入随访终点的时间,或至最近1次临床随访时间。镜下血尿为尿沉渣红细胞计数>10万/ml。蛋白尿定义为>0.4 g/24h。肾病综合征定义为尿蛋白>3.5 g/24h,血清白蛋白<30 g/L。肾功能不全定义为SCr>1.24 mg/dl。低补体血症:C3<0.8 g/L和(或)C4<0.1 g/L。ASO阳性定义为>116 IU/ml。随访终点:主要终点为终末期肾病(ESRD),定义为估算的肾小球滤过率(eGFR)<15 ml/(min·1.73m2)持续≥3个月或开始维持性血液透析;次要终点为SCr值较肾活检时出现倍增。eGFR的计算方法:成人采用CKD-EPI 公式,未成年人采用Schwartz 公式。
病理资料与相关定义所有病例均在B超引导下行肾活检术。活检组织经甲醛固定,行光镜、免疫荧光及电镜检查。光镜染色包括HE、PAS、PASM-Masson及 Masson三色染色。直接免疫荧光法检测肾组织中 IgG、IgA、IgM、C3、C1q和 Fibrin,观察免疫球蛋白和补体沉积的部位和强度。对10例C3-PIGN、9例C3GN行C3补体片段(C3b、C3c、C3dg、C3d和C3g)免疫荧光染色。电镜组织以 3.75%冷戊二醛固定,1%四氧化锇后固定,70~80 nm超薄切片,醋酸铀、柠檬酸铅霜染色,置 Hitachi 7500透射电子显微镜下观察。肾活检标本的病理评分均在PAS染色上进行。按照病理分型标准,肾小管萎缩与间质纤维化(IFTA):1分(IFTA病变范围<25%); 2分(IFTA病变范围25%~50%); 3分(IFTA病变范围> 50%)。新月体、袢坏死、血管硬化等,则按照有无该项病变进行区分。免疫荧光强度进行半定量分级:-、trace、1+、2+和3+。电镜下观察驼峰、系膜区、内皮下、基膜内及上皮侧非驼峰电子致密物,上皮侧非驼峰电子致密物为基底侧较宽、高度较小的电子致密物。
统计方法采用SPSS 22.0统计软件进行数据分析。正态分布数据以均值±标准差表示,组间比较使用t检验。非正态分布数据以中位数(范围)表示,组间比较采用Man-Whitney、Kruskal-Wallis检验。分类变量以率表示,组间比较采用Pearsonχ2检验或 Fisher精确检验。所有检验均为双侧检验,P< 0.05为差异有统计学意义。
结 果
一般情况本研究收集了89例PIGN(PIGN),其中43例(48.3%)单纯C3沉积(C3-PIGN),46例(51.7%)典型感染后肾小球肾炎(Ig+C3-PIGN)。C3-PIGN组与Ig+C3-PIGN组及C3GN组的临床和病理特点比较见表1、2。
PIGN的临床病理特点C3-PIGN患者男性25例,女性18例,年龄11~63岁,中位年龄25岁,肾脏病程4~300 d,中位病程20 d,39例(90.70%)C3-PIGN患者发病前存在前驱感染,37例(86.05%)ASO阳性,18例伴肉眼血尿,16例(37.21%)患者尿蛋白定量>1 g/d。而Ig+C3-PIGN患者中男性24例,女性22例,年龄10~73岁,中位年龄16岁,36例(78.26%)发病前存在前驱感染,17例伴肉眼血尿,34例(73.91%)尿蛋白定量>1 g/d。
C3-PIGN患者和Ig+C3-PIGN患者组织学表型均以肾小球毛细血管内增生性病变为主,其次为肾小球系膜增生性病变,个别病例表现为弥漫增生性病变;分别有7例和15例存在<50%的新月体,4例和13例患者存在轻度或中度的肾小管萎缩间质纤维化(IFTA)。超微结构观察C3-PIGN患者可见驼峰、系膜区、内皮下、基膜内及上皮侧非驼峰电子致密物的比例分别为100%、48.84%、18.6%、18.6%和2.33%,而Ig+C3-PIGN患者可见驼峰、系膜区、内皮下、基膜内及上皮侧非驼峰电子致密物的比例分别为91.3%、71.74%、52.17%、15.22%和4.35%。与Ig+C3-PIGN组比较,C3-PIGN组肾病范围的蛋白尿和低白蛋白血症的比例较低,病理方面,C3-PIGN组新月体和IFTA的比例及超微结构下系膜区和内皮下的电子致密物沉积的比例较低(P<0.05)。
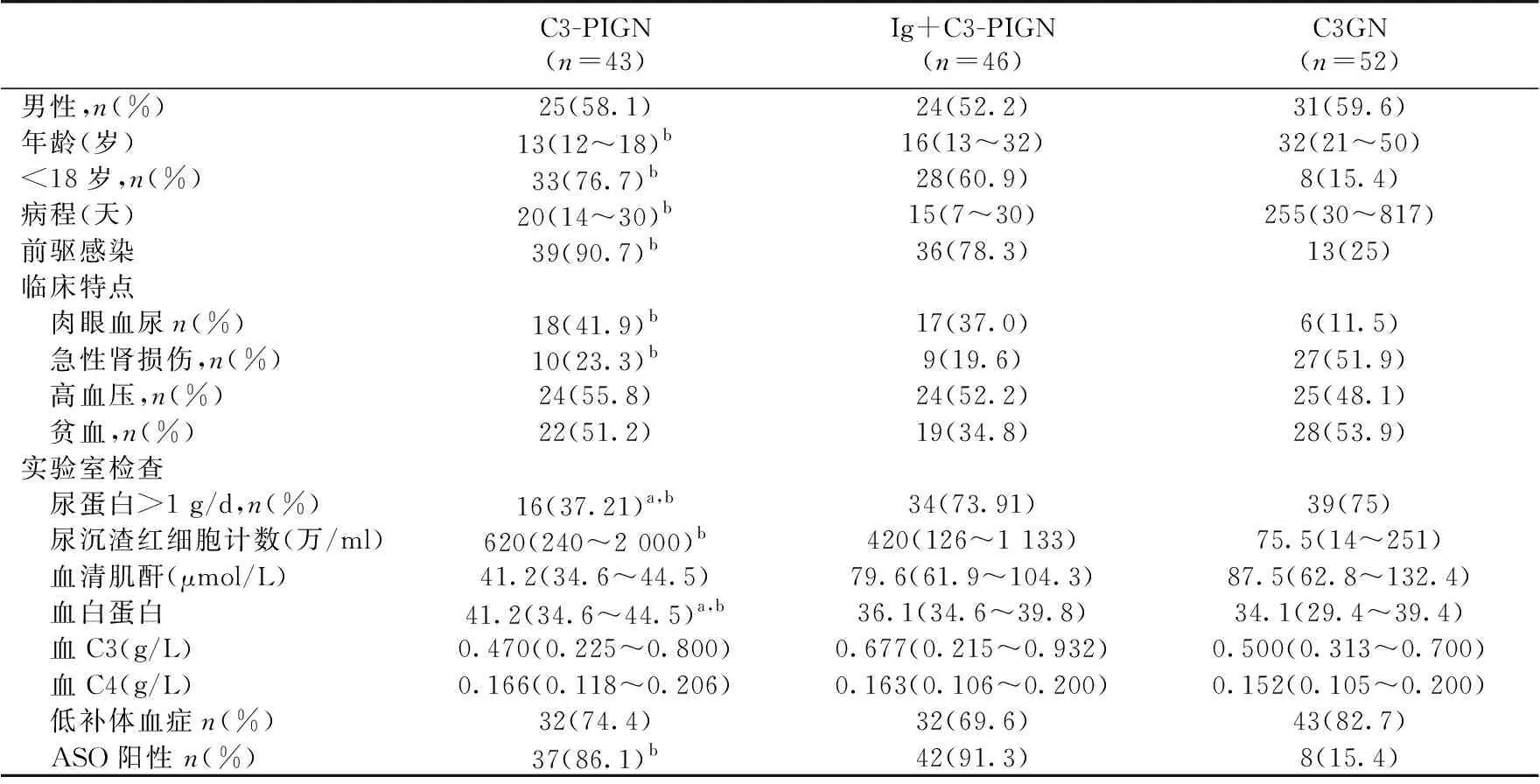
表1 三组患者临床特点
C3-PIGN:单纯C3沉积的感染后肾小球肾炎;Ig+C3-PIGN:免疫球蛋白合并C3沉积的感染后肾小球肾炎;C3GN:C3肾小球
肾炎;ASO:抗链球菌溶血素“O”;a:与Ig+C3-PIGN比较,P<0.05;b:与C3G比较,P<0.05
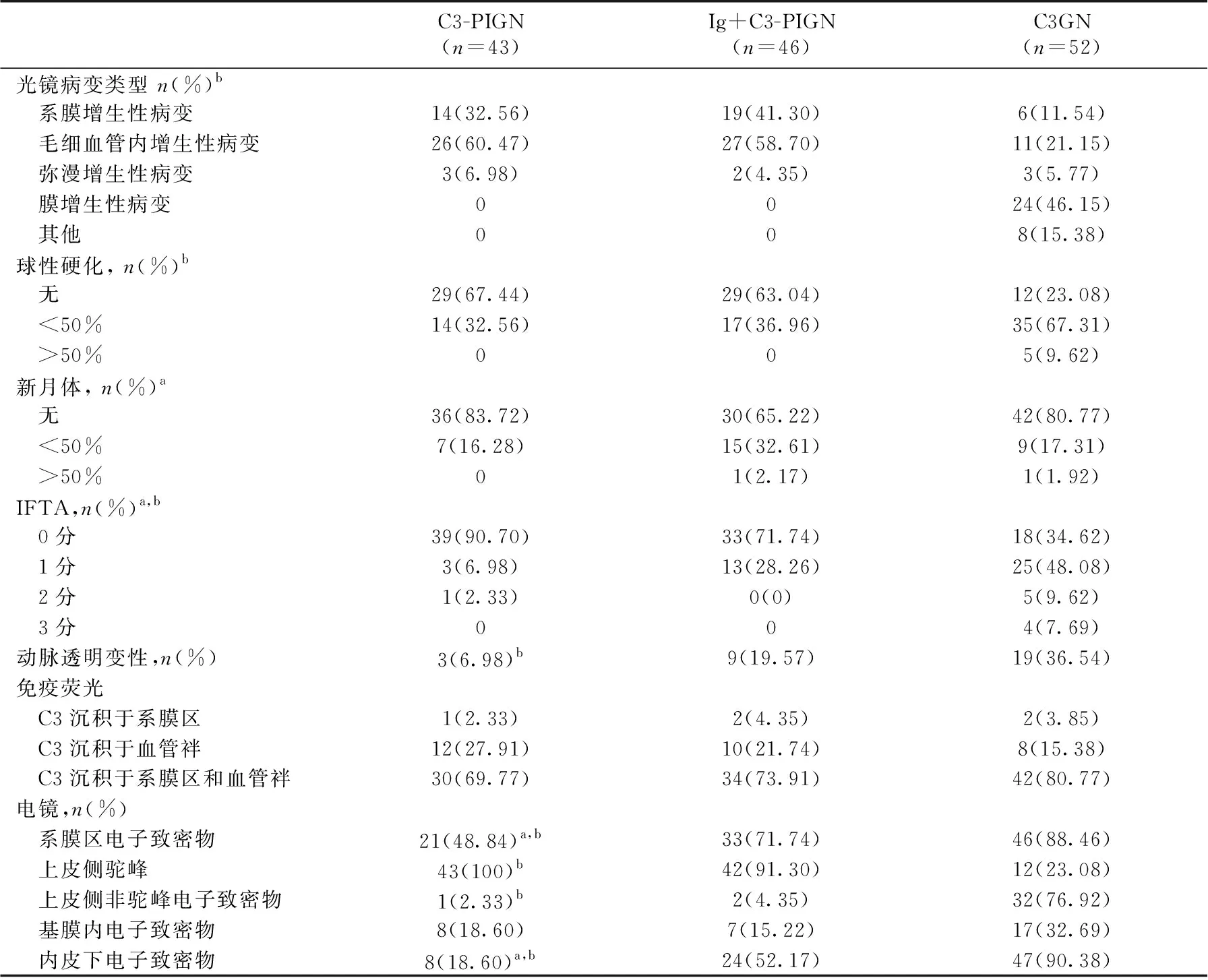
表2 三组患者的病理特点
C3-PIGN:单纯C3沉积的感染后肾小球肾炎;Ig+C3-PIGN:免疫球蛋白合并C3沉积的感染后肾小球肾炎;C3GN:C3肾小球
肾炎;a:C3-PIGN与Ig+C3-PIGN比较,P<0.05;b:C3-PIGN与C3G比较,P<0.05
C3-PIGN与C3GN的比较C3-PIGN和C3GN有着相同的免疫表型,我们对C3-PIGN和同期诊断为C3GN的患者进行了比较,临床方面,年龄、前驱感染比例、肾脏病程、尿红细胞计数、肾病范围蛋白尿、血白蛋白和ASO阳性率有统计学差异,相较于C3GN,C3-PIGN患者未成年人比例更高,前驱感染比例更高、病程更短,尿红细胞计数更多,肾病范围蛋白尿比例和低白蛋白血症发生率更低,而ASO阳性比例较高。C3GN患者中13例(25%)起病前存在感染,8例(15.38%)ASO阳性。病理方面,C3-PIGN患者以肾小球毛细血管内增生性和系膜增生性病变为主,C3GN患者以肾小球膜增生性病变为主(24例,46.15%),其次为肾小球系膜增生病变(12例,23.08%),还包括毛细血管内增生性病变(6例,11.54%)、结节样病变(4例,7.69%)和弥漫增生性病变(3例,5.77%)。球性硬化比例、IFTA评分、动脉透明变性比例和电子致密物分布有统计学差异,与C3GN比较,C3-PIGN患者总体病变较轻:球性硬化比例、肾小管萎缩间质纤维化的比例、动脉透明变性的比例更低,电镜下可见肾小球系膜区、内皮下和上皮侧非驼峰电子致密物沉积的比例更低,而驼峰的比例更高。
对C3-PIGN与C3GN肾小球补体C3片段免疫组化染色发现,肾小球内均为C3b、C3c和C3g阳性表达,且C3c和C3g强度明显强于C3b,而C3dg和C3d均为阴性(图1)。
C3-PIGN的预后和转归C3-PIGN患者给予了抗生素、激素和保肾药物治疗。中位随访时间11个月,总体预后良好,41例患者肾功能正常,仅1例患者进展至ESRD,1例患者CKD 3期。32例患者1年内尿检转阴,7例患者尿检持续阳性>1年,其中5例患者最终尿检转阴,2例患者分别随访了4年和2年,尿液检查持续阳性,其中1例患者进入ESRD(图2),符合C3GN的诊断。
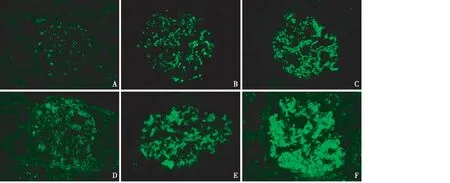
图1 A~C:单纯C3沉积的感染后肾小球肾炎患者免疫荧光染色C3b+(A)、C3c++(B)、C3g++(C),弥漫分布于肾小球系膜区和毛细血管袢(IF,×400);D~F:C3肾小球肾炎患者免疫荧光染色C3b+(A)、C3c++(B)、C3g+++(C),弥漫分布于肾小球系膜区和毛细血管袢(IF,×400)
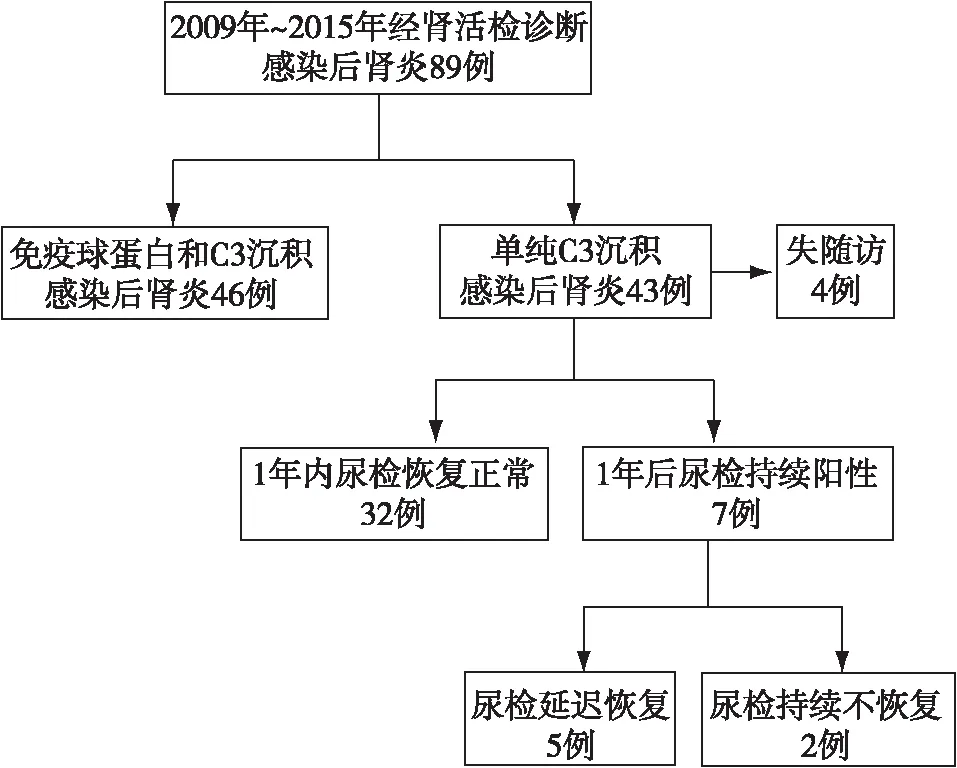
图2 单纯C3沉积的感染后肾小球肾炎患者尿检的长期随访情况
讨 论
C3GN的定义为肾小球单纯C3或C3为主伴有少量免疫球蛋白和C1q沉积,因此C3GN是主要依据免疫病理作出的诊断。C3GN的组织学表型多样,包括各种增生性和非增生性肾小球疾病。虽然在部分C3GN中发现了针对补体旁路途径C3转化酶的抗体(C3肾炎因子)或补体调节蛋白相关基因的突变,提示C3GN与补体旁路途径的异常有关[6],然而并不是所有病例都能检测出抗体或基因突变[7],目前在诊断C3GN时,主要还是依靠免疫病理。
C3沉积为主的肾小球肾炎不仅仅是C3GN,还包括C3-PIGN,两者之间的界限并不清楚,目前仍没有明确的鉴别方法[8]。通常认为PIGN具有自限性特点,预后良好,8周后补体C3恢复正常,1年内尿检转阴,然而有一部分PIGN患者尿检持续阳性或补体C3持续低下,在PIGN患者中也检测到C3肾炎因子或补体调节蛋白的基因突变[9],提示PIGN中也存在旁路途径活化的异常。PIGN甚至会转变为C3G[10-11]。因此有作者认为C3-PIGN和C3GN属于一个疾病谱[12],尿检持续阳性的不典型PIGN可能就是C3GN[9]。
我们回顾性总结了PIGN病例,发现近一半(48.3%)的患者表现为单纯C3沉积(C3-PIGN),与Ig+C3-PIGN比较,临床和病理表现更轻。原因可能是Ig+C3-PIGN除了激活旁路途径外,还激活了补体活化的经典途径,导致了更重的临床和病理表现,但是我们也发现Ig+C3-PIGN患者中仅3例出现了低C4血症,这在MPGN和C3GN的比较中也有类似的发现[7],MPGN中接近一半的病例C4水平正常,提示补体经典途径可能并未显著激活,或者可能只在肾脏局部激活。
对C3-PIGN和C3GN进行比较,发现感染不仅是PIGN的主要诱发因素,同时也是C3GN重要的诱发因素,有60%的感染是链球菌感染,而且C3GN的前驱感染比例仍有被低估的可能。临床和病理特点方面C3-PIGN与C3GN存在一些不同,C3-PIGN病程短,起病急,以大量血尿多见,肾病范围的蛋白尿比例不高,而C3GN患者病程长,肾病范围蛋白尿、低蛋白血症和AKI的比例更高。病理方面,C3-PIGN与C3GN均可表现为肾小球系膜增生性病变、毛细血管内增生性病变和弥漫增生性病变,C3GN还可以表现为肾小球膜增生性病变。C3-PIGN肾小球硬化、肾小管间质慢性病变及系膜区、内皮下和上皮侧非驼峰电子致密物沉积的比例更低。当然C3-PIGN与C3GN在临床表现和病理方面存在交叉区域,同时我们的样本量有限,并不能据此区分出C3-PIGN与C3GN。
C3-PIGN和C3GN的免疫病理均为C3肾小球沉积,两者C3沉积的性质和特点是否存在差别。通过对两组患者肾组织补体片段的免疫组化染色,发现C3-PIGN和C3GN患者肾小球内沉积的补体片段并没有差别。有研究分别对C3G病例的循环和组织中的补体片段进行了检测。Zhang等[14]在C3G患者血清中检测了一系列补体系统相关的生物标志物,与正常对照比较,C3GN和DDD患者血清中C3下降,而C3d升高。Sethi等[11]则使用质谱的方法对C3GN和DDD患者肾小球沉积物进行了分析,发现C3GN和DDD患者肾小球沉积物中的补体活化产物是一致的,均以C3dg为主,同时存在失活的C3b(即iC3b)。Sethi等[11]认为C3G患者C3b与肾小球毛细血管袢内皮细胞和基膜结合导致C3b在肾小球内的沉积,调节蛋白介导C3b失活产生iC3b,并进一步裂解产生C3dg,从而大量沉积于肾小球内。我们通过免疫组化的方法发现C3-PIGN和C3GN肾小球内存在少量的C3b沉积,更多的是iC3b的下游裂解产物C3c及C3dg的下游裂解片段C3g,肾小球内并未出现C3d的表达,结合Zhang等[14]发现的C3G患者血清中C3d水平升高,有可能C3dg裂解后的C3d没有沉积于肾小球,而是进入血液。C3GN虽然存在旁路途径的异常活化,但C3b的失活和进一步裂解并没有被完全阻断,包括C3b及其下游裂解产物C3c和C3g可在肾小球内沉积。C3-PIGN和C3GN的补体片段沉积均以C3b和C3g为主,而C3dg和C3d阴性。我们认为这两种C3沉积为主的肾小球疾病在肾小球局部的补体活化和裂解失活过程没有差别。这进一步提示C3-PIGN和C3GN属于同一个疾病谱。
分析C3-PIGN和C3GN的临床转归发现C3-PIGN中7例(16.28%)患者随访1年后仍有尿检阳性,其中5例患者在随后的观察中尿检逐渐恢复正常,而另外2例(4.65%)患者尿检持续不缓解,肾功能受损。我们认为这类患者存在补体旁路途径的异常,补体活化调节的平衡被打断,导致持续肾损伤,符合C3GN的诊断[9]。补体旁路途径调节正常的患者,肾脏损伤具有自限性,尿液检查可以逐渐转阴。而如果补体旁路途径调节异常,肾脏损伤持续存在,会出现持续的蛋白尿和血尿,部分会延迟恢复,而严重的患者则持续存在尿检异常。由于是回顾性研究,未能完成补体旁路途径相关抗体和基因的检测,我们今后将对这部分患者进一步完善检查。
总结:本研究回顾性分析了PIGN和C3GN的临床病理和随访资料,发现C3-PIGN的临床和病理改变较Ig+C3-PIGN和C3GN患者轻,但是C3-PIGN和C3GN肾小球沉积的补体C3片段没有差别,提示C3-PIGN和C3G存在相同的补体活化和裂解过程,可能为同一类疾病。对C3-PIGN患者要进行长期追踪随访,从而发现这些以感染为诱因,临床诊断为“C3-PIGN”的C3GN患者。
1 Pickering MC,D′Agati VD,Nester CM,et al.C3 glomerulopathy:consensus report.Kidney Int,2013,84(6):1079-1089.
2 Xiao X,Pickering MC,Smith RJ.C3 glomerulopathy:the genetic and clinical findings in dense deposit disease and C3 glomerulonephritis.Semin Thromb Hemost,2014,40(4):465-471.
3 Servais A,No⊇l LH,Roumenina LT,et al.Acquired and genetic complement abnormalities play a critical role in dense deposit disease and other C3 glomerulopathies.Kidney Int,2012,82(4):454-464.
4 Fakhouri F,Frémeaux-Bacchi V,No⊇l LH,et al.C3 glomerulopathy:a new classification.Nat Rev Nephrol,2010,6(8):494-499.
5 Sethi S,Fervenza FC,Zhang Y,et al.C3 glomerulonephritis:clinicopathological findings,complement abnormalities,glomerular proteomic profile,treatment,and follow-up.Kidney Int,2012,82(4):465-473.
6 Barbour TD,Ruseva MM,Pickering MC.Update on C3 glomerulopathy.Nephrol Dial Transplant,2016,31(5):717-725.
7 Iatropoulos P,Daina E,Curreri M,et al.Cluster Analysis Identifies Distinct Pathogenetic Patterns in C3 Glomerulopathies/Immune Complex-Mediated Membranoproliferative GN.J Am Soc Nephrol,2018,29(1):283-294.
8 Ito N,Ohashi R,Nagata M.C3 glomerulopathy and current dilemmas.Clin Exp Nephrol,2017,21(4):541-551.
9 Sethi S,Fervenza FC,Zhang Y,et al.Atypical postinfectious glomerulonephritis is associated with abnormalities in the alternative pathway of complement.Kidney Int,2013,83(2):293-299.
10 Sandhu G,Bansal A,Ranade A,et al.C3 glomerulopathy masquerading as acute postinfectious glomerulonephritis.Am J Kidney Dis,2012,60(6):1039-1043.
11 Prasto J,Kaplan BS,Russo P,et al.Streptococcal infection as possible trigger for dense deposit disease(C3 glomerulopathy).Eur J Pediatr,2014,173(6):767-772.
12 Al-Ghaithi B,Chanchlani R,Riedl M,et al.C3 Glomerulopathy and post-infectious glomerulonephritis define a disease spectrum.Pediatr Nephrol,2016,31(11):2079-2086.
13 Iatropoulos P,Noris M,Mele C,et al.Complement gene variants determine the risk of immunoglobulin-associated MPGN and C3 glomerulopathy and predict long-term renal outcome.Mol Immunol,2016,71:131-142.
14 Zhang Y,Nester CM,Martin B,et al.Defining the complement biomarker profile of C3 glomerulopathy.Clin J Am Soc Nephrol,2014,9(11):1876-1882.

