二氢硫辛酸琥珀酰转移酶在小鼠肾间质纤维化中的作用
张玉明 杨 振 刘利敏 段梦露 张 磊 孙世仁
我国慢性肾脏病患者约有1.2亿,其中成人患病率为10.8 %[1],慢性肾脏病已经成为危害公众健康的严重问题。肾间质纤维化(RIF)是各种慢性肾病进行性发展的共同途径,是形成终末期肾衰竭(ESRF)的主要病理学基础[2-4]。然而RIF的机制并不十分清楚,缺乏有效的治疗手段,阐明RIF机制成为该领域研究的热点。
研究表明,肾小管上皮细胞能量代谢障碍是形成肾脏纤维化的危险因素之一[5]。线粒体作为细胞内能量代谢的主要场所,近年来研究发现,线粒体功能缺陷与肾脏纤维化的发病有关[6-10];线粒体中α酮戊二酸脱氢酶复合体(α-KGDHC)是三羧酸循环氧化脱羧的限速酶,二氢硫辛酸琥珀酰转移酶(DLST)定位于线粒体,参与细胞的能量代谢,是α-KGDHC的重要组成部分[11]。本研究采用小鼠单侧输尿管梗阻(UUO)模型和HK2细胞缺氧模型,探讨DLST在肾脏纤维化中的作用。
材料与方法
材料8周龄雄性C57b/l小鼠,购自空军军医大学实验动物中心,自由摄食及饮水,在SPF级环境中饲养。兔抗人DLST多克隆抗体购自美国Sigma公司,兔抗人Ⅰ型胶原蛋白(Col-Ⅰ)多克隆抗体、兔抗人β-actin多克隆抗体和兔抗人α-SMA多克隆抗体购自北京博奥森,lipofectamine 2000转染试剂购自GIBCO公司,DLST高表达质粒和DLST shRNA购自上海吉凯公司。
方法
动物模型的建立及实验分组 实验动物随机分为两组:假手术组(Sham,n=15)和UUO模型组(n=45),UUO模型组又随机分为1周(n=15)、2周(n=15)和3周组(n=15)。小鼠腹腔注射戊巴比妥钠(40 mg/kg,30 g/L),麻醉后正中切口,逐层暴露肾脏,游离左侧输尿管,穿线结扎并剪断左侧输尿管,逐层缝合切口。Sham组只暴露肾脏,游离左侧输尿管,穿线但不结扎和剪断,其余操作与模型组相同。小鼠麻醉苏醒后正常饲养。
HE和Masson染色 分别于术后即刻、1周、2周和3周处死小鼠,取左侧肾脏,用生理盐水冲洗,放入4%甲醛溶液中固定48h,常规石蜡包埋,切片,行HE和Masson染色。
免疫组化检测DLST的表达 将固定好的肾组织脱水复蜡,包埋后切片;切片经脱蜡复水后,用3% H2O2去离子水孵育10 min,消除内源性过氧化物酶的活性;PBS浸泡5 min;10%山羊血清室温孵育30 min;滴加兔抗大鼠DLST一抗4℃过夜后,37℃再孵育2 h,PBS洗3遍;滴加羊抗兔IgG二抗,37℃孵育2 h,PBS洗3遍;滴加链霉素抗生物素蛋白-过氧化物酶溶液,37℃孵育30 min,PBS洗3遍;DAB显色,苏木素复染,中性树胶封片;普通光镜下观察。
Western Blot检测相关蛋白表达 取各组小鼠肾脏组织,提蛋白取上清,BCA法进行蛋白定量;各组取相同蛋白量经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后湿转法转移至PVDF膜上,用含5 %脱脂奶粉的TBST室温封闭2 h,然后用DLST、Col-Ⅰ、α-SMA(1∶ 1 000)和β-actin(1∶ 5 000)的一抗4℃过夜;TBST洗膜3次,用辣根过氧化物酶标记的二抗室温孵育2h,TNST洗膜3次;ECL显色,用Image J图像分析软件进行灰度值分析,以β-actin作为内参。
细胞培养 HK2细胞用含10%胎牛血清的F12培养基在恒温37℃,95% O2/5% CO2培养箱内培养,缺氧组HK2细胞先将培养基更换为不含10%胎牛血清的DMEM,然后将培养瓶置于含1% O2和5% CO2的培养箱中缺氧12 h,缺氧完成后更换培养基为10%胎牛血清的DMEM,并在95% O2/5% CO2培养箱内复氧4h。
细胞转染实验 严格按照上海吉凯公司高表达质粒和shRNA的步骤操作。按照Lipofectamine 2000转染试剂盒说明将DLST高表达质粒转染HK2细胞,培养48 h后,Western Blot检测Col-Ⅰ表达的变化;按照Lipofectamine 2000转染试剂盒说明转染Control siRNA和3种不同的DLST shRNA,培养48h后,Western Blot检测Col-Ⅰ表达的变化。
统计学分析采用SPSS 13.0进行统计学分析,数据均以均数±标准差表示,组间采用单因素方差分析比较,P<0.05为差异有统计学意义。
结 果
各组小鼠肾脏组织的病理变化小鼠肾脏HE染色结果显示,Sham组小鼠肾脏结构正常,肾小球、肾小管和肾间质结构清晰,无炎性细胞浸润;UUO组小鼠在1、2、3周时肾小管损伤明显,肾小管上皮细胞空泡变性、肿胀,肾间质有大量炎性细胞浸润,且随着模型时间的延长,损伤逐渐加重。Masson染色结果显示,Sham组小鼠肾间质没有明显的染蓝胶原纤维;UUO组小鼠在1、2、3周时肾间质可见大量蓝色胶原纤维,且随着模型时间的延长,纤维化程度逐渐增加(图1)。
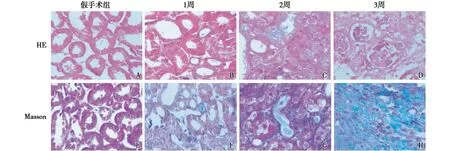
图1 单侧输尿管梗阻小鼠肾脏纤维化和损伤明显(A~D:HE,×400;E~H:Masson,×400)
各组小鼠肾脏DLST免疫组化的比较Sham组小鼠肾脏DLST免疫组化染色可见大量的棕黄色颗粒,且分布广泛,说明DLST在Sham组表达较多;而与Sham组相比,UUO模型组小鼠肾脏在1、2、3周时均可见DLST的表达显著减少,而且随着模型时间的延长表达量逐渐降低(图2)。
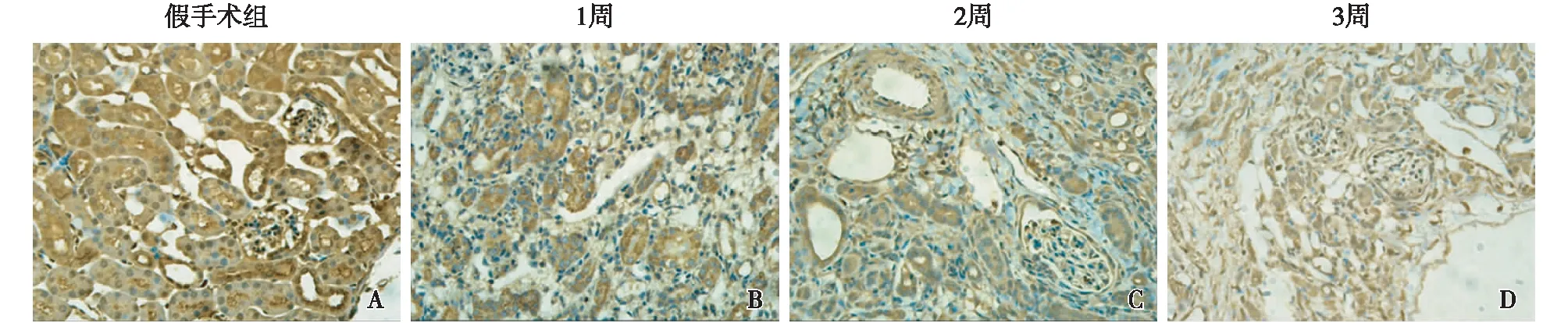
图2 单侧输尿管梗阻小鼠肾脏二氢硫辛酸琥珀酰转移酶表达逐渐减少(IH,×400)
各组小鼠肾脏DLST、Col-Ⅰ和α-SMA表达的变化Western-Blot结果检测DLST、Col-Ⅰ和α-SMA表达的变化,结果显示,与Sham组相比,UUO组DLST的表达随时间的延长而逐渐降低(P<0.05),而Col-Ⅰ和α-SMA的表达逐渐增加(P<0.05),表明纤维化程度随着UUO模型时间的延长逐渐加重(图3)。
HK2细胞高表达和干扰DLST后Col-Ⅰ和α-SMA表达的变化Western blot结果显示,在高表达DLST时,与空白对照组和转染空质粒组相比,缺氧条件下高表达DLST可明显增加其蛋白的表达水平,同时显著抑制纤维化相关蛋白Col-Ⅰ的表达;而在正常HK2细胞,与NC组相比,用3种不同DLST的shRNA沉默DLST,3种shRNA均能降低DLST的蛋白表达,其中shRNA2和3的沉默作用更明显,同时3种shRNA沉默DLST后,Col-Ⅰ的表达显著升高,其中shRNA2和3升高的更明显(图4)。
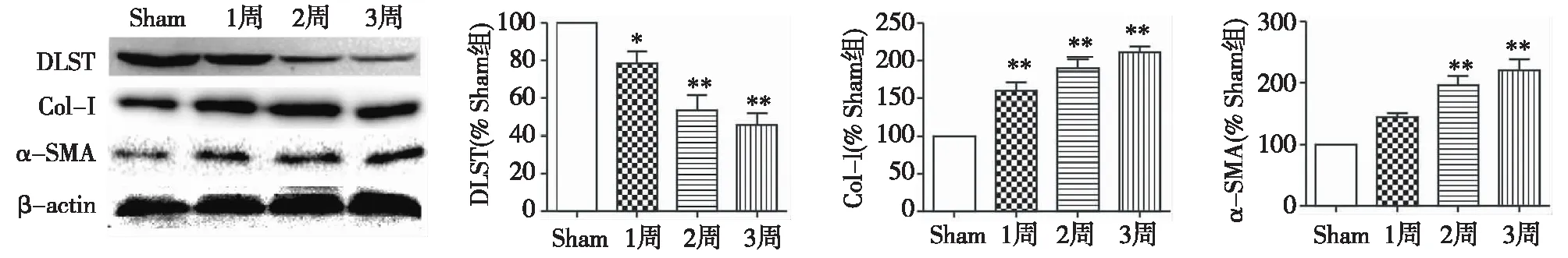
图3 单侧输尿管梗阻小鼠肾脏DLST表达降低而纤维化相关蛋白表达增加Sham:假手术组;DLST:二氢硫辛酸琥珀酰转移酶;Col-Ⅰ:Ⅰ型胶原蛋白;α-SMA:α平滑肌动蛋白;*:与Sham组比较,P<0.05; **:与Sham组比较,P<0.01
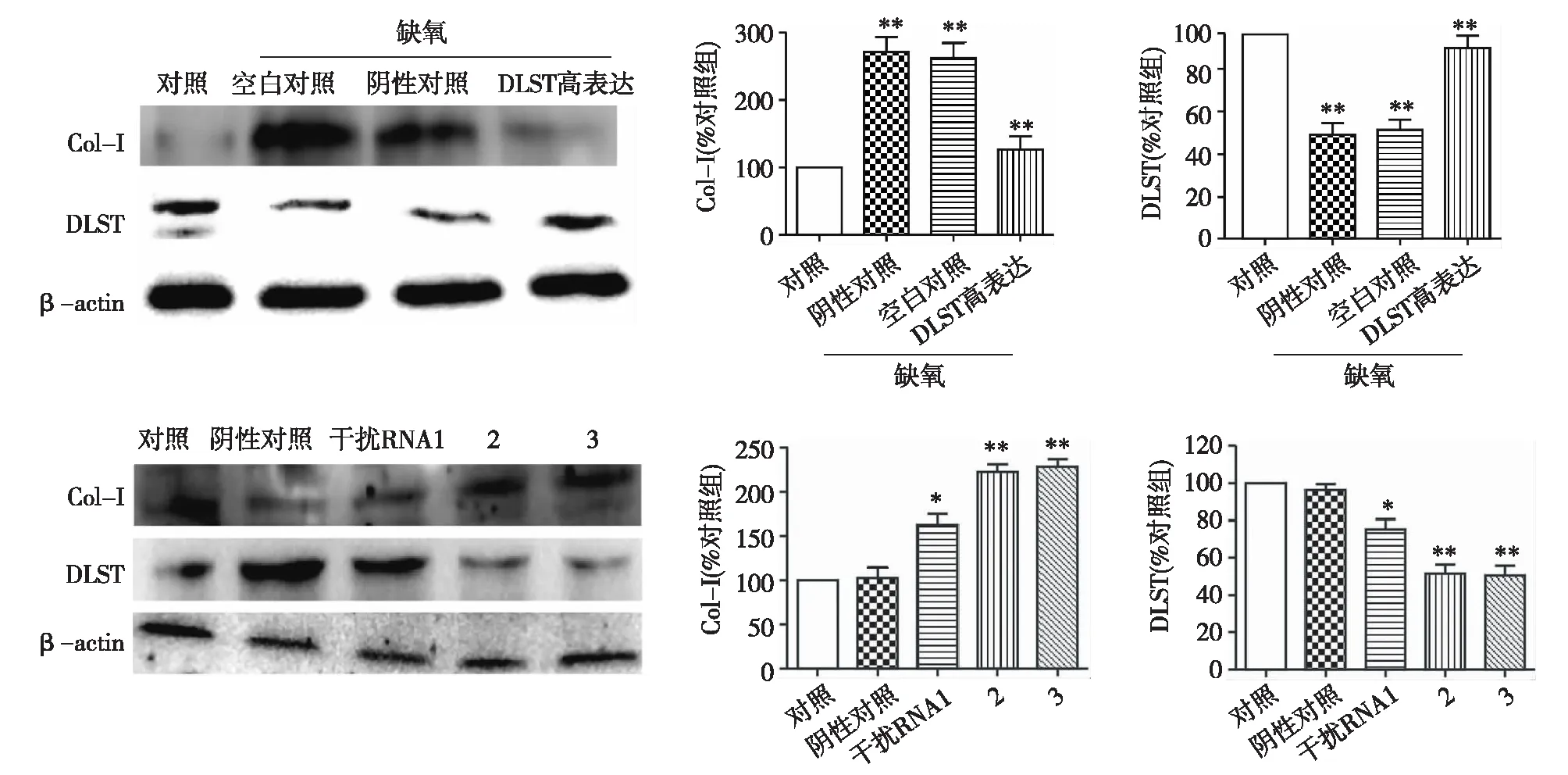
图4 HK2细胞缺氧时高表达DLST可减少Col-Ⅰ表达Col-Ⅰ:Ⅰ型胶原蛋白;DLST:二氢硫辛酸琥珀酰转移酶;与对照组比较*:P<0.05;**:P<0.01
讨 论
肾间质纤维化是由多种因素引起的细胞外基质成分在肾间质内过度聚集和肾间质成纤维细胞的过度增生形成的一种慢性病理性变化,是各种慢性肾脏病发展到终末期的共同结果[12-15]。然而肾间质纤维化的发病机制复杂,缺乏有效的临床治疗药物,因此,阐明肾间质纤维化的发病机制,探索有效的治疗方法,对于防治和治疗各种慢性肾病具有重要意义。
本研究发现,UUO模型组小鼠肾小管损伤明显,肾小管上皮细胞空泡变性、肿胀,肾间质有大量炎性细胞浸润,而且Masson染色显示纤维化增加明显,损伤和纤维化程度均随着模型时间的延长而加重;同时,我们又观察了纤维化相关蛋白的表达,结果发现,UUO模型组Col-Ⅰ和α-SMA的表达显著增加,这些结果提示UUO模型出现了明显的肾间质纤维化。
近年来发现,线粒体能量代谢障碍是导致肾脏损伤的一个重要因素,DLST是线粒体三羧酸循环氧化脱羧限速酶α-KGDHC的重要组成部分[16],其在肾脏损伤中的作用也越来越受到关注。免疫组化和Western-blot结果发现,UUO模型组DLST的表达显著减少。这些结果提示DLST可能与肾间质纤维化的形成有关。
为了进一步验证DLST在肾间质纤维化形成中的作用,我们采用HK2细胞缺氧模型模拟纤维化过程。结果显示,缺氧处理后高表达DLST可明显降低纤维化相关蛋白Col-Ⅰ的表达,而正常HK2细胞用shRNA干扰DLST后,可明显增加Col-Ⅰ蛋白的表达,这些结果证明DLST表达的变化可直接影响纤维化的进程。由于DLST是α酮戊二酸脱氢酶复合体的重要组成部分,参与三羧酸循环能量代谢的调控。缺氧时,三羧酸循环受阻可能是导致DLST表达降低的原因。
综上所述,本实验发现,UUO模型小鼠肾脏肾间质纤维化程度加重,同时伴有DLST蛋白表达的降低。而DLST表达的变化可直接影响纤维化的进程。这为临床上治疗肾间质纤维化提供了新的实验依据和策略。然而DLST表达改化参与肾间质纤维化的机制还不清楚,有待进一步的研究。
1 Liu ZH.Nephrology inChina.Nat Rev Nephrol,2013,9(9):523-528.
2 Kliem V,Johnson RJ,Alpers CE,et al.Mechanisms involved in the pathogenesis of tubulointerstitial fibrosis in 5/6-nephrectomized rats.Kidney Int,1996,49(3):666-678.
3 Lawson J,Elliott J,Wheeler-Jones C,et al.Renal fibrosis in feline chronic kidney disease:known mediators and mechanisms of injury.Vet J,2015,203(1):18-26.
4 Li X,Zhuang S.Recent advances in renal interstitial fibrosis and tubular atrophy after kidney transplantation.Fibrogenesis Tissue Repair,2014,7:15.
5 Yuan Y,Chen Y,Zhang P,et al.Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells.Free Radic Biol Med,2012,53(1):30-43.
6 Zhang S,Tan X,Chen Y,et al.Postconditioning protects renal fibrosis by attenuating oxidative stress-induced mitochondrial injury.Nephrol Dial Transplant,2017,32(10):1628-1636.
7 魏骐骄,刘晓雅.线粒体功能紊乱与肾脏损伤.肾脏病与透析肾移植杂志,2017,26(1):58-62.
8 杨茜.急性肾损伤进展为慢性肾脏病的机制.肾脏病与透析肾移植杂志,2016,25(3):274-278,252.
9 Coca SG,Singanamala S,Parikh CR.Chronic kidney disease after acute kidney injury:a systematic review and meta-analysis.Kidney Int,2012,81(5):442-448.
10 Gentle ME,Shi S,Daehn I,et al.Epithelial cell TGFβ signaling induces acute tubular injury and interstitial inflammation.J Am Soc Nephrol,2013,24(5):787-799.
11 Bruschi SA,Lindsay JG,Crabb JW.Mitochondrial stress protein recognition of inactivated dehydrogenases during mammalian cell death.Proc Natl Acad Sci U S A,1998,95(23):13413-13418.
12 Farris AB,Colvin RB.Renal interstitial fibrosis:mechanisms and evaluation.Curr Opin Nephrol Hypertens,2012,21(3):289-300.
13 Rodríguez-Iturbe B,García GG.The role of tubulointerstitial inflammation in the progression of chronic renal failure.Nephron Clin Pract,2010,116(2):c81-88.
14 Zhou TB,Qin YH,Lei FY,et al.Prohibitin attenuates oxidative stress and extracellular matrix accumulation in renal interstitial fibrosis disease.PLoS One,2013,8(10):e77187.
15 Gajjala PR,Fliser D,Speer T,et al.Emerging role of post-translational modifications in chronic kidney disease and cardiovascular disease.Nephrol Dial Transplant,2015,30(11):1814-1824.
16 Dumont M,Ho DJ,Calingasan NY,et al.Mitochondrial dihydrolipoyl succinyltransferase deficiency accelerates amyloid pathology and memory deficit in a transgenic mouse model of amyloid deposition.Free Radic Biol Med,2009,47(7):1019-1027.

