生长抑制和DNA损伤诱导基因45β在足细胞损伤中的作用及机制
张利文 施少林 侯 庆 汪 玲 张明超 任 强 谌达程 李 知 翟修文秦卫松 曾彩虹 陈朝红 刘志红
足细胞损伤是局灶节段性肾小球硬化(FSGS)等多种肾小球疾病发生发展的病理主因,足细胞凋亡和脱落导致足细胞数量减少和毛细血管塌陷[1],被认为是FSGS的发展的重要步骤。但足细胞凋亡和缺失的分子机制尚不明确。
生长抑制与DNA损伤基因45β(GADD45B)在DNA损伤和修复中发挥重要作用,参与细胞周期、凋亡和生存调节[2]。Shi等[3]发现,GADD45B在Dicer缺失小鼠肾小球足细胞特异表达。足细胞Dicer缺失导致足细胞凋亡和脱落,与小鼠蛋白尿和肾小球硬化进展有关。Zhang等[4]发现脂多糖可诱导GADD45B mRNA表达上调,在机体主要脏器组织中,肾和脾GADD45B mRNA表达量最高。Pippin等[5]研究发现,GADD45B蛋白表达水平在进展性Heymann肾炎大鼠肾小球和C5b-9处理培养的足细胞中增加。 但是,目前尚不清楚GADD45B表达升高是否在足细胞损伤中起直接作用。本研究观察GADD45B在肾小球表达,探索其表达改变对足细胞功能的影响。
材料与方法
病例选择随机选择南京总医院国家肾脏疾病临床医学研究中心经肾活检证实为FSGS的患者37例,入选标准:(1)蛋白尿>3.5 g/24h; (2)血清肌酐(SCr)<265.2 μmol/L;(3)排除有明确继发因素(感染、药物、代谢、肿瘤等),无肾病家族史。肾癌旁组织8例(我院泌尿外科肾癌切除患者)作为正常对照。本研究中的肾组织样本来源于国家肾脏疾病临床医学研究中心生物样本库,经本院伦理委员会审核通过。
临床病理指标的相关分析分别将24h尿蛋白、SCr、血清白蛋白(Alb)与FSGS肾小球GADD45B累积光密度进行pearson相关性分析。
肾小球组织处理和分离患者肾活检组织置于RNA保存液中(Ambion)在-70℃保存。将活检肾组织放入4℃ RNA保存液中,于显微镜下手持解剖镊分离肾小球。分离的肾小球进行RNA提取(Qiagen),cDNA合成(Invitrogen)及qRT-PCR(Qiagen)。GADD45B引物正义链:5′-CTGGTCACGAACCCTCACACGG-3′,反义链:5′-TTGCCCCGGCTTCTTCGCA-3′。 内参引物18S RNA正义链:5′-GATGGGCGGCGGAAAATAG-3,反义链: 5′-GCGTGGATTCTGGATAATGGT-3′。
免疫组织化学染色与分析将甲醛固定石蜡包埋切片(2 μm),经脱蜡,抗原修复和封闭后,与辣根过氧化物酶(HRP)或碱性磷酸酶(AP)标记兔抗人GADD45B抗体(1∶ 50) ,4℃过夜孵育。经DAKO EnVision系统孵育(Dako),DAB显色,苏木素复染; AP标记抗体以BCIP/NBT显色;光镜下观察。每张切片在400倍视野下随机选取5个非重叠完整肾小球,以Image-Pro Plus 6.0计算机图像分析系统对肾组织免疫组化结果进行半定量分析,计算每个肾小球累积光密度(integrated optical density,IOD)。
斑马鱼饲养和繁殖斑马鱼饲养于28.5℃水温环境中,照明14h与黑暗10h交替。斑马鱼胚胎于28.5℃培养箱中孵化,每日更换培养液。
转基因斑马鱼构建转基因鱼系Tg(pod:Gal4),Tg(UAS:GADD45Ba,cmlc2:gfp)和Tg(UAS:GADD45Bb,cmlc2:gfp)利用Tol2转座子和Tol2门克隆技术试剂盒(Kwan,Fujimoto et al.2007)构建。斑马GADD45Ba/bb cDNA 利用RT-PCR从斑马鱼胚胎扩增所得,扩增产物克隆到pME-MCS并进行测序验证。所用引物如下GADD45Ba 正义链:5′-TTGGTACCATGACCCTGGAAGAAGTCGTTG-3′,反义链: 5′-AGAATTCTCAGCGTTCTTGCAGGGACAG-3′; gadd45bb 正义链:5′-TTGGTACCATGACTCTGGAGGAAGTTGTTG-3′,反义链: 5′-AGAATTCTCAGCGCTCTTGCAGG-3′。 中间克隆,p5E-UAS 和 p3E-cmlc2:EGFP-pA用LR酶根据厂商操作步骤组合而成(Life Technology)。表达载体与Tol2转座酶RNA,共同注入单细胞期野生型(AB)斑马鱼胚胎。为鉴定Tg(UAS:GADD45Ba:cmlc-gfp) 和 (UAS:gadd45bb:cmlc-gfp)转基因鱼,将转基因鱼与AB斑马鱼交配,F1胚胎(72 hpf)置于荧光显微镜下观察。将心脏有绿色荧光的配体喂养至成年。Tg(pod:GAL4) F1斑马鱼和Tg(UAS:NTR-mcherry)斑马鱼交配产卵,将肾脏有mcherry红色荧光的斑马鱼养至成年即获得双转基因斑马鱼Tg(pod:GAL4;UAS:NTR-mcherry)。Tg(UAS:NTR-mcherry) 来自国际斑马鱼资源库(ZIRC)。
反义寡核苷酸(Morpholino,MO)实验Splice MO是一种反义吗啉寡核苷酸,可以干扰mRNA正常剪切,从而降低该基因的表达。在剪切的两端设计引物,通过RT-PCR分别行产物电泳和条带切胶回收基因测序。如有序列的缺失或者插入,PCR产物凝胶电泳会出现双条带。GADD45Ba/bb的MO购自GENE TOOLS公司。序列如下GADD45Ba (Exon 3 )5′-TGTATGTGTCTACTTACAGTGACGA-′3.GADD45Bb (Exon 3) 5′-ATCCCTGAAGAAGTTGACAAACGCA-′3,对照MO:5′-CCTCTTACCTCAGTTACAATTTATA-′3。斑马鱼单细胞期胚胎进行注射0.6 mmol/L GADD45Ba MO或1.5 mmol/L GADD45Bb MO。所使用的鉴定引物为gadd45 ba正义链: 5′-TTGGTACCATGACCCTGGAAGAAGTCGTTG-3′,反义链:5′-AGAATTCTCAGCGTTCTTGCAGGGACAG-3′。GADD45Bb正义链:5′ TTGGTACCATGACTCTGGAGGAAGTTGTTG-3′,反义链: 5′- AGAATTCTCAGCGCTCTTGCAGG -3′。
诱导斑马鱼足细胞损伤Tg(pod:GAL4;UAS:NTR-mcherry) 斑马鱼足细胞过表达硝基还原酶(NTR),可将甲硝唑(MTZ)转化为毒性物质,从而诱导足细胞的损伤[6]。MTZ作用于72 hpf斑马鱼胚胎48h, 0.1% DMSO作为溶剂对照。
原位杂交胚胎用含4%多聚甲醛(PFA)磷酸盐缓冲液(PBS)固定,用地高辛标记的GADD45B RNA探针在70°杂交,然后用连接碱性磷酸酶标记的底物抗地高辛抗体孵化,硝基四氮唑蓝(NBT)显色。
凋亡检测抗caspase-3蛋白抗体(BD Biosciences)1∶ 500稀释,抗Cy3标记二抗(Invitrogen)抗体1∶ 2 000稀释,共聚焦激光扫描显微镜观察拍摄( SP53,Leica)。
蛋白尿检测Tg(pod:NTRmCherry;l-fabp:VDBP-GFP)与Tg(UAS:GADD45Ba/bb)交配产卵,将20枚3 dpf胚胎放入12孔板中, MTZ处理12h,取100 μl培养液,ELISA定量检测幼鱼中培养基中绿色荧光蛋白(GFP)(Cell Biolabs,San Diego,CA)。
统计学处理使用SPSS 软件(version 11.5)进行统计学分析。所有数据用正态分布的计量资料用均数±标准差表示,组间比较用单因素方差分析,采用LSD检验进行组间比较。P<0.05为差异有统计学意义。
结 果
GADD45B在FSGS患者肾小球中表达上调qRT-PCR显示,FSGS患者肾小球GADD45 mRNA表达显著高于正常组(图1A)。免疫组化染色显示,GADD45B信号在正常肾组织肾小球很弱,在FSGS患者肾小球,GADD45B表达显著增加(图1C),FSGS组IOD为3 807.20±2 069.80;正常对照组:979.08±202.82(图1B)。

图1 GADD45B在FSGS患者肾小球中表达上调A:分离人肾小球RNA的实时荧光定量qPCR结果;B:免疫组化染色半定量分析结果;C:免疫组化染色,C1-2,C4-5:DAB 显色;C3,C6:BCIP/NBT显色;FSGS:局灶节段性肾小球硬化;IOD:累积光密度
FSGS患者GADD45B表达量与临床病理指标的相关性pearson相关性分析显示,FSGS患者肾小球GADD45B表达与蛋白尿呈正相关(r=0.667,P<0.01)(图2A),与Alb呈负相关(r=-0.371,P<0.05)(图2B),与SCr呈正相关(R=0.361,P<0.05)(图2C)。
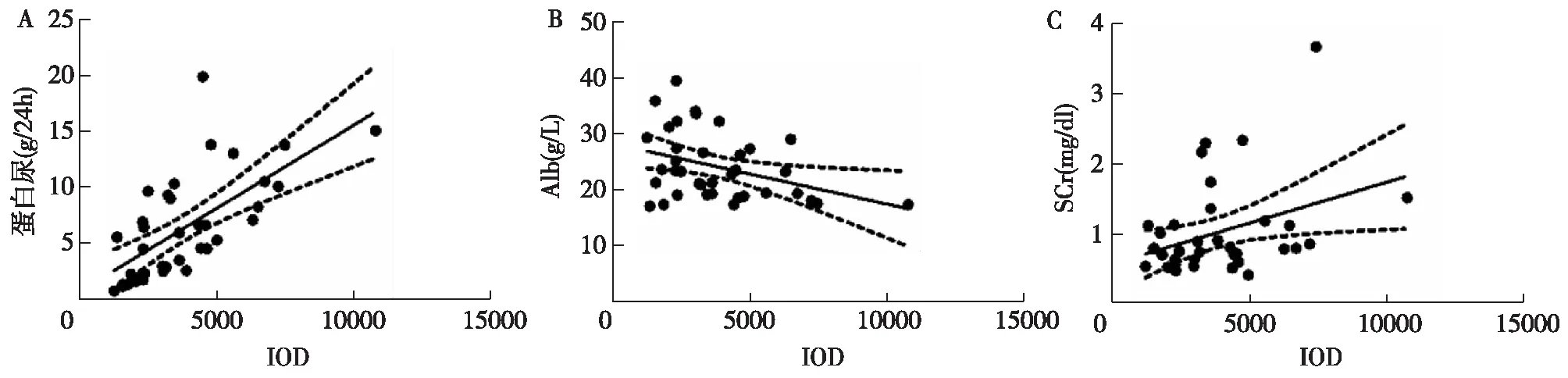
图2 FSGS患者肾小球GADD45B表达量与临床指标的相关性A:GADD45B表达量与蛋白尿呈正相关;B:与Alb呈负相关;C:与SCr呈正相关;SCr:血清肌酐;Alb血清白蛋白;I0D:累积光密度
GADD45B在斑马鱼足细胞上表达GADD45B在斑马鱼的同源基因为GADD45Ba和GADD45Bb。利用qRT-PCR对分离斑马鱼足细胞并进行纯度验证,结果显示分离下的肾小球组织只表达足细胞标记分子podocin而不表达肾小管标记分子cdh17(图3A)。 RT-PCR结果显示GADD45B和在斑马鱼肾小球上有表达(图3B)。
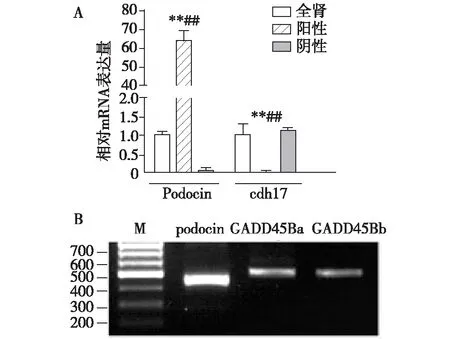
图3 斑马鱼足细胞表达GADD45BA:分离斑马鱼足细胞进行纯度验证;B:分离斑马鱼足细胞GADD45Ba和GADD45Bb的RT-PCR结果
GADD45Ba/bb过表达加重MTZ诱导的足细胞损伤基于UAS/GAL4系统构建足细胞稳定表达GADD45Ba和GADD45Bb转基因斑马鱼,原位杂交结果验证,GADD45Ba/bb特异在转基因斑马鱼肾小球高表达(图4A)。Tg(pod:Gal4;UAS:NTR-mcherry)与Tg(UAS:GADD45Ba/bb,cmlc:gfp)斑马鱼交配产卵,通过荧光筛选,带有双色荧光的幼鱼同时表达GADD45Ba/bb和NTR基因,只有肾小球带红色荧光的幼鱼只表达 NTR基因(图4B)。MTZ处理48h,结果显示足细胞上表达GADD45Ba/bb斑马鱼水肿程度和水肿率明显增高(图4C)。Tg(pod:NTRmCherry;l-fabp:VDBP-GFP)斑马鱼表达GFP标记维生素D (VDBP)蛋白。VDBP的分子量和等电点类似人Alb,可作为一个模拟反映肾小球滤过屏障通透性的示踪标记。MTZ处理后肾小球滤过屏障破坏可导致GFP在近端小管荧光积累(图4D),表明肾小球滤过屏障受损,大分子物质滤过,以及足细胞凋亡(图4E)和脱落。ELISA定量结果显示,斑马鱼足细胞过表达表达GADD45Ba/bb可明显加重MTZ诱导的NTR转基因鱼蛋白尿。0.1% DMSO和10 mmol/L MTZ 处理GADD45Ba/bb组并未表现出显著的GFP排泄(图4F)。Caspase-3染色结果显示,斑马鱼足细胞表达GADD45Ba/bb可明显加重MTZ诱导的NTR转基因斑马鱼足细胞凋亡(图4G)。
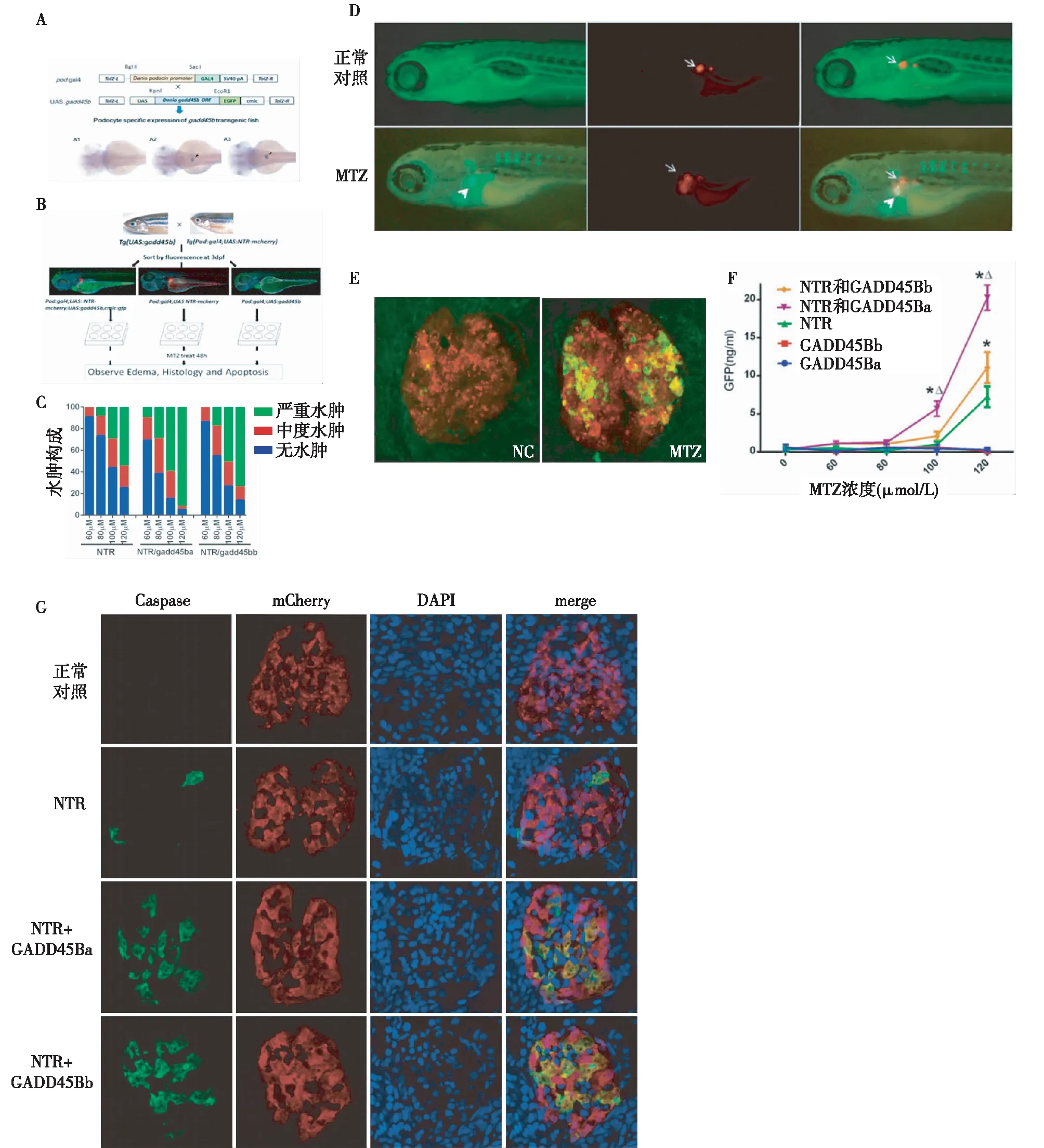
图4 GADD45Ba/bb过表达加重MTZ诱导的足细胞损伤A:建立足细胞稳定表达GADD45Ba/bb斑马鱼示意图及原位杂交;A1:对照; A2/A3:足细胞表达GADD45Ba/bb斑马鱼;B:荧光筛选转基因斑马鱼; C:MTZ处理后水肿程度和水肿率;D:MTZ处理转基因鱼(pod:NTRmCherry; l-fabp:VDBP-GFP)后导致GFP在近端小管荧光积累;E:Caspase-3染色阳性;F:ELISA检测GFP排泄情况;G: Caspase3染色阳性
抑制GADD45Ba/bb表达减轻MTZ诱导的足细胞损伤利用splicing MO 造成GADD45Ba/bb前体mRNA剪切异常,阻抑斑马鱼GADD45Ba/bb表达(图5A)。对Tg(pod:Gal4;UAS:NTR-mcherry)斑马鱼胚胎注射GADD45Ba/bb-MO后的RT-PCR结果显示,除了野生型条带,还出现了新条带(图5B),提示MO造成了碱基的插入。MO注射3天和5天分别取30只斑马鱼行qRT-PCR检测MO敲低程度,结果显示,在3天和5天时GADD45Ba表达分别被抑制47.1%±6.8%、 25.3%±8.5%;GADD45Bb表达在3天和5天时被抑制42.4%±5.9%、19.2%±7.6%(图5C、D)。MTZ处理注射过MO的Tg(pod:NTRmCherry;l-fabp:VDBP-GFP),结果显示,抑制GADD45Ba和GADD45Bb可显著减轻NTR转基因鱼MTZ引起的水肿(图5E)和蛋白尿(图5F)。
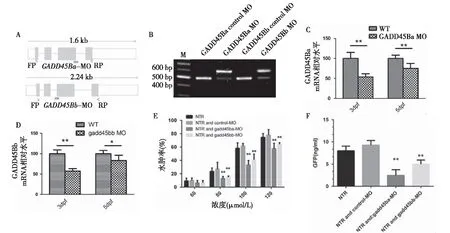
图5 抑制GADD45Ba/bb表达减轻MTZ诱导的足细胞损伤A:MO作用示意图;B:RT-PCR验证MO剪切效果;C,D:qPCR验证敲低程度;E: MTZ处理后斑马鱼水肿率,NTR:未注射MO组,NTR+control MO:注射对照MO组,NTR+GADD45Ba MO:注射GADD45Ba MO组,NTR+GADD45Bb MO:注射GADD45Bb MO组;F:MTZ处理斑马鱼GFP的排泄量
讨 论
GADD45B表达上调通常与应激下生长停滞或DNA损伤有关,DNA损伤可诱导GADD45B表达[7]。GADD45B参与了多种细胞适应应激过程,包括细胞凋亡、DNA修复、染色质调节和细胞周期延迟。GADD45B在细胞凋亡的调控中发挥复杂作用,取决于细胞种类和刺激方式,可增强或抑制细胞凋亡。Gupta等发现在造血细胞过表达GADD45A和GADD45B,可显著抑制DNA损伤剂,包括紫外线(UV)诱导的造血细胞细胞凋亡,促进细胞存活[8]。Larsen等报道,IL-1β刺激大鼠胰岛素瘤细胞(INS-1E)可诱导GADD45B以时间依赖的方式表达增加;过表达GADD45B能显著减少IL-1β诱导的INS-1E细胞凋亡[9]。Ma等[10]发现在成熟的海马神经元中GADD45B是神经活动诱导的早期快反应基因,GADD45B缺陷小鼠表现出神经活动诱导神经祖细胞增殖缺陷和成年海马新生神经元的树突生长抑制。但也有报道称GADD45B扮演损伤性作用。Kim发现,在大鼠心脏和体外心肌细胞中,GADD45B介导缺血/缺氧诱导心肌细胞凋亡[11]。
据报道,GADD45B可通过与调节因子如MTK1_MEKK4相互作用参与细胞周期调控[12]。GADD45B与MTK1_MEKK4的 N-氨基末端结构域相互作用导致构象变化,释放MTK1自动抑制作用,MTK1激活诱导MKK6磷酸化,然后激活p38和c-Jun氨基末端激酶信号通路。有研究称GADD45家族可以抑制MKK7-JNK信号通路[13]。最近,GADD45B被发现在环境和生理应激下DNA去甲基化中发挥作用[14]。
斑马鱼肾单位分子组成、结构和功能与高等哺乳动物后肾高度保守,是近年来肾脏疾病研究理想的脊椎动物模型,在肾病相关基因的筛查和研究中发挥了重要作用[6,15-16]。
综上所述,我们发现GADD45B在斑马鱼足细胞应激反应扮演着重要作用。同时也提供了利用斑马鱼模型研究足细胞损伤相关基因功能的模型。随着基因编辑技术如CRISPR/Cas9等的成熟和转基因斑马鱼的成功构建,斑马鱼模型在基因功能筛选中发挥了重要作用。
1 Lim,BJ,Yang JW,Do WS,et al.,Pathogenesis of Focal Segmental Glomerulosclerosis.Journal of Pathology & Translation Medicine,2016.50(6):405.
2 Nowicki B,Nowicki S.DAF as a therapeutic target for steroid hormones:implications for host-pathogen interactions.Adv Exp Med Biol,2013,735:83-96.
3 Shi S1,Yu L,Chiu C,et al.Podocyte-selective deletion of dicer induces proteinuria and glomerulosclerosis.J Am Soc Nephrol,2008,19(11):2159-2169.
4 Zhang N1,Ahsan MH,Zhu L,et al,NF-kappaB and not the MAPK signaling pathway regulates GADD45Beta expression during acute inflammation.J Biol Chem,2005,280(22):21400-21408.
5 Pippin JW,Durvasula R,Petermann A,et al.DNA damage is a novel response to sublytic complement C5b-9-induced injury in podocytes.J Clin Invest,2003,111(6):877-885.
6 Zhou W,Hildebrandt F.Inducible podocyte injury and proteinuria in transgenic zebrafish.J Am Soc Nephrol,2012,23(6):1039-1047.
7 Chakravarty D,Cai Q,Ferraris JD,et al.Three GADD45 isoforms contribute to hypertonic stress phenotype of murine renal inner medullary cells.Am J Physiol Renal Physiol,2002,283(5):F1020-1029.
8 Gupta M,Gupta SK,Hoffman B,et al.Gadd45a and GADD45B protect hematopoietic cells from UV-induced apoptosis via distinct signaling pathways,including p38 activation and JNK inhibition.J Biol Chem,2006,30,281(26):17552-17558.
9 Larsen CM,Døssing MG,Papa S,et al.Growth arrest- and DNA-damage-inducible 45beta gene inhibits c-Jun N-terminal kinase and extracellular signal-regulated kinase and decreases IL-1beta-induced apoptosis in insulin-producing INS-1E cells.Diabetologia,2006,49(5):980-989.
10 Ma DK,Jang MH,Guo JU,et al.Neuronal activity-induced GADD45B promotes epigenetic DNA demethylation and adult neurogenesis.,323(5917):1074-1077.
11 Kim YA,Kim MY,Yu HY,et al.Gadd45β is transcriptionally activated by p53 via p38α-mediated phosphorylation during myocardial ischemic injury.J Mol Med (Berl),2013,91(11):1303-1313.
12 Takekawa M,Tatebayashi K,Itoh F,et al.Smad-dependent GADD45Beta expression mediates delayed activation of p38 MAP kinase by TGF-beta.EMBO J,2002,21(23):6473-6482.
13 Ueda T,Kohama Y,Kuge A,et al.GADD45 family proteins suppress JNK signaling by targeting MKK7.Arch Biochem Biophys,2017,635:1-7.
14 Ebarasi L,Oddsson A,Hultenby K,et al.Zebrafish:a model system for the study of vertebrate renal development,function,and pathophysiology.Curr Opin Nephrol Hypertens,2011,20(4):416-424.
15 Hentschel DM,Mengel M,Boehme L,et al.Rapid screening of glomerular slit diaphragm integrity in larval zebrafish.Am J Physiol Renal Physiol,2007,293(5):F1746-1750.
16 Ebarasi L1,Oddsson A,Hultenby K,et al.Zebrafish:a model system for the study of vertebrate renal development,function,and pathophysiology.Curr Opin Nephrol Hypertens,2011,20(4):416-424.

