肾移植后轻链沉积病
徐 峰 曾彩虹
病例摘要
病史患者男性,49岁,因“肾移植术后2年,血清肌酐(SCr)升高1月”于2018-02-21入院。
患者因慢性肾功能不全(CKD 5D期)行血液透析治疗8个月后于2016-02-19在外院行右侧同种异体肾移植术,术后予泼尼松+他克莫司(FK506)+西罗莫司+麦考酚钠肠溶片抗排斥治疗,术后1周SCr降至110 μmol/L。于当地医院门诊规律随访,查尿蛋白阴性,隐血+~++,SCr波动于137~146 μmol/L,FK506浓度6~8 ng/ml。2018-01-20复查SCr 180 μmol/L,当地医院将FK506由1 mg 1次/12h减量至0.5 mg 1次/12h。2018-02-15复查尿蛋白+,隐血++,SCr 236 μmol/L,免疫抑制方案为泼尼松5 mg 1次/d+FK506 1 mg 1次/12h+西罗莫司0.5 mg 1次/d+麦考酚钠肠溶片 0.36g 1次/12h+雷公藤20 mg 3次/d。病程中患者精神、食欲、睡眠可,尿量正常,大便正常,体重无明显改变。为明确诊断收住入院。
既往史2012年体检发现SCr 396 μmol/L,予保肾治疗。2015年开始血液透析治疗。否认肝炎、结核、疟疾等传染病史,否认“高血压”病史,否认外伤、输血及过敏史。
家族史及个人史无特殊。
体格检查体温36.7℃,脉搏74次/min,呼吸16次/min,血压132/70 mmHg,体质量指数(BMI)24 kg/m2。心律齐,未闻及杂音,双肺听诊呼吸音正常,未闻及干湿啰音及胸膜摩擦音,腹平软,全腹无压痛及反跳痛,肝脾肋下未触及,双下肢无水肿。右手前臂可触及动静脉瘘,震颤良好,右下腹见一长约12 cm的手术瘢痕,可及移植肾,大小约10 cm×5 cm,质中,无压痛,边界清,未闻及血管杂音。
实验室检查
尿液检查 尿蛋白定量1.62 g/d、尿沉渣红细胞计数65.5 个/μl、尿NAG 5.7 U/(g·Cr)、RB蛋白0.3 mg/L、尿溶菌酶测定<0.5 mg/L;尿游离轻链:κ 173.00 mg/L、λ 6.50 mg/L、κ/λ 26.62。
血常规 血红蛋白129 g/L、白细胞计数7.1×109/L、淋巴细胞百分数21.10%、中性粒细胞百分数65.60%、血小板计数122×109/L。
血生化 白蛋白38.2 g/L,球蛋白 36.9 g/L,丙氨酸氨基转移酶45.0 U/L,天门冬氨酸氨基转移酶31.0 U/L,尿素氮13.6 mmol/L,SCr 241 μmol/L,尿酸273 μmol/L,三酰甘油5.7 mmol/L,总胆固醇9.08 mmol/L,电解质正常。
免疫学检查 CD4 625个/μl ,CD8 818个/μl;AECA 阴性;FLOW-PRA I类阴性,Ⅱ类阴性,抗MICA抗体阴性。补体C3 1.34 g/L、补体C4 0.297 g/L;IgG 9.74 g/L,IgA 0.554 g/L,IgM 0.447 g/L,IgE <20 IU/ml,ASO <25 IU/ml,RF <20 IU/ml,IgG4 208 mg/L;血游离轻链:κ 40.80 mg/L、λ 24.40 mg/L、κ/λ 1.67;免疫固定电泳未见单克隆免疫球蛋白条带。
病原学检查 传染病四项阴性。
血药浓度 FK506血药浓度 4.9~5.1 ng/ml,雷帕霉素血药浓度8.49 ng/ml。
辅助检查
心电图 (1)窦性心律;(2)ST段改变。
移植肾血管超声 移植肾各级动脉阻力指数增高。
胸部CT (1)右肺中叶外侧段钙化,右肺中叶内侧段机化性肺炎;(2)左肺下叶后基底段局灶性炎症;(3)主动脉及冠状动脉粥样硬化。
骨髓穿刺 大致正常骨髓像。骨髓活检未见异常。
肾活检
光镜 皮质肾组织2条,27个肾小球中2个球性废弃,余肾小球系膜区中~重度增宽,系膜细胞和基质增多,见结节形成(图1A),毛细血管袢开放尚好,见单个核细胞、中性粒细胞5~10个/袢,囊壁节段增厚分层。PASM-Masson:阴性。肾小管间质急性病变中度,多灶性肾小管上皮细胞刷状缘脱落,偶见小管炎(1个/切面),伴轻度慢性病变,多处小灶性肾小管萎缩、基膜增厚,间质较多单个核细胞浸润,呈小灶性聚集,多处小灶性纤维化。小动脉节段透明变性,小叶间动脉弹力层增厚分层。刚果红染色阴性。
免疫荧光 肾小球3个,冰冻切片荧光染色IgG、IgA、IgM、C3、C1q均阴性。κ轻链++,呈颗粒状弥漫分布于系膜区,线样沉积于毛细血管袢,肾小管基膜、间质血管壁κ 轻链阳性(图1B),λ轻链阴性。C4d管周毛细血管阴性。
免疫组化 肾组织冰冻切片BK病毒染色阴性。HLA-DR 皮质肾小管45% 表达,阳性 20%,弱阳性 25%。
电镜 肾小球系膜区显著增宽,系膜细胞和基质增多,系膜区见细颗粒状电子致密物分布。毛细血管袢开放尚好,基膜内侧见细颗粒状电子致密物呈带状分布(图1C),节段袢融合,袢内见内皮细胞聚集和单核细胞分布。肾小管基膜外侧、小动脉壁和间质亦见细颗粒状电子致密物沉积。
病理诊断:移植肾轻链沉积病(LCDD)(κ型)。
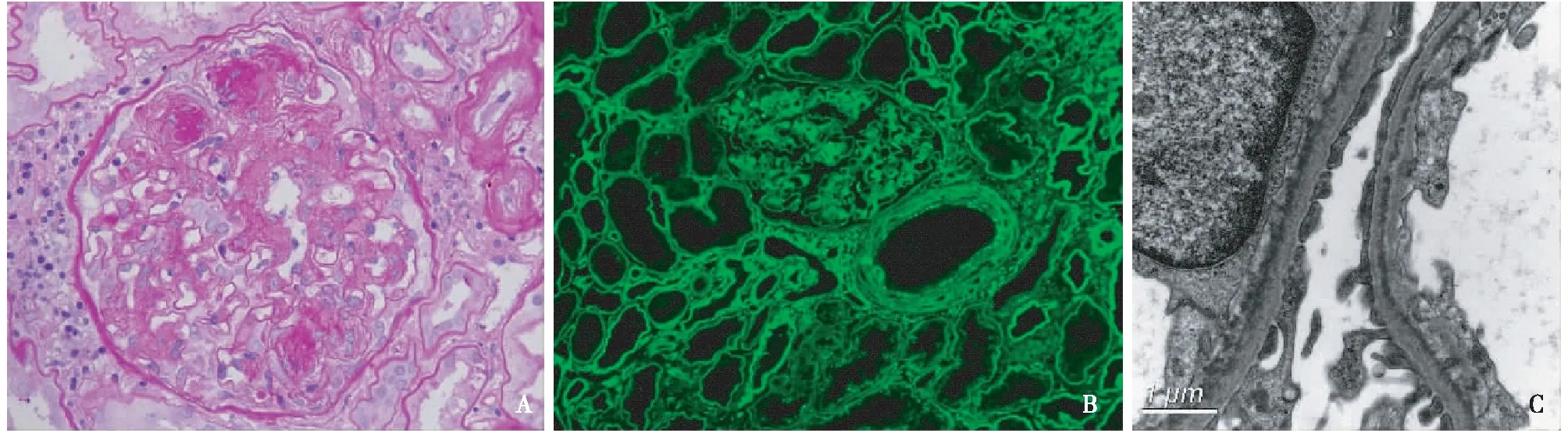
图1 A:肾小球系膜区中~重度增宽,见结节形成(PAS,×400);B:肾小球κ轻链++,呈颗粒状弥漫分布于肾小球系膜区,线样沉积于毛细血管袢,肾小管基膜、间质血管壁κ 轻链阳性(IF,×200);C:肾小球毛细血管袢基膜内侧见细颗粒状电子致密物呈带状分布(EM)
治疗及随访明确诊断后抗排斥方案维持不变,出院后外院予硼替佐米联合地塞米松方案已治疗2个疗程,复查尿蛋白+,SCr 230 μmol/L,血游离轻链:κ 29.4 mg/L、λ 20.8 mg/L,κ/λ 1.41。
讨 论
本例中年男性患者,移植术后2年,临床表现为SCr升高,伴中等量蛋白尿和少量血尿,血、尿游离轻链比值略升高,肾活检组织学表现为肾小球中~重度系膜增生性病变伴结节形成,肾小管间质中度急性病变。免疫荧光IgG、IgA、IgM、C3、C1q均阴性,C4d管周毛细血管壁阴性。κ轻链弥漫分布于肾小球系膜区、毛细血管袢,肾小管基膜和间质血管壁,超微结构观察肾小球系膜区、毛细血管袢基膜内侧、肾小管基膜外侧缘、间质和小动脉壁见细颗粒状电子致密物沉积。诊断符合移植肾LCDD(κ型)。
诊断和鉴别诊断移植后出现肾功能不全需要考虑多种可能,如急性/慢性排斥反应、药物毒性、感染及原发或新生的肾脏疾病等[1],本例虽然移植肾轻链沉积病诊断明确,但仍需排除合并其他情况。
排斥反应包括抗体介导和T细胞介导的排斥反应,本例组织学存在肾小球炎和少量管周毛细血管炎,但是Banff评分肾小球炎+管周毛细血管炎仅2分,未见动脉内膜炎,管周毛细血管C4d染色阴性,FLOW-PRA Ⅰ类和Ⅱ类抗体、抗MICA抗体均为阴性,因此抗体介导的排斥反应证据不足。本例存在中度的肾小管急性病变,但是仅偶见肾小管炎,间质较多的炎细胞浸润,呈灶性聚集而不是弥漫性分布,参照Banff分型,未达到活动性T细胞介导的排斥反应诊断标准。
肾移植抗排斥药物导致肾损害主要为神经钙调蛋白抑制剂,包括环孢素A和FK506,相关肾损害可表现为肾小管上皮细胞等立方空泡变性,肾小球局灶节段性肾小球硬化,动脉中膜的结构重塑,如中膜和外膜的滴状透明变性、血栓性微血管病样病变。而本例并无以上典型改变。
本例肾小球炎,间质炎细胞浸润,需要排除感染的可能性,但是间质浸润细胞以单个核细胞为主,可见少量中性粒细胞分布,结合临床无发热、C反应蛋白升高等证据,肾组织SV-40大T抗原染色阴性。因此感染的可能性不大。
轻链相关肾病还包括轻链管型肾病、淀粉样变性,轻链肾小管病等[2]。本例管腔内未见骨髓瘤样管型,肾组织刚果红染色阴性,肾小管上皮细胞胞质内未见结晶和单一轻链沉积,可排除合并存在其他轻链相关肾病的可能。
移植肾轻链沉积病本例缺少自体肾活检资料,无法判断轻链沉积病为新生还是复发。新生的LCDD少见,有报道肾移植术后16年出现新生的LCDD[3]。本例移植术后2年发现了LCDD,新生的可能性也不能完全排除。如果能明确对侧肾的情况,则有助于鉴别。同时也说明供肾活检及程序性活检的重要性。
复发性移植肾LCDD报道相对较多[4-5]。LCDD肾移植后的复发率较高,并导致移植肾迅速失功。Leung等[6]总结了7例行肾移植的LCDD患者,其中1例早期出现骨髓瘤复发,5例出现了LCDD复发,复发的中位时间为33.3月,其中4例死亡,1例进入血液透析治疗。因此,包括LCDD在内的具有肾脏意义的单克隆丙种球蛋白病(MGRS)是肾移植的相对禁忌症,需要进行治疗后才可以考虑肾移植,否则移植后会很快复发[7-8],随着自体外周血干细胞移植和硼替佐米的推广,减少异常轻链的产生,LCDD患者移植肾可延迟复发,获得较长的生存期[9-11]。本例患者确诊后接受了2个疗程的BD方案治疗,血轻链比值恢复正常,SCr略有下降。预后如何还需进一步随访。
本例骨髓穿刺未见异常,血清免疫固定电泳亦未发现单克隆免疫球蛋白条带,血游离轻链比值稍高于正常值,仅尿游离轻链比值明显升高。虽然LCDD是单克隆免疫球蛋白病,然而部分病例临床并没有骨髓瘤或单克隆免疫球蛋白条带。Li等[12]总结了48例中国自体肾LCDD的临床和病理特征,发现骨髓瘤的比例仅24.4%,血清单克隆免疫球蛋白阳性的比例仅26.2%,Leung等[6]报道的7例移植肾复发性LCDD患者中也有2例未见多发性骨髓瘤和血清单克隆免疫球蛋白条带。完善血、尿免疫固定电泳和游离轻链检测可提高临床发现LCDD的灵敏度[13],而肾活检和免疫组织学检查仍是诊断LCDD的金标准[14]。
LCDD也是一类系统性疾病,可累及多个器官,而肾移植后LCDD复发同样也会累及肾外器官[15],系统的实验室和影像学检查非常必要。本例目前尚没有发现累及肾外其他器官的证据,随访过程中仍需进一步监测,排除其他器官的功能。
小结:移植肾LCDD的组织学改变类似自体肾LCDD,肾活检免疫组织学检查是诊断LCDD最重要的手段。LCDD肾移植术后易复发,需联合自体干细胞移植或硼替佐米等治疗后方可行肾移植。
1 Haas M,Sis B,Racusen LC,et al.Banff 2013 meeting report: inclusion of c4d-negative antibody-mediated rejection and antibody-associated arterial lesions.Am J Transplant,2014,14(2):272-283.
2 Ciocchini M,Arbelbide J,Musso CG.Monoclonal gammopathy of renal significance (MGRS): the characteristics and significance of a new meta-entity.Int Urol Nephrol,2017,49(12):2171-2175.
3 Ecder T,Tbakhi A,Braun WE,et al.De novo light-chain deposition disease in a cadaver renal allograft.Am J Kidney Dis,1996,28(3):461-465.
4 Larsen T,Hammer A,Jørgensen KA.Recurrence of light-chain deposition disease after renal transplantation.Scand J Urol Nephrol,2008,42(2):187-188.
5 Horike K,Takeda A,Otsuka Y,et al.A case of recurrent light chain deposition disease after living-related renal transplantation - detailed process of the recurrence.Clin Transplant,2012,26 Suppl 24:64-69.
6 Leung N,Lager DJ,Gertz MA,et al.Long-term outcome of renal transplantation in light-chain deposition disease.Am J Kidney Dis,2004,43(1):147-153.
7 Stern L,Havasi A.Renal transplantation in amyloidosis and MIDD.Front Biosci (Elite Ed),2015,7:149-157.
8 Angioi A,Amer H,Fervenza FC,et al.Recurrent Light Chain Proximal Tubulopathy in a Kidney Allograft.Am J Kidney Dis,2016,68(3):483-487.
9 Barraclough KA,Dowling JP,Schwarer AP,et al.Sequential autologous peripheral blood stem cell transplantation and kidney transplantaion of light chain deposition disease.Nephrol Dial Transplant,2007,22(4):1268-1269.
10 Moiz A,Javed T,Garces J,et al.Late recurrence of light chain deposition disease after kidney transplantation treated with bortezomib: a case report.Ochsner J,2014,14(3):445-449.
11 Kuppachi S,Holanda D,Thomas CP.Light Chain Deposition Disease After Kidney Transplantation With Long Graft Survival: Case Report.Transplant Proc,2016,48(1):255-258.
12 Li XM,Rui HC,Liang DD,et al.Clinicopathological characteristics and outcomes of light chain deposition disease: an analysis of 48 patients in a single Chinese center.Ann Hematol,2016,95(6):901-909.
13 Jimenez-Zepeda VH.Light chain deposition disease: novel biological insights and treatment advances.Int J Lab Hematol,2012,34(4):347-355.
14 van Ingen G,van Bronswijk H,Meijer CJ,et al.Light chain deposition disease without detectable light chains in serum or urine.Report of a case and review of the literature.Neth J Med,1991,39(3-4):142-147.
15 Jimenez-Zepeda VH,Vajpeyi R,John R,et al.Light chain deposition disease affecting the gastrointestinal tract in the setting of post-living donor kidney transplantation.Int J Hematol,2012,96(1):125-131.

