血细胞样本长期低温保存对DNA质量和产量的影响
窦为娟 卢颖辉 唐 蓉 周敏林 贺 贝 尹 茹 朱 萍 曾彩虹 刘志红 郑春霞
生物样本库为医学研究提供了重要资源,高质量的冷冻样本是进行基因组学、转录组学、蛋白组学等研究的最基本要求。疾病的复杂病因学是一个挑战,遗传易感性、生活方式及环境都可能对疾病的发展有影响。随着医学水平的发展,一些新基因逐渐被发现,以及一些已知基因新功能的确定,需要重新对某类患者进行大规模基因组学研究,因此要收集成千上万份的血液或组织样本,这些样本可能于生物样本库中已经保存了很多年[1-2]。从临床诊断到基因组学研究,血液样本是最常用的提取DNA材料之一,能否从血液样本中提取到高质量的DNA是限制后续基因组学研究成功的关键。样本的质量直接影响后续研究的准确性和科学性[3-5]。
血液样本中DNA通常以全血、血细胞、白膜层、血单个核细胞、血凝块这五种形式保存,关于不同形式之间保存效果比较的报道较少见。有研究指出DNA的保存形式应根据研究需要来选择[6-7],然而在实际操作中,还需要考虑到样本采集量是否节约,收集是否便利快捷,样本能否被充分利用,以及保存空间和成本等因素。10年前我们样本库采用抗凝血分离出血细胞的形式保存DNA,并将吸取的上层血浆同时进行冻存,这种保存方法使得血液样本充分利用,并减少患者采血量和中间人为操作环节。本研究通过检测保存10年以上血细胞样本抽提DNA的纯度、产量及完整性,明确长期低温保存的血细胞样本DNA能否用于后续全基因组关联分析(GWAS)、外显子测序等基因组学研究。
材料与方法
样本来源南京总医院国家肾脏疾病临床医学研究中心生物样本库中保存10年以上(11~13年,保存时间为2004~2006年,于2017年提取DNA)的150份血细胞样本。所有样本均为清晨采集空腹外周静脉血3 ml于EDTA抗凝管中,静置30 min后,室温离心(1 000 r/min,10 min),吸取上层血浆转移至2 ml冻存管中,以便用于其他研究,再将剩余的血细胞全部转移至2 ml冻存管中,并立即冻存于-80℃超低温冰箱。从血液采集到存入冰箱的时间≤8 h,保存期间,冰箱温度设置为-80℃,温度维持在-60~-80℃之间,所有用于检测DNA的血细胞样本均未经过冻融。所有患者血液样本的保存和使用均经过南京总医院伦理委员会的批准。
检测方法
DNA抽提 所有血细胞样本均在室温下解冻,然后用生理盐水将血细胞容量补足至3 ml。检查有无血凝块。采用PerkinElmer与Hamilton公司联合提供的全自动核酸提取仪及其配套的DNA提取试剂盒(Chemagic DNA Blood Kit,CMG-1073)。DNA抽提利用磁珠法原理,并遵循保证核酸一级分子结构的完整性及排除其他分子污染的原则,提取纯化DNA。DNA洗脱液为10 mMTris-HCl pH 8.0,体积为800 μl。
DNA纯度及产量测定 取1 μl DNA样品,采用微量紫外分光光度仪Nanodrop2000(Thermo Scientific)进行测定,检测A260/A280、A260/A230及DNA浓度,再根据浓度和溶解体积计算出所得DNA产量。通常1.7≤A260/A280≤1.9,并且A260/A230≥2.0被认为是反映DNA纯度的理想标准。DNA产量≥10 μg则足以用于基因组学研究。A260/A230用来反映影响DNA纯度的其他污染物,若比值<2.0则说明可能存在盐离子等杂质的残留。
DNA完整性测定 取200 ng DNA样品上样,L2000 DNA marker为分子量标准,80 V恒定电压电泳30 min,0.8%溴化乙啶染色,SIM凝胶成像系统进行照相并保存。泳道口中如果存在较亮的条带,提示有蛋白污染。DNA 电泳条带最前面如果有较小的条带,提示存在 RNA 污染。条带弥散、拖尾,提示DNA有降解。
统计学方法所有样本DNA测得的A260/A280、A260/A230及总量均以均数、标准差表示;采用SPSS 23.0对样本来源患者采集样本时的白细胞数量及样本DNA产量间采用双变量相关分析,pearson相关系数>0.7表示强相关,0.4~0.7中度相关,<0.4表示弱相关。显著性检验结果sig(双侧)P<0.05表示统计学差异有意义,两者相关有统计学意义;sig(双侧)P>0.0.5表示统计学差异不显著,两者相关无统计学意义,该相关可能是由于抽样误差等其他因素所致。
结 果
所有血细胞样本提取DNA的A260/A280均数是1.84,该值在1.7~1.9范围内,表明所提取的DNA纯度高;所有样本DNA的A260/A230均数是2.27,该值>2.0,表明所提取的DNA污染较少;所有样本DNA产量均数是187.57 μg,该值>10 μg,表明所提取的DNA量足以用于基因组学研究(表1)。150份样本凝胶电泳均可见DNA条带比较集中,未见弥散分布,分子量均≥20 kb(图1)。

表1 血细胞样本抽提DNA的情况
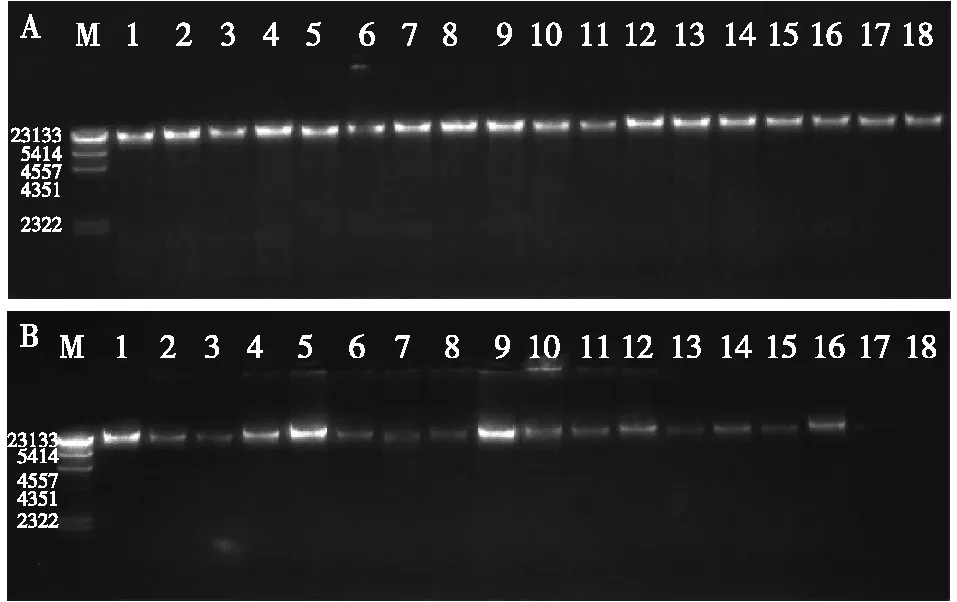
图1 琼脂糖凝胶电泳检测DNA完整性A:1~18为DNA 1.7≤A260/A280≤1.9且A260/A230≥2.0的代表性样本凝胶条带;B:1~4为DNA产量≥10μg,A260/A280<1.7或A260/ A 280>1.9,A260/A230≥2.0的所有凝胶条带;5~11为DNA产量≥10μg,A260/A280<1.7或A260/ A 280>1.9,A260/A230<2.0的所有凝胶条带;12为DNA产量<10μg,1.7≤A260/A280≤1.9,A260/A230≥2.0的凝胶条带;13为DNA产量<10μg,1.7≤A260/A280≤1.9,A260/A230<2.0的凝胶条带;14为DNA产量<10μg,A260/ A 280>1.9,A260/A230≥2.0的凝胶条带;15~18为DNA产量<10μg,A260/A280<1.7或A260/A 280>1.9,A260/A230<2.0的凝胶条带;M:DNA marker
150份血细胞样本抽提的DNA中,134份1.7≤A260/A280≤1.9,占89.3%;120份A260/A230≥2.0,占80%;115份1.7≤A260/A280≤1.9且A260/A230≥2.0,占76.7%;19份1.7≤A260/A280≤1.9且A260/A230<2.0,占12.7%;2份A260/A280<1.7且A260/A230≥2.0,占1.3%;3份A260/A280>1.9且A260/A230≥2.0,占2%;6份A260/A280<1.7且A260/A230<2.0,占4%;5份A260/A280>1.9且A260/A230<2.0,占3.3%(图2)。
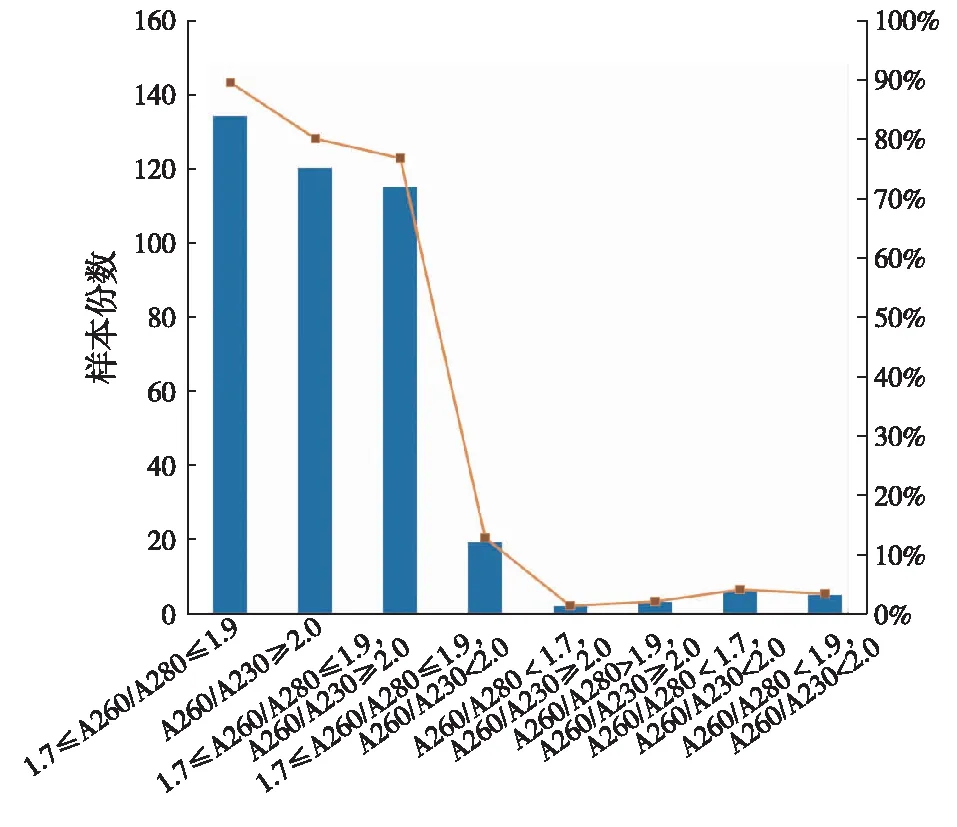
图2 150份血细胞样本抽提DNA的纯度分析
143份DNA产量≥10 μg,占95.3%。1.7≤A260/A280≤1.9且DNA产量≥10μg的血细胞样本有132份,占88%。1.7≤A260/A280≤1.9、A260/A230≥2.0且DNA产量≥10μg的血细胞样本有114份,占76%。
DNA产量≥10 μg的143份血细胞样本纯度分析见图3。
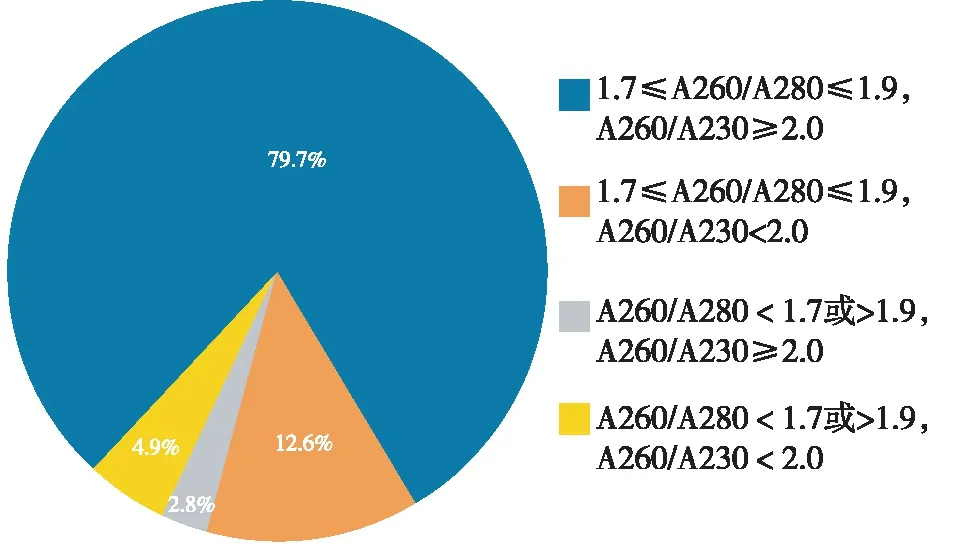
图3 143份DNA产量≥10 μg样本纯度分析
DNA产量<10 μg的7份血细胞样本中,最低产量为5.2 μg。具体样本纯度分析见图4。
患者白细胞数量与DNA产量相关分析,显示白细胞数量与DNA产量间无相关性(P>0.05)。
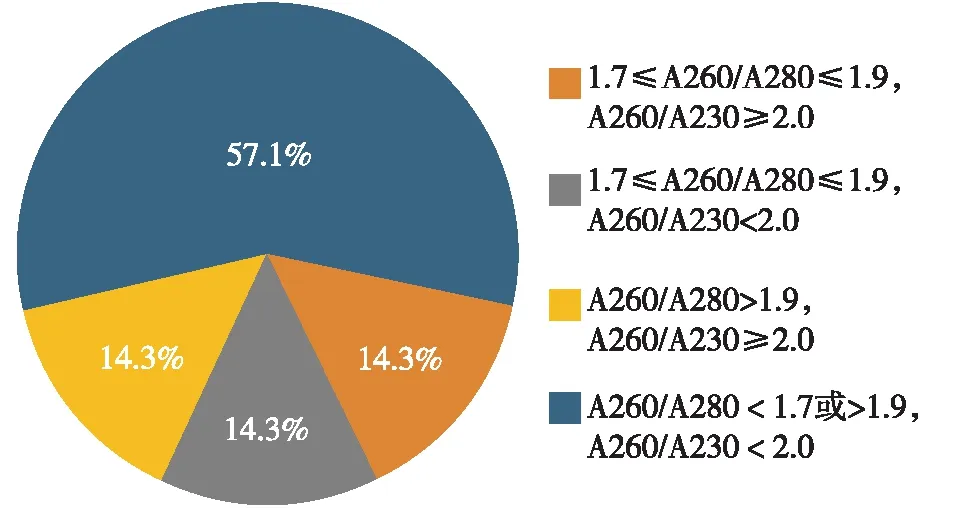
图4 7份DNA产量<10 μg样本纯度分析
讨 论
关于血液样本经过长期低温保存后抽提的DNA是否能满足研究需要,目前报道并不多见。国际上对于不同来源样本抽提的DNA目前并没有统一的标准来衡量,是否可用于后续研究取决于该研究对DNA产量、纯度和完整性的要求。事实上,如果DNA产量≥10 μg,A260/A280在1.7~1.9之间,A260/A230≥2.0,凝胶电泳没有降解条带,则认为可满足任何分子或基因组检测。
早在十年前,国内就有单位将不同种类的血液以不同方式保存起来,用于今后相关DNA的研究。2000年有报道表明保存在-20℃的全血中提取的DNA质量及产量均较高,且保持着高度完整性[8]。Visvikis等[9]报道短期(1年内)和长期(5~6年)保存在-70℃和-80℃的全血提取DNA的质量和产量几乎无明显下降。近年也有少数关于血液样本长期低温保存对DNA质量及产量影响的研究,如Richardson等[10]通过对4℃保存11~922d的全血样本进行DNA提取,发现随着保存时间的延长,所得到DNA的产量会有所减少;也有报道表明-75℃保存3个月会后提取的全血基因组 DNA产量降低,而质量无明显变化[11]。最近有研究关于保存温度对DNA质量影响的报道,该研究通过将全血样本(n=6)在4℃、-20℃和-80℃分别保存20年后,提取DNA,检测DNA的质量,并与新鲜全血样本提取的DNA质量进行比较,得出需要将样本保存在-20℃以下以防止DNA降解的结论[12]。Chen等[13]通过对-30℃保存了2~19年的全血样本进行DNA提取,检测DNA的质量和产量,结果发现低温保存19年的全血样本仍保持着高质量与高产量。
本研究将-80℃保存10年以上的血细胞样本磁珠法提取DNA进行检测,发现所得DNA的A260/A280在1.7~1.9之间占89.3%;A260/A230≥2.0,占80%,且琼脂糖凝胶电泳条带均在15kb以上,没有降解条带出现,说明所获得DNA的质量较高。DNA平均产量在187.57 μg,大于10μg者占95.3%,足以用于后续的全基因组关联分析、外显子捕获测序、甲基化DNA测序等。目前本中心已有研究者使用样本库保存10年以上的血细胞样本提取的DNA进行糖尿病肾病GWAS研究(文章待发表)。尤其是A260/A280在1.7~1.9之间、A260/A230在2.0以上及DNA产量>10 μg的样本份数所占比例较高,达到76%,说明这种以血细胞形式长期低温保存的样本可使DNA获得较高的保存效果。影响样本DNA的质量及使用可行性的因素有很多,例如样本类型、采集时间、采集容器及保存方法等。一些保护性措施在样本的采集、处理及保存过程中也有被使用的[14]。我中心采集和保存中的几点注意事项有助于提高DNA的保存效果:如发现有明显血凝块的标本(血凝块会导致提取的DNA纯度和浓度均降低)则重新留取血标本[15];吸取上层血浆后剩余的血细胞直接倒入冻存管中,而不采用移液枪或滴管吸取的方式,尽量减少中间人为操作环节;尽量缩短从标本采集到放入冰箱的时间;-80 ℃保存,保存期间无冻融。
此外,有研究报道提取方法会影响DNA提取的产量和纯度,尤其是库存血[16-17]。有研究者通过对6种不同DNA提取方法效果的比较,表明不同实验室之间DNA提取方法之间存在很多变量,提取方法的不同,所得到的DNA产量和纯度也会有所不同[18]。我中心的所有样本均采用全自动核酸提取仪磁珠法提取DNA,这种方法与传统的盐析法、苯酚抽提法、固相吸附法相比较,不需要多次离心,实现了提取与纯化一体化,利用仪器自动化操作,减少了人为因素的干扰,具有高效、快速、自动化的优势,可以满足大批量样本提取DNA的需求[19-20]。商品化DNA提取试剂盒说明书中提到平均可从每毫升全血中提取40 μg DNA,本研究中3ml血细胞中提取DNA平均产量为187.57 μg,因此提取的DNA产量符合要求。
其中,也有极少部分样本DNA的A260/A280超出1.7~1.9范围,A260/A230低于2.0,或DNA产量小于10 μg。究其原因,可能与血液中有较多微小血凝块、血量不足3ml及操作中的误差等有关。此外,患者的年龄也可能影响所获得的白细胞数量[21-22],从而影响DNA的产量,通常随着患者年龄增长,白细胞数量和淋巴细胞数量会呈现下降的趋势[23],然而本研究中并没有观察到白细胞对DNA产量有影响。由于本研究纳入的150例肾脏疾病患者白细胞低的仅有7例,而且最低值也超过3 000/μl,白细胞高的仅有6例,最高值不超过13 000/μl,其余患者白细胞值均在正常范围内,因此,尚不能完全确定白细胞数量与DNA产量之间的关系,关于这一问题的解决需要后续更大样本量的研究。
本研究未能获得这些样本新鲜时提取DNA的质量、产量和完整性情况,因而也无法明确纯度不高和(或)产量低的样本是在采集、处理过程中或是在保存过程中、还是在提取DNA过程中的不当因素所导致的。另外,本研究是从保存的血细胞样本提取DNA检测质量、产量和完整性,并没有与其他保存形式如:全血或白膜层细胞,作比较以明确DNA以哪种保存形式所获得的长期低温保存效果最好。这些均需要进一步的前瞻性研究。
小结:血细胞-80℃低温保存10年以上经磁珠法提取所得到的DNA仍保持着较高的纯度、产量和完整性。该研究提示了血细胞样本以这样的保存方式及提取方法,可使DNA的质量和产量达到较高水平,为其他研究者利用样本库中保存了10年以上的样本用于后续分子研究、基因组学研究提供参考。
1 Yu R,Dan Y,Xiang X,et al.Stability of Chronic Hepatitis-Related Parameters in Serum Samples After Long-Term Storage.Biopreserv Biobank,2017,15(3):211-219.
2 Carpi FM,Di PF,Vincenzetti S,et al.Human DNA extraction methods:patents and applications.Recent Pat DNA Gene Seq,2011,5(1):1-7.
3 Le PC,Köbel M,de Ladurantaye M,et al.Specimen quality evaluation in Canadian biobanks participating in the COEUR repository.Biopreserv Biobank,2013,11(2):83-93.
4 Betsou F,Barnes R,Burke T,et al.Human biospecimen research:experimental protocol and quality control tools.Cancer Epidemiol Biomarkers Prev,2009,18(4):1017-1025.
5 Shabihkhani M,Lucey GM,Wei B,et al.The procurement,storage,and quality assurance of frozen blood and tissuebiospecimens in pathology,biorepository,and biobanksettings.Clin Biochem,2014,47(4-5):258-266.
6 Steinberg K,Beck J,Nickerson D,et al.DNA banking for epidemiologic studies:a review of current practices.Epidemiology,2002,13(3):246-254.
7 韩喜荣,胡永华.血液标本类型及保存方式对DNA产量、质量的影响.中国卫生检验杂志,2002,12(5):540-542.
8 Alrokayan SAH,Wang L,Wang SS,et al.Effect of storage temperature on thequality and quantity of DNA extracted from blood.J Biol Sci,2000,3(3):392-394.
9 Visvikis S,Schlenck A,Maurice M.DNA extraction and stability for epidemiological studies.Clin Chem Lab Med,1998,36(8):551-555.
10 Richardson AJ,Narendran N,Guymer RH,et al.Blood storage at 4 degrees C-factors involved in DNA yield and quality.J Lab Clin Med,2006,147(6):290-294.
11 吕晓岩,杨志岗.保存条件对提取全血基因组DNA质量的影响.中国医药指南,2016,14(10):28-29.
12 Hara M,Nakanishi H,Yoneyama K,et al.Effects of storage conditions on forensic examinations of blood samples and bloodstains stored for 20 years.Leg Med (Tokyo),2016,18:81-84.
13 Chen WC,Kerr R,May A,et al.The Integrity and Yield of Genomic DNA Isolated from Whole Blood Following Long-Term Storage at -30°C.Biopreserv Biobank,2018,16(2):106-113.
14 Chacon-Cortes D1,Haupt LM,Lea RA,Griffiths LR.Comparison of genomic DNA extraction techniques from whole blood samples:a time,cost and quality evaluation study.Mol Biol Rep,2012,39(5):5961-5966.
15 李王霞,刘光箭,陆华新,等.标本因素对全自动磁珠法全血DNA提取的影响.中国输血杂志,2014,27(1):29-31.
16 Kalousová M,Levová K,Kuběna AA,et al.Comparison of DNA isolation using salting-out procedure and automated isolation (MagNA system).Prep Biochem Biotechnol,2017,47(7):703-708.
17 Mathay C,Hamot G,Henry E,et al.Method Validation for Extraction of Nucleic Acids from Peripheral Whole Blood.Biopreserv Biobank,2016,14(6):520-529.
18 Dilhari A,Sampath A,Gunasekara C,et al.Evaluation of the impact of six different DNA extraction methods for the representation of the microbial community associated with human chronic wound infections using a gel-based DNA profiling method.AMB Express,2017,7(1):179.
19 张振,杨文涛,陈炯,等.人外周血基因组DNA提取的影响因素及方案选择.河南科技大学学报(医学版),2016,34(4):310-315.
20 张帅,徐锐,张强,等.改良盐析法提取全血基因组DNA的影响因素研究.中国现代医学杂志,2012,22(35):42-46.
21 Bulla A,De witt B,Ammerlaan W,et al.Blood DNA yield but not integrity or methylation is impacted after long-term storage.Biopreserv Biobank,2016,14(1):29-38.
22 Mychaleckyj JC,Farber EA,Chmielewski J,et al.Buffy coat specimens remain viable as a DNA source for highly multiplexed genome-wide genetic tests after long term storage.J Transl Med,2011,9:91.
23 Erkeller-Yuksel FM,Deneys V,Yuksel B,et al.Age-related changes in human blood lymphocyte subpopulations.J Pediatr,1992,120(2 Pt 1):216-222.

