影响原发性局灶节段性肾小球硬化预后的因素
史一帆 谢静远 综述 任 红 审校
局灶节段性肾小球硬化(FSGS)发病率日益增加,是一类常见的临床病理综合征,临床上以蛋白尿或肾病综合征为主要表现,特征性病理学表现是局灶性、节段性、非增殖性毛细血管袢硬化和足细胞损害。FSGS为一病理诊断名词,分为原发性和继发性。已知多种原因可引起的局灶节段性肾小球硬化病变,称之为继发性FSGS,包括病毒感染、药物毒性、返流性肾病、肾小球毛细血管内高压力或高灌注,以及各种慢性肾小球肾炎晚期出现的FSGS等。诊断原发性FSGS需排除上述各种继发性因素。对于原发性FSGS患者,虽然目前有大量的治疗手段如糖皮质激素、免疫抑制剂、血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)类药物等,但是许多患者对于糖皮质激素和免疫抑制剂治疗呈无反应性或是依赖性;新上市的利妥昔单抗、半乳糖、阿达木单抗、阿巴西普等药物,也不是对所有患者都有效。FSGS患者预后往往较差,50%尿蛋白定量>3 g/24h的患者在5~10年内进入终末期肾病(ESRD);若尿蛋白定量>10 g/d,则肾脏5年的存活率更低[1]。总结与预后相关的因素,有助于对患者进行危险分层。本文将分别从病理、临床、基因及治疗等层面提取与原发性FSGS预后相关的危险因素,并就这些危险因素展开探讨。
病理表现
光镜根据哥伦比亚病理分型,FSGS被分为塌陷型、细胞型、顶端型、门周型及非特殊型。各病理类型的特点见表1[2]。 以我国为代表的亚洲国家以非特殊型FSGS最为常见。在光镜下观察发现塌陷型FSGS球性硬化比例最高(达60%),其后依次为门周型(23.07%)、非特殊型(16.66%)、细胞型(9.09%)、顶端型(0)[3]。国内外众多临床试验对于病理分型与预后关系的结论比较一致,顶端型FSGS预后最好,塌陷型FSGS预后最差,其余三种病理类型介于两者之间。D’Agati等[4]统计了138例FSGS患者,其中顶端型、非特殊型和塌陷型FSGS患者发展为ESRD的比例分别为7%、20%和47%。
除了肾小球病变分型,肾小管间质纤维化的程度也对FSGS的预后有着提示作用。Ren等[5]研究显示肾小管纤维化程度与患者对治疗的反应性有关:纤维化程度轻的患者治疗反应性较好;纤维化严重的患者治疗的反应性较差。该研究对2002年~2011年168例FSGS患者进行回顾性分析,结果显示,肾小管间质的纤维化程度>25%可作为判断FSGS患者预后的独立危险因素。

表1 局灶节段性肾小球硬化哥伦比亚病理分型[2]
电镜电镜技术的发展加深了对FSGS发病机制的认识。电镜研究发现,足细胞受损导致了FSGS的病情发展。Taneda等[6]观察了43例FSGS患者的肾脏超显微结构,发现电镜下出现足突融合、足细胞与基膜剥离及内皮下间隙增宽均提示不良预后,这些病变提示FSGS病情的严重性及病程较长,患者的肾小球滤过率(GFR)及缓解率均很低。对激素治疗呈无反应性的患者的内皮下间隙增宽的基膜长度占基膜全长的19.6%,而在完全缓解的患者中仅为0.7%。
临床表现
血清肌酐和GFR Paik等[7]通过多变量的分析提出肾活检时的血清肌酐升高的程度与FSGS预后密切相关,血清肌酐可以作为FSGS的独立危险因素。Gipson等[8]回顾性研究了78例慢性起病FSGS患者的基线GFR水平,发现最终完全缓解的患者基线GFR平均值为94 ml/(min·1.73m3);部分缓解的患者基线GFR平均值为91 ml/(min·1.73m3);不缓解的患者基线GFR平均值为67.6 ml/(min·1.73m3),提示GFR可作为判断FSGS患者预后的线索。
尿液生物标志物蛋白尿不仅是反映肾损害的标志,也是导致肾脏病变发展的独立因素。控制蛋白尿是防止肾功能进一步恶化的关键,FSGS患者的蛋白尿水平将与其预后有着密不可分的关系。Velosa等[9]的一项研究显示,24h尿蛋白>14 g是FSGS患者不良预后的重要危险因素,这些患者在3~6年内均进展为ESRD。Gipson等[8]对78例FSGS患者的回顾性研究也显示尿蛋白水平低的患者趋向于完全缓解而尿蛋白水平高的患者趋向于不缓解,其中完全缓解组的平均尿蛋白定量为4.3 g/24h,而不缓解组的平均尿蛋白定量为7.7 g/24h。Kalantari等[10]选取了11位经肾活检确诊为FSGS的患者,根据基线GFR是否>60 ml/(min·1.73m3)分为两组,对尿液中的12种蛋白质进行了检测,通过对检测数据及患者预后的综合分析后发现,RNAS2及HPT两种蛋白质对于FSGS患者的预后有较为明确的提示意义,与GFR>60 ml/(min·1.73m3)组相比,GFR<60 ml/(min·1.73m3)组的RNAS2显著升高而HPT显著降低,同时这些患者的预后也较差。Kalavrizioti等[11]研究发现,尿液中出现细胞因子MCP-1和TGF-β1表明肾脏存在炎症和纤维化病变,提示预后不良。Bazzi的回顾性研究中,将38例患者分为完全缓解组与ESRD组,对于近十种生物标志物进行统计分析,发现尿IgG排泄率与尿α2微球蛋白的数值在ESRD组中高于完全缓解组,研究者认为以上两项结果可作为FSGS患者的预后及对药物治疗反应性的预测指标。其中尿IgG排泄率可作为完全缓解的预测因素(HR 5.5),因为可敏感反映患者对治疗的反应性,而尿α2微球蛋白升高可作为患者进展为ESRD的预测指标(HR 16)[12]。
循环渗透因子许多研究认为部分FSGS患者起病是由于循环渗透因子损害足细胞,目前发现的与FSGS致病相关的循环渗透因子主要有可溶性尿激酶受体(suPAR)、心肌营养素样细胞因子(CLC-1)及CD40抗体。这些循环渗透因子不仅在FSGS起病中发挥作用,同时也是导致原发性FSGS肾脏移植术后复发及治疗缓解后复发的重要因素,原因可能是经移植或治疗达到缓解后,循环渗透因子继续对肾脏足细胞造成损害进而导致复发[13]。Wei等[14]报道,suPAR是溶酶原激活因子受体的可溶性形式, suPAR蛋白的分子大小20~50 kD,可通过ELISA对患者血清标本进行检测。在实验研究中,由过表达suPAR的转基因小鼠成功诱导了FSGS病变。suPAR和β3整合素相互作用,使足细胞结构发生改变,从而破坏肾小球滤过屏障的功能。另外,CLC-1也被认为是与FSGS相关的循环渗透因子,并与FSGS患者肾移植术后及治疗缓解后的复发有着紧密联系。研究显示存在CLC-1的FSGS患者复发的概率是正常人的100倍[15]。Delville等[16]在20例FSGS患者肾移植前对其血清标本进行了ELISA检测,其中10例患者在1年内发生了复发性FSGS, 10例患者在1年内未发生FSGS,通过对检测数据的分析比较发现,存在CD40抗体与肾移植后是否复发FSGS具有最强的关联性和预判性(准确度78%)。综上所述,循环渗透因子对于患者预后有着较强的提示作用,对于血清中存在循环渗透因子的患者,在经治疗达到缓解后也应该保持密切随访,监测疾病是否复发。同时由于这些患者在肾移植后复发的概率很高,应谨慎选择肾移植作为替代治疗。
基因层面
基因检测原发性FSGS患者的预后与遗传变异方面的关系在近年来的研究中逐渐被揭示。Hao等[17]进行的一项观察性研究,在大量FSGS患者中进行筛选,设立了家族性FSGS组和散发性FSGS组,每组各124例,两组之间的性别、年龄均无显著差异。在病理检查中发现,家族性FSGS患者的肾小球及肾小管损伤都较散发性FSGS患者更加严重。在长时间的随访中发现家族性FSGS患者在部分缓解率(23.08%vs48.39%)及进展为ESRD的时间(72月vs96月)均低于散发性FSGS患者,家族性FSGS患者对于治疗的反应性以及预后都较散发性FSGS患者差。
近年来,许多与FSGS预后相关的基因位点突变被发现。2015年英国研究团队对81例成人激素抵抗型肾病综合征(SRNS)的FSGS患者进行基因检测,检测范围覆盖39个基因,发现COL4A 3~5突变是最常见的致病突变位点,占致病性基因突变的67%,突变位点为2q35-q37。且被诊断为COL4突变患者多伴家族史、基膜异常和发病年龄更早[18]。另一项研究显示COL4A3突变多见于中国和高加索人种的FSGS家系中,检出率为12.5%,且这些患者的预后都较差,一方面Ⅳ型胶原缺乏会导致足细胞与基膜分离;另一方面,COL4A3突变的患者对于激素治疗的反应性差[19]。 INF2基因突变可通过多条通路的共同作用,最终破坏足细胞骨架的正常结构及足细胞特异性相关蛋白的表达而致病,该基因突变在欧洲FSGS家系中检出率较高,达到10%~16%,而在我国的检出率为3.6%[20-21]。目前所检测出的基因突变位点为2、3、4号外显子。法国的研究小组对78例家族性FSGS患者进行了检测,26例患者检测出INF2基因突变,其中有18例患者发生ESRD,平均发病年龄36岁,INF2基因突变的患者ESRD的发生率高于未检测出该突变的FSGS患者(70%vs47%)[20]。NPHS2突变在近年来的研究中被证明与FSGS患者的激素抵抗相关,该基因编码的是位于足细胞上的结构蛋白podocin。该基因突变在欧洲FSGS家系中检出率为4%~24%。而在亚洲检出率为3.33%[22]。Ramanathan等[23]发现部分SRNS患者存在NPHS2基因突变,大多患者NPHS2突变集中在1、5、8号外显子上,突变位点为P20L、P316S和p.R229Q。杜克大学研究者对19个早发型FSGS/SRNS家系进行基因检测发现,其中两个家系存在NPHS2 p.R229Q位点的突变,其中1个孩子4岁发病,2个孩子13岁发病,且均病程进展迅速,对激素治疗呈无反应性。研究结果提示p.R229Q突变的FSGS患者发病年龄早,病情进展迅速且伴激素抵抗[24]。在一项针对78例FSGS /SRNS患者的基因检测中发现PLCE1基因突变的患者易发生弥漫性系膜硬化且在FSGS/SRNS患者中占较大的比例,该基因突变位点主要位于10q23,33[25]。WT-1基因突变与肾母细胞瘤的发病有关,同时也会导致FSGS,且这些患者多数对激素及免疫抑制剂治疗呈无反应性。该基因在中国SRNS患儿中的检出率为5.83%[22]。根据突变位点的不同,表现为Denys-Drash综合征和Frasier综合征,两者都与泌尿生殖系统的肿瘤、足细胞损伤、SRNS有关,不同的是前者往往在儿童期就进展为ESRD,而后者多在青春期进展为ESRD[26]。目前发现与CoQ10合成相关的基因有COQ2、COQ6、ADCK4、PDSS2,这些基因突变的FSGS患者在不补充CoQ10的情况下会呈持续性的SRNS且在青春期病情进展快速。1例5岁持续性FSGS/SRNS女孩被检测出COQ6基因突变后,给予补充CoQ10后达到完全缓解且尿蛋白水平降至发病以来的最低值[27]。有研究对534例FSGS患儿中进行基因检测,ADCK4检出率为1.9%,该基因在中国SRNS患儿中的检出率为6.67%。目前发现的突变位点有c.645delT,c.1199-1200dupA和c.532C>T。这些患儿往往伴随大量蛋白尿,在青春期病情进展速度较WT-1及NPHS2突变的FSGS患者更快,在十年内即进展为ESRD[22,28]。
在发现患者对于激素治疗不敏感时可考虑进行基因检测,基因检测不仅有助于了解FSGS/SRNS的发病机制,更能帮助临床医师及时调整治疗方案,避免不必要的长期使用激素和免疫抑制剂。
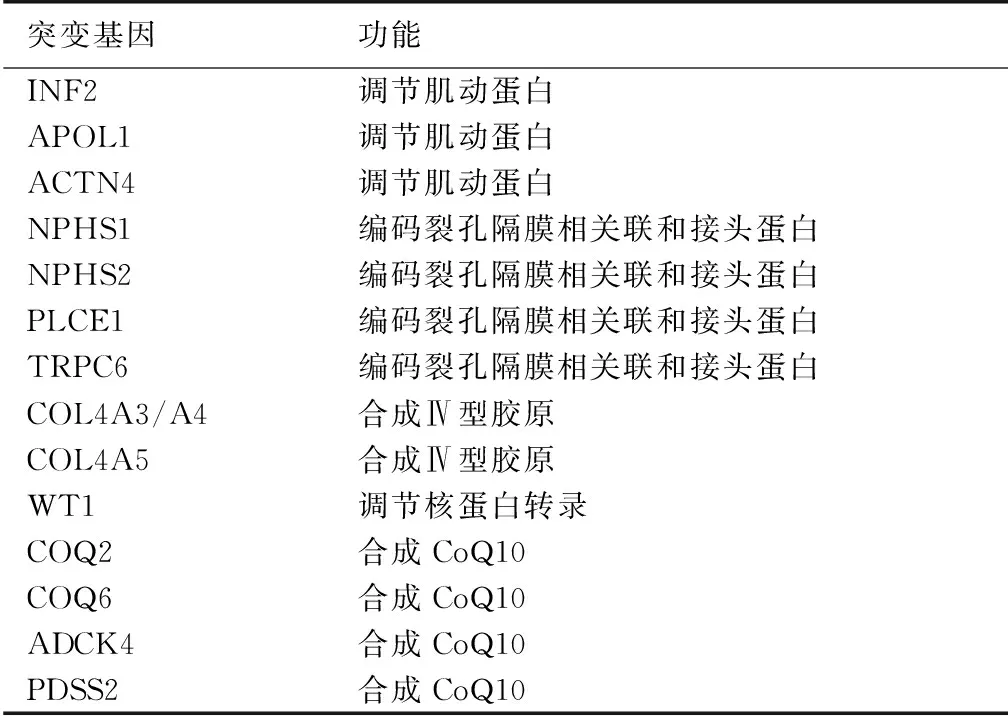
表2 FSGS/SRNS相关的基因突变
FSGS:局灶节段性肾小球硬化;SRNS:激素抵抗性肾病综合征
微小RNA (miRNA) miRNA是一类内生的、长度约为20~24个核苷酸的小RNA,其在细胞内具有多种重要的调节作用,大量研究结果提示miRNA可作为生物标志物对FSGS患者的预后进行判断。研究显示,尿液中miRNA10-a和miRNA-30d这两个miRNA表达上升提示肾小球的滤过屏障已经受到较大的损伤[29]。血清中miRNA-192升高不仅可用于鉴别微小病变和FSGS,其升高程度还与肾小管纤维化程度有关,与预后紧密相关[30]。Zhang等[31]比较了活动性FSGS患者与完全缓解的FSGS患者尿液中54个候选miRNA,发现miR-196a、miR-30a-5p和miR-490在活动性FSGS组尿液中水平要显著高于完全缓解组。该研究结果提示以上三个miRNA可作为预测患者对激素治疗反应性的生物标志物[31]。
治疗层面
患者对于治疗的反应性是决定其预后最重要的因素之一。将FSGS患者对于治疗呈无反应性作为FSGS预后相关的独立危险因素已被国内外的学者广泛接受,甚至有人提出将患者对于治疗的反应性作为判断FSGS预后的最佳标准。研究表明患者对于治疗有/无反应将决定其完全不同的预后,对于治疗有着良好反应的患者倾向于完全缓解,而对于治疗无反应的患者则倾向于发展为ESRD[32]。该研究对81例原发性FSGS患者进行了回顾性研究,分为激素敏感组和激素抵抗组,结果显示对于激素治疗敏感的患者无一例进展为ESRD,而激素抵抗的FSGS患者有40%进展为ESRD。有研究表明部分对治疗无反应的患者可能是由于治疗不够充分,当将疗程增至5~8月时,对治疗呈无反应性的患者比例大大降低,而达到完全缓解者比例大大提升[33]。另外对激素治疗敏感的患者有50%会在减药或停药时复发,包括频繁复发肾病综合征(FRNS)及激素依赖型肾病综合征(SDNS),对于这些患者长期应用激素会导致肥胖、高血压、糖尿病、骨质疏松、白内障等副作用,尽管可在激素基础上加用一些免疫抑制剂(如环磷酰胺、环孢素等),但是免疫抑制剂同时会带来更严重的毒副作用,且有研究报道,这些患者在激素基础上加用环磷酰胺后2年及5年缓解率仍不理想,FRNS缓解率分别为72%和36%,SDNS缓解率分别为40%和24%[34-35]。这些临床上表现为激素抵抗或是激素依赖的患者往往提示预后不良。
小结:大量与FSGS预后相关的因素已经被临床广泛关注,给FSGS的诊断、治疗和预后判断带来了巨大的帮助和参考价值。期望有更多能在早期判断FSGS预后的因素被发现并应用到临床中,定会给FSGS的诊治带来积极的帮助,同时也会给患者带来更好的预后。
1 Korbet SM.Clinical picture and outcome of primary focal segmental glomerulosclerosis.Nephrol Dial Transplant,1999,14(Suppl 3):68-73.
2 D′Agati VD,Fogo AB,Bruijn JA,et al.Pathologic classification of focal segmental glomerulosclerosis:a working proposal.Am J Kidney Dis,2004,43(2):368-382.
3 Swarnalatha G,Ram R,Ismal KM,et al.Focal and segmental glomerulosclerosis:does prognosis vary with the variants?Saudi J Kidney Dis Transpl,2015,26(1):173-181.
4 D′Agati VD,Alster JM,Jennette JC,et al.Association of histologic variants in FSGS clinical trial with presenting features and outcomes.Clin J Am Soc Nephrol,2013,8(3):399-406.
5 Ren H,Shen P,Li X,et al.Treatment and prognosis of primary focal segmental glomerulosclerosis.Contrib Nephrol,2013,181:109-118.
6 Taneda S,Honda K,Ohno M,et al.Podocyte and endothelial injury in focal segmental glomerulosclerosis:an ultrastructural analysis.Virchows Arch,2015,467(4):449-458.
7 Paik KH,Lee BH,Cho HY,et al.Primary focal segmental glomerular sclerosis in children:clinical course and prognosis.Pediatr Nephrol,2007,22(3):389-395.
8 Gipson DS,Chin H,Presler TP,et al.Differential risk of remission and ESRD in childhood FSGS.Pediatr Nephrol,2006,21(3):344-349.
9 Velosa JA,Holley KE,Torres VE,et al.Significance of proteinuria on the outcome of renal function in patients with focal segmental glomerulosclerosis.Mayo Clin Proc, 1983,58(9):568-577.
10 Kalantari S,Nafar M,Samavat S,et al.Urinary prognostic biomarkers in patients with focal segmental glomerulosclerosis.Nephrourol Mon,2014,6(2):e16806.
11 Kalavrizioti D,Gerolymos M,Rodi M,et al.T helper (Th)-cytokines in the urine of patients with primary glomerulonephritis treated with immunosuppressive drugs:Can they predict outcome? Cytokine,2015,76(2):260-269.
12 Bazzi C,Rizza V,Casellato D,et al.Urinary IgG and α2-macroglobulin are powerful predictors of outcome and responsiveness to steroids and cyclophosphamide in idiopathic focal segmental glomerulosclerosis with nephrotic syndrome.Biomed Res Int,2013,2013:941831.
13 Wada T,Nangaku M.A circulating permeability factor in focal segmental glomerulosclerosis:the hunt continues.Clin Kidney J,2015,8(6):708-715.
14 Wei C,Sigdel TK,Sarwal MM,et al.Circulating CD40 autoantibody and suPAR synergy drives glomerular injury.Ann Transl Med,2015,3(19):300.
15 Savin VJ,McCarthy ET,Sharma M.Permeability factors in nephrotic syndrome and focal segmental glomerulosclerosis.Kidney Res Clin Pract,2012,31(4):205-213.
16 Delville M,Sigdel TK,Wei C,et al.A circulating antibody panel for pretransplant prediction of FSGS recurrence after kidney transplantation.Sci Transl Med,2014,6(256):256ra136.
17 Hao X,Xie J,Ma J,et al.Increased risk of treatment failure and end-stage renal disease in familial focal segmental glomerular sclerosis.Contrib Nephrol,2013,181:101-108.
18 Gast C,Pengelly RJ,Lyon M,et al.Collagen (COL4A) mutations are the most frequent mutations underlying adult focal segmental glomerulosclerosis.Nephrol Dial Transplant,2016,31(6):961-970.
19 Xie J,Wu X,Ren H,et al.COL4A3 mutations cause focal segmental glomerulosclerosis.J Mol Cell Biol,2014,6(6):498-505.
20 Boyer O,Benoit G,Gribouval O,et al.Mutations in INF2 are a major cause of autosomal dominant focal segmental glomerulosclerosis.J Am Soc Nephrol,2011,22(2):239-245.
21 Xie J,Hao X,Azeloglu EU,et al.Novel mutations in the inverted formin 2 gene of Chinese families contribute to focal segmental glomerulosclerosis.Kidney Int,2015,88(3):593-604.
22 Wang F,Zhang Y,Mao J,et al.Spectrum of mutations in Chinese children with steroid-resistant nephrotic syndrome.Pediatr Nephrol,2017,32(7):1181-1192.
23 Ramanathan AS,Vijayan M,Rajagopal S,et al.WT1 and NPHS2 gene mutation analysis and clinical management of steroid-resistant nephrotic syndrome.Mol Cell Biochem,2017,426(1-2):177-181.
24 Phelan PJ,Hall G,Wigfall D,et al.Variability in phenotype induced by the podocin variant R229Q plus a single pathogenic mutation.Clin Kidney J,2015,8(5):538-542.
25 Boyer O,Benoit G,Gribouval O,et al.Mutational analysis of the PLCE1 gene in steroid resistant nephrotic syndrome.J Med Genet,2010,47(7):445-452.
26 Miller-Hodges E.Clinical Aspects of WT1 and the Kidney.Methods Mol Biol,2016,1467:15-21.
27 Gonzalez-Villalobos RA,Janjoulia T,Fletcher NK,et al.The absence of intrarenal ACE protects against hypertension.J Clin Invest,2013,123(5):2011-2023.
28 Korkmaz E,Lipska-Ziętkiewicz BS,Boyer O,et al.ADCK4-Associated Glomerulopathy Causes Adolescence-Onset FSGS.J Am Soc Nephrol,2016,27(1):63-68.
29 Wang N,Zhou Y,Jiang L,et al.Urinary microRNA-10a and microRNA-30d serve as novel,sensitive and specific biomarkers for kidney injury.PLoS One,2012,7(12):e51140.
30 Cai X,Xia Z,Zhang C,et al.Serum microRNAs levels in primary focal segmental glomerulosclerosis.Pediatr Nephrol,2013,28(9):1797-1801.
31 Zhang W,Zhang C,Chen H,et al.Evaluation of microRNAs miR-196a,miR-30a-5P,and miR-490 as biomarkers of disease activity among patients with FSGS.Clin J Am Soc Nephrol,2014,9(9):1545-1552.
32 Rydel JJ,Korbet SM,Borok RZ,et al.Focal segmental glomerular sclerosis in adults:presentation,cours,and response to treatment.Am J kidney Dis,1995,25(4):534-542.
33 Is there a need for more precise definitions of bioavailability? Conclusions of a consensus workshop,Munich,September 9,1989; under the patronage of the F.I.P.Eur J Clin Pharmacol,1991,40(2):123-126.
34 Hodson EM,Willis NS,Craig JC.Non-corticosteroid treatment for nephrotic syndrome in children.Cochrane Database Syst Rev,2008,(1):CD002290.
35 Kamei K1,Ogura M1,Sato M1,et al.Risk factors for relapse and long-term outcome in steroid-dependent nephrotic syndrometreated with rituximab.Pediatr Nephrol,2016,31(1):89-95.

