利妥昔单抗在特发性膜性肾病治疗中的应用
陈梦星 张丽华 综述 刘志红 审校
特发性膜性肾病(IMN)是以肾小球基膜上皮细胞侧免疫复合物沉积伴基膜增厚为特征的一组疾病,是成人肾病综合征的最主要原因,其自然病程差异较大,表现为自发缓解、持续蛋白尿伴肾功能稳定和逐渐进入终末期肾病三种转归形式[1]。近年来,随着抗磷脂酶A2受体抗体(PLA2R-Ab)和抗血小板反应蛋白7A域抗体(THSD7A-Ab)的发现,IMN已被视为器官特异性自身免疫性疾病,其主要发病机制为T细胞分泌白介素等多种细胞因子刺激B细胞增殖活化,B细胞介导分泌抗体结合足细胞表面抗原PLA2R和THSD7A,形成免疫复合物沉积于肾小球上皮细胞下,损伤滤过屏障,引发蛋白尿[2]。这一突破性发现为利妥昔单抗(RTX)治疗IMN提供了有力的理论依据。RTX作为B细胞表面CD20的单克隆抗体,可有效清除B细胞,阻断抗体的产生,干扰IMN的发病机制。2002年之后,陆续有 RTX治疗IMN的报道,多数研究结果显示其疗效肯定、安全性佳,在临床上有较好的应用前景,现就其治疗IMN的作用机制、临床疗效、疗效监测及安全性作一综述。
作用机制
CD20是B细胞表面特异性标记,表达于早期及成熟阶段B细胞,不包括前体B细胞和浆细胞,通过参与组成钙离子通道对B细胞分化和成熟进行调控[3]。RTX是针对CD20的单克隆抗体,与B细胞表面CD20高度结合,通过抗体或补体依赖的细胞毒作用、抗增殖效应或诱导凋亡等机制,清除CD20+B细胞,抑制致病抗体生成[4]。近年来研究发现RTX在一些自身免疫性疾病中通过清除B细胞,阻断B细胞与T细胞的相互作用或消耗CD20弱表达的T细胞等机制,间接或直接调节T细胞亚群稳态和功能,显著减少CD4+T细胞、抑制Th17反应并恢复调节性T(Treg)细胞的比例和功能[5,6]。此外RTX可直接识别结合和足细胞表面的特异性蛋白质酸性鞘磷脂酶样磷酸二酯酶3b(SMPDL-3b),预防患者血清诱导SMPDL-3b水平下调,保护足细胞肌动蛋白骨架及活力并防止足细胞凋亡,降低蛋白尿[7]。
临床疗效
2002年Remuzzi等[8-9]首次报道RTX治疗8例保守治疗6个月无效的IMN患者,给药方案:RTX 375 mg/m2,每周1次,连续4次(标准四剂量)。随访1年,完全缓解(CR)2例,部分缓解(PR)3例。截止2007年1月,该团队总计收治了50例RTX治疗的IMN患者,10例CR,其中7例重复肾活检,对比观察显示RTX治疗后总IgG免疫荧光染色不变,IgG4和C3显著减少或消失,上皮下免疫复合物沉积几乎消失,足细胞损伤部分恢复,裂孔数目增加,肾脏亚微结构改善,可见RTX能逆转肾脏病理过程,延缓疾病进展[10]。此外,该团队还对RTX的给药方案进行匹配队列研究,12例新收治的IMN患者予B细胞滴定治疗:RTX(375 mg/m2)×1剂,1周后监测外周血CD20+B细胞,如果>5个/mm3时,再予1剂治疗,并与既往接受标准四剂量治疗的24例进行匹配对比,结果发现两种方案的缓解率(CR 17%vs8%;PR 50%vs58%)和复发风险无差异,且B细胞滴定治疗安全性更好、费用更低[11]。
2008年Fervenza等[12]报道了另一种小剂量RTX 给药方案(1g,每2周1次,连续2次)治疗15例IMN,2例CR、6例PR、1例失访。2010年该团队又采用RTX(标准四剂量)治疗20例IMN,2例CR、12例PR、2例失访。尽管标准四剂量方案清除B细胞更为有效,但两者的血药浓度、缓解率及安全性均相当,且小剂量方案治疗费用低[13]。
2012年Ruggenent等[14]报道了首个大规模前瞻性队列研究,100例IMN患者,RTX给药方案:2005年10月之前采用标准四剂量,之后B细胞滴定治疗方案。中位随访时间29月,缓解率65%,中位缓解时间7.1月,随访满4年的患者24例均缓解,未缓解的患者中20例尿蛋白减少>50%。18例缓解后复发,再予RTX治疗后,4例CR、7例PR。研究还显示无论先前是否使用免疫抑制剂治疗,无论何种给药方案,患者的缓解率没有显著统计学差异。
2016年RTX治疗IMN的第一个多中心、随机对照试验(RCT)结果发表,提示RTX有望成为IMN的新一线治疗方案[15]。该试验将6个月保守治疗无效的IMN患者随机分为RTX(375 mg/m2,每周1次,连续2次)联合非免疫抑制剂治疗组(试验组)和非免疫抑制剂治疗组(对照组),第6月试验组与对照组缓解率分别为35.1%和21.1%,差异无统计学意义,但延长试验观察期至17月发现,试验组的缓解率明显高于对照组(64.8%vs34.2%,P=0.03)。
2017年国内Wang等[16]首次报道RTX(15例标准四剂量,21例B细胞滴定治疗)治疗难治性IMN的前瞻性研究。36例多种免疫抑制剂治疗无效的患者,平均肌酐2 mg/dl,随访1年,2例CR、13例PR,平均缓解时间4月,2例复发,其中1例予RTX联合他克莫司再治疗后迅速PR,患者肾功能稳定。
RTX单药治疗IMN疗效肯定,但临床见效慢,CR率相对偏低,因此近年有学者开始尝试RTX联合免疫抑制剂治疗IMN。Waldman等[17]采用RTX联合环孢素A治疗13例保守治疗无效的IMN。治疗后第3和第6个月平均尿蛋白分别下降65%和80%,第9个月92%缓解,第12个月54% CR。Cortazar等[18]报道RTX联合小剂量环磷酰胺和激素治疗15例IMN患者,其中7例首次接受免疫抑制治疗,8例为难治性IMN,100%的患者达PR,中位时间2月;93%CR,中位时间13月。
由此可见(表1),RTX治疗IMN疗效显著,相比单药治疗,联合免疫抑制剂缓解更快,缓解率尤其是CR率更高,复发率更低,这为IMN的临床治疗提供了新的思路及选择。多数研究显示两种主流给药方案(标准四剂量和B细胞滴定治疗)的疗效未见统计学差异,但后者节约了至少1/2的治疗费用。不容忽视的是,现有的研究多为小样本量的观察性研究,缓解率波动较大,而相对大样本研究与RCT研究缓解率约65%,仍有35%患者无效。有学者考虑无效原因如下[2]:(1)部分患者存在严重的不可逆的慢性肾损害;(2)体内长寿命浆细胞持续分泌IMN的致病抗体,RTX无法阻断抗体的产生;(3)自身反应性B细胞CD20抗原结构的改变,RTX无法与特定的位点结合,导致尽管外周循环B细胞耗竭,但致病抗体持续阳性。后两类患者可尝试针对长寿命浆细胞治疗或更换新一代CD20单克隆抗体。
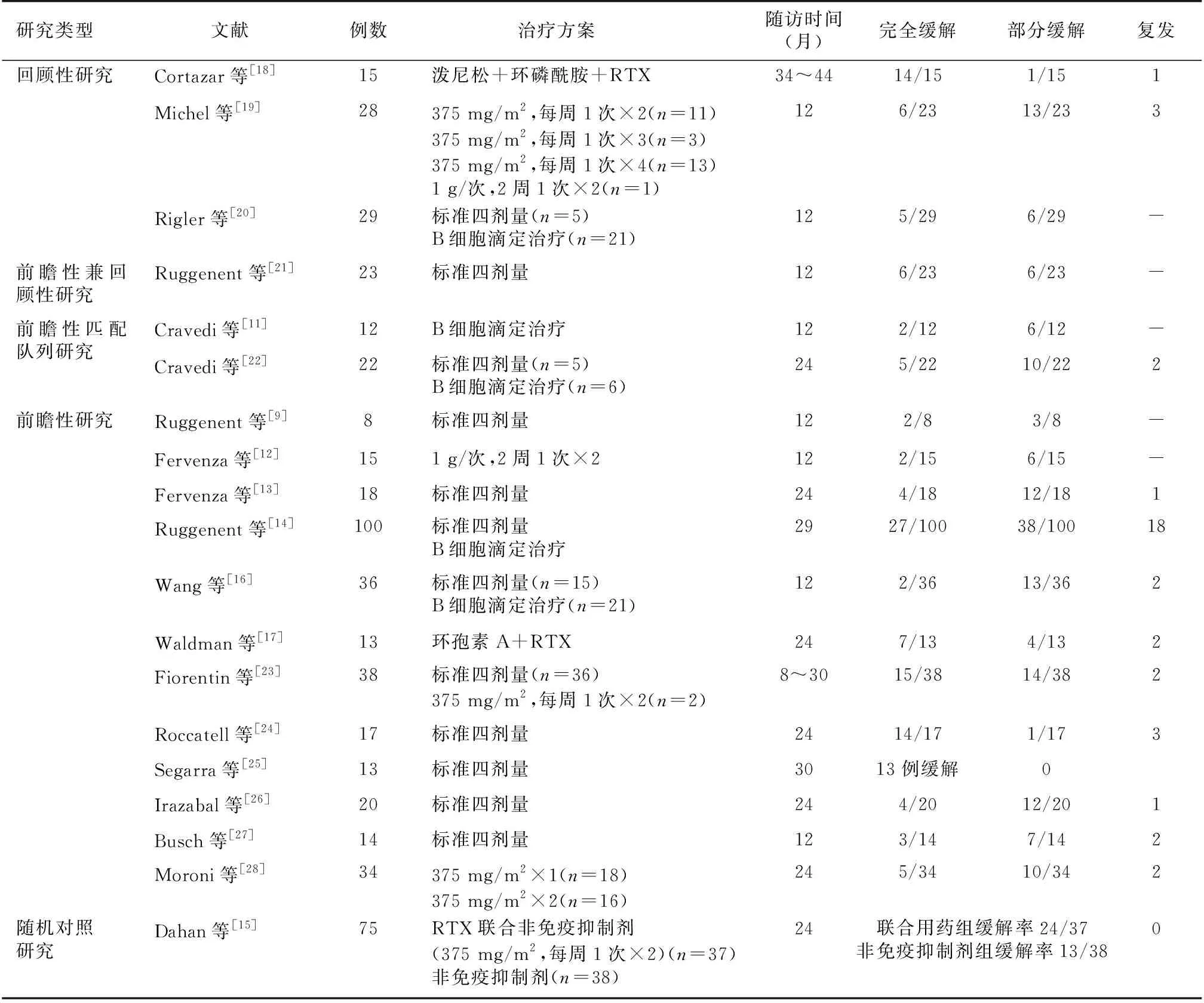
表1 RTX治疗IMN的主要临床试验及其疗效
RTX:利妥昔单抗;IMN:特发性膜性肾病;标准四剂量:RTX 375 mg/m2,每周1次,连续4次;B细胞滴定治疗:375 mg/m2×1剂,1周后监测外周血CD20+B淋巴细胞,如果>5 个/mm3时,再予1剂RTX治疗
疗效监测
抗PLA2R-Ab、PLA2R抗原表位多项研究发现抗PLA2R-Ab水平与IMN病情和活动度相关,自发或经RTX治疗缓解的患者血清抗PLA2R-Ab转阴或滴度下降,当抗体转阳或升高时,疾病复发,且抗体的变化早于蛋白尿的变化[15-16,29]。Ruggenenti等[30]研究显示抗PLA2R-Ab可预测RTX治疗IMN的疗效。基线抗体滴度越低,缓解率越高,RTX治疗6个月后抗PLA2R-Ab转阴率为71.9%,抗体转阴者缓解率明显高于抗体未转阴者(89.1%vs11.1%,P<0.001),抗体转阴早于临床缓解2.66个月,25例CR患者抗体均转阴,治疗过程中抗体滴度再次升高,则高度提示3个月后疾病复发。由此可见,监测抗PLA2R-Ab变化有助于动态掌握患者肾脏免疫炎症活动情况,评估疗效,指导RTX临床用药。
近期研究发现PLA2R抗原包含半胱氨酸富含域(CysR)、纤维连接蛋白样Ⅱ型结构域和8个C型凝集素样结构域(CTLD)[31]。CysR结构域可能是PLA2R的优势表位,抗PLA2R-Ab活性局限于CysR表位的患者年龄更小,尿蛋白更低,自发缓解率更高,肾功能减退更慢,而向CTLD1和CTLD7结构域的表位扩展者抗PLA2R-Ab滴度更高、预后更差。PLA2R抗原表位扩展是IMN缓解率的独立预测因素,RTX可有效逆转表位扩展,因此研究者建议存在显著表位扩展者应尽早行RTX治疗。
血清白蛋白Dahan等[15]观察到RTX治疗IMN中患者血清白蛋白升高早于尿蛋白降低,推测RTX在改善滤过屏障,降低尿蛋白的同时可促进肝脏合成白蛋白或抑制近端肾小管重吸收白蛋白。血清白蛋白可能是临床反应的早期预测因子,尤其针对抗PLA2R-Ab抗体阴性的IMN。
B细胞IMN患者予以第1剂RTX治疗后外周血B细胞完全被清除,第3个月开始恢复,6~11个月恢复至正常范围[14,23]。尽管RTX主要机制是清除B细胞,但现有文献报道RTX治疗IMN缓解者和无效者的B细胞数并无显著区别,考虑监测的CD20+B细胞仅能反映循环B细胞的总数,并非自身反应性B细胞的异常扩增,所以不能单纯以循环CD20+B细胞作为判断IMN预后的生物学指标[30]。
Treg细胞Treg细胞由一类起负性调节作用的CD4+CD25+T细胞组成,可抑制自身反应性T细胞的活性和维持免疫耐受,此功能受损可直接导致自身免疫性疾病。IMN作为器官特异性自身免疫性疾病,在Treg细胞方面研究报道较少。早期研究发现编码Treg发育及功能的转录因子FOXP3的相关基因突变可导致IMN的发生[5]。Roccatello等[24]统计发现RTX治疗缓解患者的Treg细胞比例12个月后可升至基线值的10倍,而无效者无明显变化。Rosenzwajg等[5]报道与健康人群相比,IMN患者基线Treg细胞绝对数目相当,但在CD4+T细胞所占比例明显下降,且RTX治疗缓解者基线Treg细胞绝对数及比例均低于无效者,治疗后第8天缓解者Treg细胞比例即明显升高,而无效者Treg细胞绝对数目及比例无明显变化,Treg细胞的变化与B细胞相关,与尿蛋白、血清白蛋白、抗PLA2R-Ab等无相关性。可见Treg细胞数目及比例增加仅存在于RTX治疗有效的患者,且Treg的升高早于抗PLA2R-Ab转阴,或许可作为RTX治疗IMN疗效的早期预测指标。
安全性
RTX常见的不良事件主要有感染和输液反应两大类(表2),前者可予以抗生素处理,后者通常中断输液或注射甲泼尼龙,治疗前也可予激素及抗组胺药预防,对症处理后预后通常良好。尽管RTX说明书携有黑色警告,如24 h内致命的输液反应,严重的皮肤黏膜反应,乙肝病毒再激活和进行性多灶性脑白质病变等,但已有多项RCT显示RTX治疗自身免疫性疾病具有良好的耐受性和安全性[32]。Brand团队回顾性分析100例RTX与103例激素联合环磷酰胺治疗IMN的安全性,发现RTX安全性更佳,严重不良事件和一般不良事件发生率均较低[2]。值得一提的是,RTX可有效缓解患者肾病综合征状态,摆脱激素及免疫抑制剂的依赖性,改善患者生活质量。目前RTX治疗IMN的临床试验,随访时间较短,不能排除远期不良事件尤其恶性肿瘤的可能,但在一些自身免疫性疾病或淋巴瘤的长年随访中,相比其他免疫抑制剂其治疗剂量更大,时间更长,安全性更佳[32]。
表2利妥昔单抗在自身免疫性疾病中常见的不良事件[14,33-35]

常见不良事件临床表现输液反应寒战、发热、瘙痒、面色潮红、皮疹、咽部不适、疲劳、支气管痉挛、喘鸣、喉头水肿、血管神经性水肿感染上呼吸道感染、支气管炎、肺炎、尿路感染、水痘、带状疱疹血液系统中性粒细胞减少、淋巴细胞减少、低丙种球蛋白血症、血小板减少、全血细胞减少消化系统消化不良、腹泻、腹痛、恶心、胃食管反流、口腔溃疡、肝毒性心血管系统低血压、高血压、心律失常精神和神经系统头痛、头晕、感觉异常骨骼和肌肉系统骨关节炎其他脱发、血糖升高、血清病样反应
小结:RTX通过清除CD20+B细胞、增加Treg细胞及亚群稳态、保护足细胞等机制,达到降低蛋白尿、治疗IMN的作用,其临床疗效显著,安全性佳,为IMN患者提供了新的治疗选择。在治疗过程中可监测抗PLA2R-Ab等指标,有助于预测疗效及复发,优化RTX的用药方案。
1 Ponticelli C,Glassock RJ.Glomerular diseases:membranous nephropathy--a modern view.Clin J Am Soc Nephrol,2014,9(3):609-616.
2 Ruggenenti P,Fervenza FC,Remuzzi G.Treatment of membranous nephropathy:time for a paradigm shift.Nat Rev Nephrol,2017,13(9):563-579.
3 Kuroki A,Iyoda M,Shibata T,et al.Th2 cytokines increase and stimulate B cells to produce IgG4 in idiopathic membranous nephropathy.Kidney Int,2005,68(1):302-310.
4 Reff ME,Carner K,Chambers KS,et al.Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20.Blood,1994,83(2):435-445.
5 Rosenzwajg M,Languille E,Debiec H,et al.B- and T-cell subpopulations in patients with severe idiopathic membranous nephropathy may predict an early response to rituximab.Kidney Int,2017,92(1):227-237.
6 Colucci M,Corpetti G,Emma F,et al.Immunology of idiopathic nephrotic syndrome.Pediatr Nephrol,2018,33(4):573-584.
7 Fornoni A,Sageshima J,Wei C,et al.Rituximab targets podocytes in recurrent focal segmental glomerulosclerosis.Sci Transl Med,2011,3(85):85ra46.
8 Remuzzi G,Chiurchiu C,Abbate M,et al.Rituximab for idiopathic membranous nephropathy.Lancet,2002,360(9337):923-924.
9 Ruggenenti P,Chiurchiu C,Brusegan V,et al.Rituximab in idiopathic membranous nephropathy:a one-year prospective study.J Am Soc Nephrol,2003,14(7):1851-1857.
10 Ruggenenti P,Cravedi P,Sghirlanzoni MC,et al.Effects of rituximab on morphofunctional abnormalities of membranous glomerulopathy.Clin J Am Soc Nephrol,2008,3(6):1652-1659.
11 Cravedi P,Ruggenenti P,Sghirlanzoni MC,et al.Titrating rituximab to circulating B cells to optimize lymphocytolytic therapy in idiopathic membranous nephropathy.Clin J Am Soc Nephrol,2007,2(5):932-937.
12 Fervenza FC,Cosio FG,Erickson SB,et al.Rituximab treatment of idiopathic membranous nephropathy.Kidney Int,2008,73(1):117-125.
13 Fervenza FC,Abraham RS,Erickson SB,et al.Rituximab therapy in idiopathic membranous nephropathy:a 2-year study.Clin J Am Soc Nephrol,2010,5(12):2188-2198.
14 Ruggenenti P,Cravedi P,Chianca A,et al.Rituximab in idiopathic membranous nephropathy.J Am Soc Nephrol,2012,23(8):1416-1425.
15 Dahan K,Debiec H,Plaisier E,et al.Rituximab for Severe Membranous Nephropathy:A 6-Month Trial with Extended Follow-Up.J Am Soc Nephrol,2017,28(1):348-358.
16 Wang X,Cui Z,Zhang YM,et al.Rituximab for non-responsive idiopathic membranous nephropathy in a Chinese cohort.Nephrol Dial Transplant,2017, Nov 14.
17 Waldman M,Beck LH,Braun M,et al.Membranous nephropathy:Pilot study of a novel regimen combining cyclosporine and Rituximab.Kidney Int Rep,2016,1(2):73-84.
18 Cortazar FB,Leaf DE,Owens CT,et al.Combination therapy with rituximab,low-dose cyclophosphamide,and prednisone for idiopathic membranous nephropathy:a case series.BMC Nephrol,2017,18(1):44.
19 Michel PA,Dahan K,Ancel PY,et al.Rituximab treatment for membranous nephropathy:a French clinical and serological retrospective study of 28 patients.Nephron Extra,2011,1(1):251-261.
20 Aleš RA,Jerman A,Orsag A,et al.Rituximab for the treatment of membranous nephropathy:a single-center experience.Clin Nephrol,2017,88(13):27-31.
21 Ruggenenti P,Chiurchiu C,Abbate M,et al.Rituximab for idiopathic membranous nephropathy:who can benefit?Clin J Am Soc Nephrol,2006,1(4):738-748.
22 Cravedi P,Sghirlanzoni MC,Marasà M,et al.Efficacy and safety of rituximab second-line therapy for membranous nephropathy:a prospective,matched-cohort study.Am J Nephrol,2011,33(5):461-468.
23 Fiorentino M,Tondolo F,Bruno F,et al.Treatment with rituximab in idiopathic membranous nephropathy.Clin Kidney J,2016,9(6):788-793.
24 Roccatello D,Sciascia S,Di SD,et al.New insights into immune mechanisms underlying response to Rituximab in patients with membranous nephropathy:A prospective study and a review of the literature.Autoimmun Rev,2016,15(6):529-538.
25 Segarra A,Praga M,Ramos N,et al.Successful treatment of membranous glomerulonephritis with rituximab in calcineurin inhibitor-dependent patients.Clin J Am Soc Nephrol,2009,4(6):1083-1088.
26 Irazabal MV,Eirin A,Lieske J,et al.Low- and high-molecular-weight urinary proteins as predictors of response to rituximab in patients with membranous nephropathy:a prospective study.Nephrol Dial Transplant,2013,28(1):137-146.
27 Busch M,Rüster C,Schinköthe C,et al.Rituximab for the second- and third-line therapy of idiopathic membranous nephropathy:a prospective single center study using a new treatment strategy.Clin Nephrol,2013,80(2):105-113.
28 Moroni G,Depetri F,Del VL,et al.Low-dose rituximab is poorly effective in patients with primary membranous nephropathy.Nephrol Dial Transplant,2017,32(10):1691-1696.
29 Pourcine F,Dahan K,Mihout F,et al.Prognostic value of PLA2R autoimmunity detected by measurement of anti-PLA2R antibodies combined with detection of PLA2R antigen in membranous nephropathy:A single-centre study over 14 years.PLoS One,2017,12(3):e0173201.
30 Ruggenenti P,Debiec H,Ruggiero B,et al.Anti-Phospholipase A2 Receptor Antibody Titer Predicts Post-Rituximab Outcome of Membranous Nephropathy.J Am Soc Nephrol,2015,26(10):2545-2558.
31 Seitz-Polski B,Debiec H,Rousseau A,et al.Phospholipase A2 Receptor 1 Epitope Spreading at Baseline Predicts Reduced Likelihood of Remission of Membranous Nephropathy.J Am Soc Nephrol,2018,29(2):401-408.
32 Cravedi P,Remuzzi G,Ruggenenti P.Rituximab in primary membranous nephropathy:first-line therapy,why not?Nephron Clin Pract,2014,128(3-4):261-269.
33 Mahmoud I,Jellouli M,Boukhris I,et al.Efficacy and Safety of Rituximab in the Management of Pediatric Systemic Lupus Erythematosus:A Systematic Review.J Pediatr,2017,187:213-219.e2.
34 Maratea D,Bettio M,Corti MG,et al.The efficacy and safety of rituximab in treating childhood nephrotic syndrome:an Italian perspective.Ital J Pediatr,2016,42(1):63.

