钙性尿毒症性小动脉病
刘玉秋 张晓良 汤日宁 王 彬 刘必成
病例摘要
病史34岁男性,因“维持性透析12年,多发皮损伴溃烂半年”于2017-10-10入院。
患者12年前查血清肌酐(SCr)450 μmol/L,B超示双肾缩小,予腹膜透析。两年后,因逐渐无尿改为维持性血液透析(MHD)(3次/周,4h/次),透析液钙浓度1.5 mmol/L。4年前,无明显诱因感全身酸痛,查全段甲状旁腺激素(iPTH)2 274 pg/ml,诊断为继发性甲状旁腺功能亢进(甲旁亢),当地医院长期口服钙剂,复查iPTH 波动在2 000~3 000 pg/ml。半年前,出现多发性皮损伴溃烂,尤以双侧手足为著,足趾部分坏死脱落,疼痛明显,伴多处皮肤异常隆起。自行“抗感染、止痛”治疗,效果均欠佳,为进一步诊治入院。
既往史高血压病史10余年,最高血压220/150 mmHg,行MHD后血压逐步下降,已停降压药四年,现血压偏低,波动在65~85 mmHg/40~50 mmHg,低血压不影响正常透析,每次透析超滤量2 500~3 500 ml;否认糖尿病及冠心病病史,否认糖皮质激素、免疫抑制剂、华法林等用药史;因反复内瘘闭塞,曾行“动静脉内瘘成形术”3次。
个人史否认吸烟及嗜酒,否认放射性物质、毒物接触史。
家族史无特殊。
体格检查体温36.6 ℃,脉搏76次/min,呼吸16次/min,血压80/50 mmHg。神志清,精神尚好,发育正常,营养良好,轮椅推入病房。左肩部、右侧背部、左腹股沟、双侧膝关节处皮肤异常隆起,直径3~10 cm,质韧,无触痛(图1A、B);左前臂、右前臂、右侧肘部分别可见长约10 cm的陈旧性手术瘢痕,其中右侧肘部处内瘘震颤存在,其余内瘘处震颤及杂音均消失。心肺无异常;腹平软,无明显压痛、反跳痛,肠鸣音正常;四肢关节活动自如,远端动脉搏动可触及,双侧足背动脉搏动稍有减弱,左足第四足趾、右足第二、第三足趾脱落,局部皮肤坏死,疼痛明显(图1C、D)。
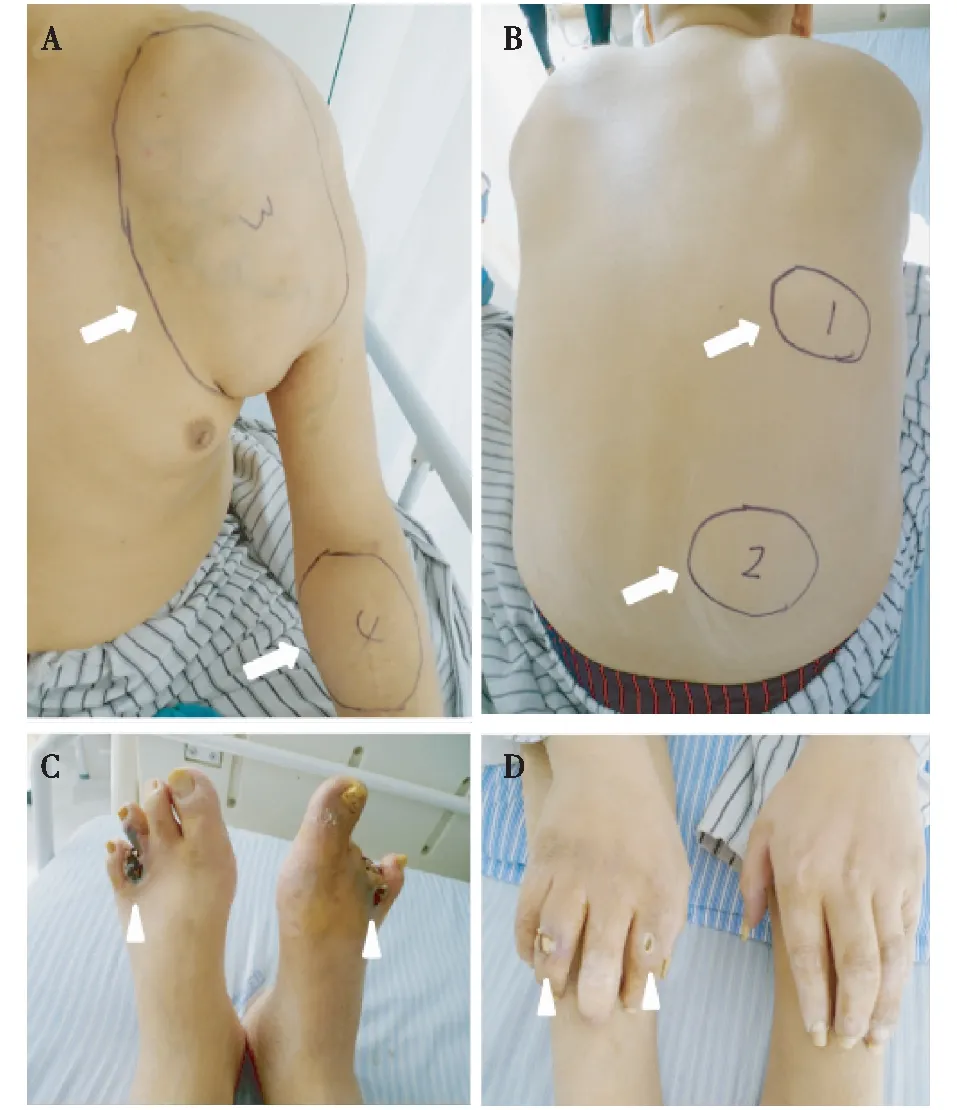
图1 多发性皮肤损害(2017-10-26)A、B:多发性转移性钙化灶(↑);C、D:双侧手足溃疡及干性坏死灶(▲)
实验室检查
血常规 血红蛋白75 g/L,RBC 2.89×1012/L,WBC 7.14×109/L,中性粒细胞比例63.7%,淋巴细胞比例24.6%,PLT 240×109/L。
在铁路污工梁人行道设计标准中,采用U型螺栓等预埋件连接的角钢支架成为宽0.50~1.55m人行道的主导方法,这些连接件成为承受托架动静载荷的关键着力点[1]。由于螺栓连接方式及受力状态比较复杂,加之在运营过程中外界环境和列车振动的影响以及在日常维修不当,在人行道宽度较大的桥梁中逐渐出现螺栓弯曲和折断的病害,然而这些关键连接件一旦出现问题,可能造成托架脱落导致的人身伤害。
血生化 白蛋白34.4 g/L,碱性磷酸酶524 IU/L,尿素氮30.2 mmol/L,SCr 977 μmol/L,尿酸471 μmol/L,三酰甘油2.94 mmol/L,总胆固醇3.446 mmol/L,高密度脂蛋白0.88 mmol/L,低密度脂蛋白2.26 mmol/L;电解质正常,钙2.72 mmol/L,磷2.50 mmol/L,二氧化碳结合力17.2 mmol/L,葡萄糖5.85 mmol/L;iPTH 2 308.4 pg/ml;25羟维生素D测定11.63 ng/ml;超敏C反应蛋白51.4 mg/L;血清铁蛋白567.9 μg/L;铁代谢:未结合铁60.1 μmol/L,总铁结合力91.6 μg/dl,转铁蛋白饱和度34.4%。
其他 纤溶功能、肌钙蛋白I、降钙素原、糖化血红蛋白、病毒八项、肿瘤相关标志物未见明显异常。
影像学检查
胸片 (1)左肩部异常改变:骨质破坏?(2)两肺纹理增多,主动脉粥样硬化(图2A)。
胸腹盆腔CT平扫示 (1)右肺中叶胸膜下钙化灶;(2)纵隔稍大淋巴结;二尖瓣钙化;(3)全身多发异常钙化灶及全身骨质改变,符合肾性骨病改变;(4)双肾萎缩伴钙化,双肾囊肿;(5)动脉粥样硬化(图2B)。
颈胸腰椎MR (1)脊柱骨质信号普遍减低、多发软组织包块伴钙化,符合肾性骨病表现;(2)颈胸腰椎轻度退行性变;L2及L3椎体许莫氏结节形成;(3)双肾萎缩并多发囊肿。
左上肢彩超 左侧肩膀及左侧前壁囊性为主混合性包块。
下肢血管彩超 左下肢动脉硬化(多发斑块形成),左下肢足背动脉狭窄、血流速度增高;右下肢动脉粥样硬化(多发斑块形成),右侧足背动脉显示不清,未见血流信号。
甲状旁腺彩超 双侧甲状旁腺见多个低回声包块,内部回声不均,伴钙化灶,右侧大者2.76 cm×1.46 cm,左侧大者3.94 cm×1.62 cm。甲状旁腺ECT:两下甲状旁腺功能亢进可能,纵膈内未见明显异位甲状旁腺。
全身ECT骨扫描 (1)全身骨质表现,结合临床考虑为代谢性骨病改变;(2)全身多处软组织异常放射性浓聚,建议治疗后复查(图2C、D)。
治疗经过患者持续高水平iPTH,影像检查提示甲状旁腺多发包块且功能亢进,明确诊断“继发性甲旁亢”。2017-11-02于中大医院行“甲状旁腺全切术”,病理示左上、左下、右上、右下甲状旁腺组织结节样增生。术后iPTH 从2 308.4 pg/ml降至2.7 pg/ml,后波动在10~30 pg/ml(图3),全身骨痛好转,但溃疡处疼痛较术前更为明显,伴肢端缺血坏死加重,进展迅速(图4)。
诊疗分析患者存在典型的皮肤损害,出现多发皮下结节、溃疡和干性坏死,需要与下肢动脉粥样硬化性闭塞症、闭塞性脉管炎、糖尿病足等血管病变相鉴别。患者无糖尿病,可除外糖尿病足;患者无间歇性跛行等表现,查体示肢体远端动脉搏动稍有减弱,无肥胖、吸烟、糖尿病、高血脂等危险因素,亦不支持下肢动脉硬化闭塞症。而血栓闭塞性脉管炎多见于青壮年男性患者,与长期大量吸烟有关,有间歇性跛行、静息痛等症状和游走性浅静脉病史,也与本例特点不符。结合本例患者长期透析史、大剂量使用钙剂、明显血管钙化等特点,临床高度考虑为“钙性尿毒症性小动脉病”。
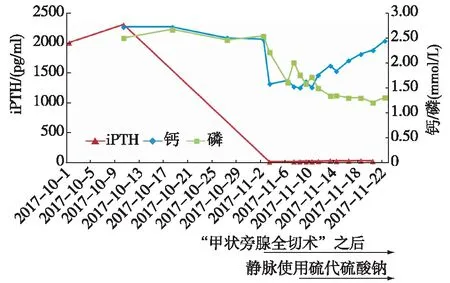
图3 血钙、磷、全段甲状旁腺激素(iPTH)变化情况
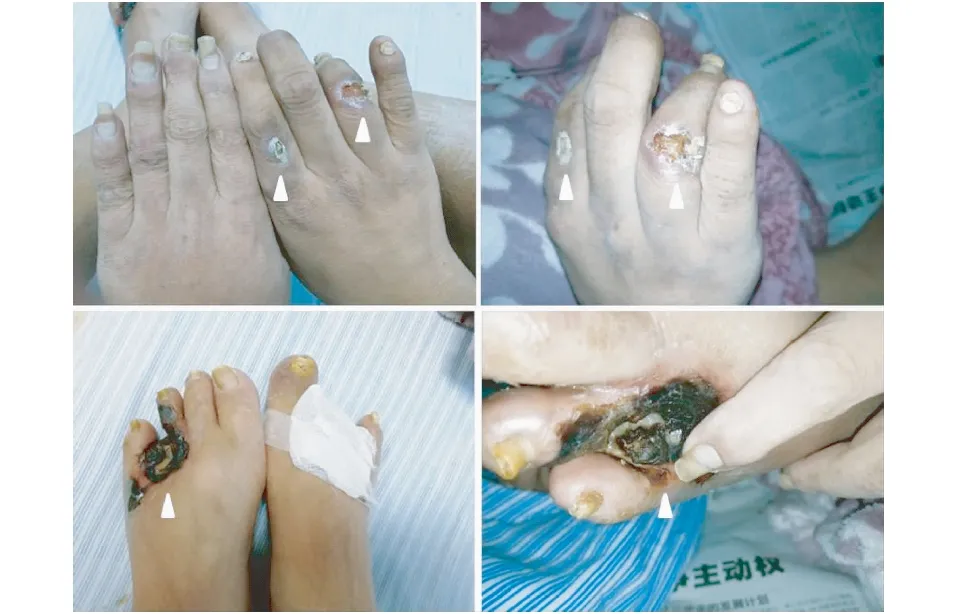
图4 甲状旁腺全切术后,肢端缺血坏死进行性加重(2017-11-14)
治疗上予停用钙剂和维生素D 及其类似物,低钙饮食,调整透析方案为间断血液滤过+血液灌流,增加透析频率,使用低钙透析液(钙离子浓度为1.25 mmol/L),静脉使用硫代硫酸钠(STS)(从5g开始,逐步增量至10g,1次/d,用0.9% NaCl 注射液250 ml溶解后静脉滴注),抗生素预防感染,多学科伤口护理,镇痛,纠正贫血及改善营养等治疗。
病情转归患者甲状旁腺全切术后,钙磷代谢紊乱得到初步控制(图3),多处软组织转移性钙化灶明显缩小(图5A),但溃疡性皮损仍持续进行性进展。应用以大剂量STS(超说明书用药)为主的综合治疗一月,虽足部坏死仍进行性发展(图5B),其左足经多学科会诊拟行截肢,但手部等多发性小溃疡坏死灶逐步愈合(图5C)。全身病变控制,疼痛减轻(图6);肢体血供较前好转,且皮肤敏感消失(治疗前双手接触热/冷水后疼痛明显,现几乎完全改善)。患者目前仍在随访中。
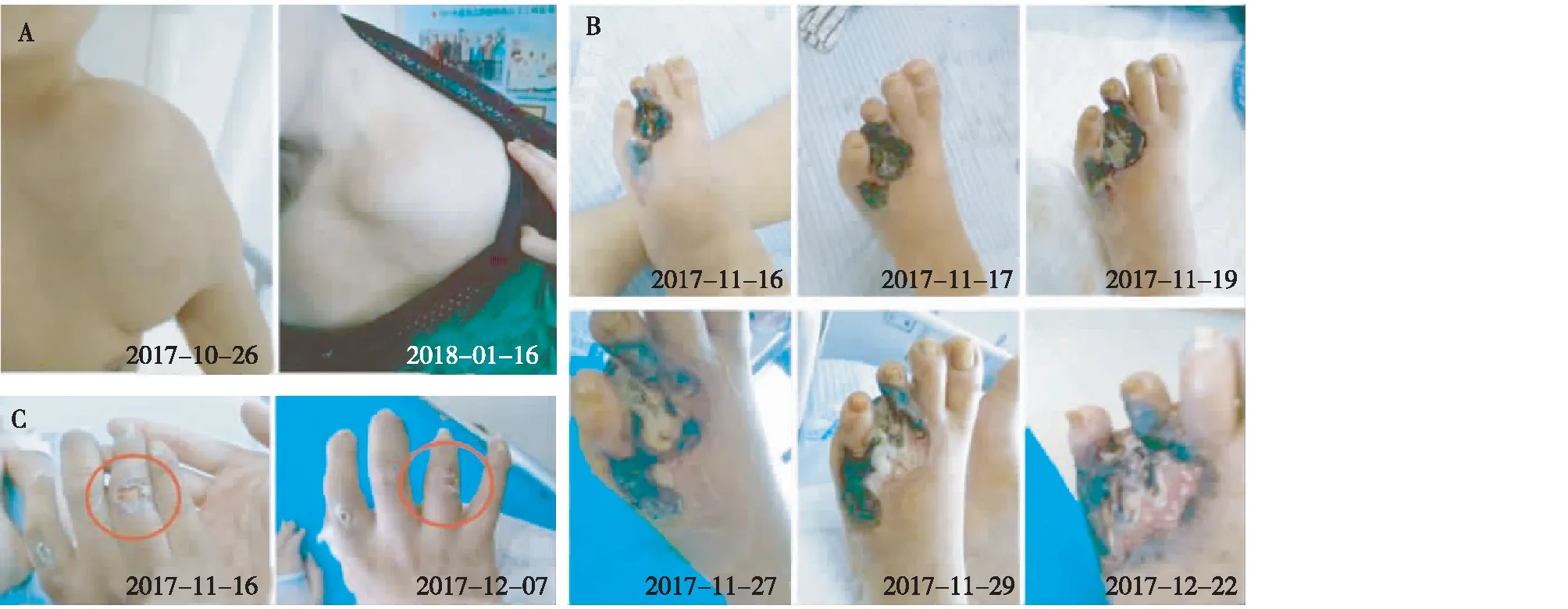
图5 硫代硫酸钠治疗后,足部晚期坏死灶仍进展,但早中期病灶呈愈合趋势A:异常软组织钙化灶明显缩小;B:足部坏死进行性发展;C:手部等多发性小溃疡坏死灶呈愈合趋势
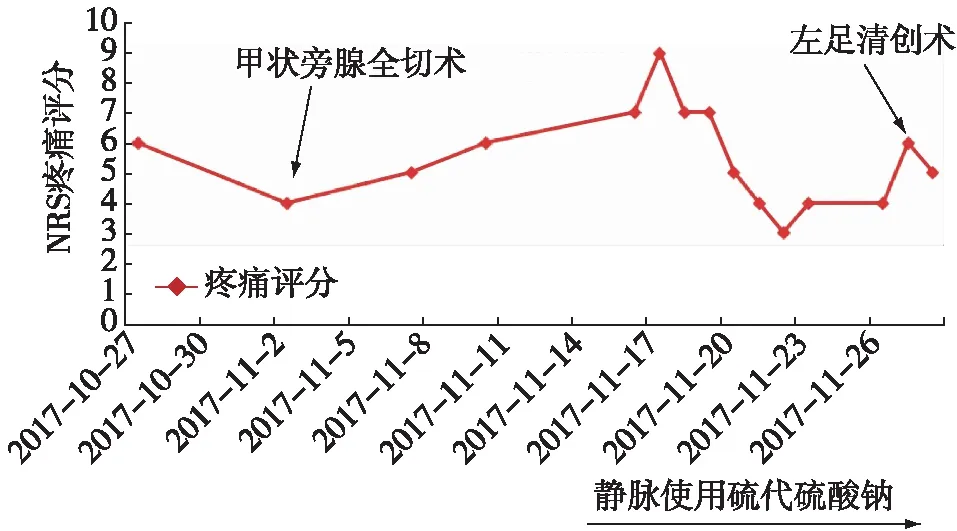
图6 NRS疼痛评分变化情况NRS疼痛评分:将疼痛程度用0~10个数字依次表示,0表示无疼痛,10表示最剧烈的疼痛,交由患者自己选择一个最能代表自身疼痛程度的数字
讨 论
本例青年男性MHD患者,血清高iPTH、高磷血症及钙磷乘积升高多年;皮肤损害呈多部位分布,多阶段病灶共存,局部缺血坏死,疼痛感强烈;“甲状旁腺全切术”后钙磷紊乱好转,转移性钙化逐步缩小,但对溃疡坏死灶无效,仍持续进展;影像学证据提示多发性血管钙化;最终诊断为钙性尿毒症性小动脉病(calcific uremic arteriolopathy,CUA),予硫代硫酸钠为主的综合治疗对左足深达骨面的严重坏死灶无能为力,但对全身早中期病灶明显改善。
CUA的特征钙性尿毒症性小动脉病,也称为钙化防御,是一种致死性的血管性疾病,多见于透析治疗的终末期肾病患者。其主要表现为系统性小动脉钙化合并内皮破坏和血栓形成,引起周围组织缺血性坏死,严重者出现坏疽[1]。典型临床表现为剧烈疼痛的皮肤损害,早期可见网状青斑、紫罗兰色的斑块或硬化的结节,逐步进展为皮肤溃疡和坏死,易继发感染[2-4]。CUA 的病因尚不完全清楚,多数认为与骨骼和矿物质代谢紊乱有关[5]。本例患者体内多个时期的CUA 病灶并存。不仅有晚期的缺血坏死灶,多发性小溃疡的中晚期病灶,而且全身多处皮肤存在早期异样改变,如皮肤敏感、皮肤粗糙增厚等。识别早期病灶,早期干预,是CUA 防治的重要手段。
近10年来CUA 的患病率有所上升,最近的数据显示在MHD患者患病率高达5%[6],因对其认识的不足,故真正的患病率仍属未知[7]。CUA 早期改变缺乏特征性,易被忽视,确诊时通常已出现广泛性坏死,处于疾病晚期,不仅伤口迁延难愈,患者长期饱受疼痛折磨,且预后不佳。本例患者就诊时已存在明显的坏死灶,虽经积极干预,但疾病仍进行性发展。据报道,CUA 患者的1年死亡率为45%~80%,与非溃疡性病变相比,溃疡性坏死灶患者死亡率更高,败血症是导致死亡的主要原因[8-9]。CUA 缺乏特异性治疗手段,一旦发生,预后不良。
CUA与继发性甲旁亢本例患者合并继发性甲旁亢,iPTH长期顽固性升高,一般药物治疗效果不佳,存在骨骼变形、持续低血压等临床症状,而且有全身多发的瘤样转移性钙化灶。甲状旁腺切除术(parathyroidectomy,PTX)后iPTH显著降低,钙磷紊乱得到初步控制,转移性钙化灶明显缩小,但其CUA 却持续恶化,疼痛加剧,肢端缺血坏死迅速进展。
甲旁亢、高磷血症及钙磷乘积升高等因素都可促进钙化的形成[10]。一项涉及3 500例HD患者的RCT 研究发现,西那卡塞组的iPTH 中位水平从690 pg/ml降至300 pg/ml,其CUA 发病率明显降低[11]。CUA 患者的最佳iPTH 水平尚不明确,但是应该避免极端值(极高或极低)[12]。Karmegam等[13]报道1例PTX 后新发的CUA 患者,甲旁亢时iPTH 水平很高,导致骨矿物质吸收和周转增加,从而增加了血清钙和磷酸盐水平;而PTX 后,骨骼原来的高转运状态受iPTH 下降的影响,甚至可能出现低转化型骨病,过量的磷酸钙会沉积在血管壁,使中膜和软组织容易发生钙化[13-14]。本例患者术后CUA 进展加速可能与iPTH 迅速下降有关,尽管PTX 被认为是一种有效的治疗方法。Lal等[15]在对26例确诊为CUA 的患者随访中也发现,单纯PTX 并不是患者生存的决定因素。因此,对于合并继发性甲旁亢的CUA 患者来说,拟钙剂可能比PTX 更可取,后者仅用于难治性病例[12,16]。
CUA的筛查及诊断有关CUA的文献资料多为个案报道或病例对照研究,少量综述性文章,缺乏其诊疗的指南、共识[5],缺少早期筛查手段,对其高危因素及早期诊断方法均有争议。Nigwekar等[10]分析了近年来发表的有关CUA 的相关研究,发现CUA的高危因素包括:老年、白人、女性、透析、糖尿病、肥胖、自身免疫性疾病、大剂量使用碳酸钙及活性维生素D、长期使用糖皮质激素或免疫抑制剂、应用华法林、维生素K缺乏、蛋白C或蛋白S缺乏、低蛋白血症、应用铁剂、皮下注射胰岛素或肝素等。但是这些研究往往存在样本量偏少、单中心研究、选择偏倚等缺陷,导致其证据力度不够。因此,迫切需要大规模多中心的临床流行病学研究,进一步明确其高危因素,对可疑患者进行早期筛查。
本例患者存在典型的多发性皮肤损害,结合其高危因素及排除其他相关疾病,临床诊断CUA。虽然皮肤活检可进一步确诊,但却不是必需的,甚至会形成一个新的病灶[12,17]。在权衡利弊后,我们未对该患者行皮肤活检。现阶段CUA 的诊断缺乏标准,主要依靠临床症状和组织病理学特征。当皮肤出现网状青斑改变并伴有痛性溃疡时应考虑CUA 的可能。既往认为溃疡是典型皮损,但是越来越多的病例表现为非溃疡性斑块[18]。没有典型皮损的患者,皮肤活检是明确诊断的重要手段。其特征性组织学特征包括皮下小动脉中层钙化、血管内膜增生和纤维化、微血栓形成,导致皮肤缺血性坏死[19-21]。我们建立了特殊钙染色方法,如von Kossa染色和茜素红染色,其对HE染色未能发现的钙盐沉积诊断具有重要价值。组织活检虽然是金标准,但是有时需要多次活检才能得出病理学诊断,会延误治疗且可能引起新发皮损。影像学检查有助于CUA 的诊断,尤其是用于评估肌肉和内脏器官的受累情况[22-23]。我们发现ECT骨显像可能是检测及定量非骨组织钙负荷的一项重要手段,“30 min/3 h对比显像”尤为重要。一项回顾性病例对照研究显示[24],对18例确诊CUA 的病例进行骨扫描,其中16例为阳性,而对照组31例非CUA 患者中仅1例阳性,这提示了ECT骨显像对其诊断具有高度的敏感性和特异性。我们对CUA 患者行ECT检查也发现,其软组织对放射性示踪剂的摄取增加,形成局部浓聚。ECT骨显像可能对出现溃疡病灶前的早期诊断具有重大意义,同时作为疗效监测手段。鉴于近来透析患者中CUA 患病率呈上升趋势,且死亡率较高,我们需要进一步规范多方面的诊断标准,从而做到早期筛查。
CUA的治疗该患者采用以STS为主的综合治疗,在1~2周时疼痛明显改善。在积极治疗干预下,其足部坏死仍持续进展,深达骨面,STS对晚期病灶效果不理想,但全身病变得到控制,早中期病灶好转明显,呈愈合趋势。STS是一种氰化物中毒的解毒剂,2004年首次报道其在CUA 方面的成功应用,但目前仍属于超说明书用药,缺乏前瞻性的研究数据,多中心回顾性队列研究显示其疗效和安全性好[10]。STS治疗机制仍不确切,可能与其增加钙盐溶解,扩张血管,抑制氧化应激,减轻炎症有关[1]。目前,文献中推荐用法一般为STS 25 g溶于100 ml生理盐水中,3次/d,透析后或透析最后1h静滴。经过系统调研及药事委员会批准,根据实际情况,调整方案为STS 5~10 g溶于250 ml生理盐水中,每日静脉滴注,患者耐受性较好。CUA 需要多学科合作的综合性治疗。其伤口的处理目标是控制渗出、预防感染、促进愈合(参照烧伤的处理原则),同时加强疼痛管理[25]。手术清创应慎重,常规清创疗效不理想,创口难以愈合,但要视具体情况决定,出现明显感染趋势时可能需要手术清创,并预防性使用抗生素。CUA 患者皮肤氧张力显著降低,部分患者接受高压氧治疗后皮损改善明显[26]。一旦有CUA 的征象,应尽量去除一切可能的致敏剂或激发剂:如华法令、糖皮质激素、活性维生素D等。合并钙磷代谢紊乱的高危患者,可使用司维拉姆,碳酸镧等非钙磷结合剂。同时优化透析方案,增加透析充分性、增加透析次数、延长透析时间、使用低钙透析液等[27]。
小结:CUA 是多见于终末期透析患者的一种潜在致死性疾病,典型表现为持久不愈的皮肤溃疡或焦痂形成。其发病机制不清,缺乏特异性治疗,一旦发生,病死率高,早期筛查是诊治关键,但目前尚无明确的CUA 诊治指南。本例CUA患者经过以STS为主的综合治疗,取得了较好的疗效。
1 Jeong HS,Dominguez AR.Calciphylaxis:Controversies in Pathogenesis,Diagnosis and Treatment.Am J Med Sci,2016,351(2):217-227.
2 Brandenburg VM,Kramann R,Specht P,et al.Calciphylaxis in CKD and beyond.Nephrol Dial Transplant,2012,27(4):1314-1318.
3 Brewster UC.Dermatological disease in patients with CKD.Am J Kidney Dis,2008,51(2):331-344.
5 Brandenburg V,Adragao T,van Dam B,et al.Blueprint for a European calciphylaxis registry initiative:the European Calciphylaxis Network (EuCalNet).Clin Kidney J,2015,8(5):567-571.
6 Rogers NM,Coates PT.Calcific uraemic arteriolopathy:an update.Curr Opin Nephrol Hypertens,2008,17(6):629-634.
7 Fine A,Fontaine B.Calciphylaxis:the beginning of the end?.Perit Dial Int,2008,28(3):268-270.
8 Weenig RH,Sewell LD,Davis MD,et al.Calciphylaxis:natural history,risk factor analysis,and outcome.J Am Acad Dermatol,2007,56(4):569-579.
9 Fine A,Zacharias J.Calciphylaxis is usually non-ulcerating:risk factors,outcome and therapy.Kidney Int,2002,61(6):2210-2217.
10 Nigwekar SU,Kroshinsky D,Nazarian RM,et al.Calciphylaxis:risk factors,diagnosis,and treatment.Am J Kidney Dis,2015,66(1):133-146.
11 Chertow GM,Block GA,Correa-Rotter R,et al.Effect of cinacalcet on cardiovascular disease in patients undergoing dialysis.N Engl J Med,2012,367(26):2482-2494.
12 Nigwekar SU,Thadhani R,Brandenburg VM.Calciphylaxis.N Engl J Med,2018,378(18):1704-1714.
13 Karmegam S,Shetty A.Calciphylaxis after parathyroidectomy.Hemodial Int,2017,21 Suppl 2:S62-62S66.
14 London GM,Marty C,Marchais SJ,et al.Arterial calcifications and bone histomorphometry in end-stage renal disease.J Am Soc Nephrol,2004,15(7):1943-1951.
15 Lal G,Nowell AG,Liao J,et al.Determinants of survival in patients with calciphylaxis:a multivariate analysis.Surgery,2009,146(6):1028-1034.
16 Nigwekar SU,Sprague SM.We Do Too Many Parathyroidectomies for Calciphylaxis.Semin Dial,2016,29(4):312-314.
17 Latus J,Kimmel M,Ott G,et al.Early stages of calciphylaxis:are skin biopsies the answer?.Case Rep Dermatol,2011,3(3):201-205.
18 Sreedhar A,Sheikh HA,Scagliotti CJ,et al.Advanced-stage calciphylaxis:Think before you punch.Cleve Clin J Med,2016,83(8):562-564.
19 Reiter N,El-Shabrawi L,Leinweber B,et al.Calcinosis cutis:part I.Diagnostic pathway.J Am Acad Dermatol,2011,65(1):1-12; quiz 13-14.
20 Essary LR,Wick MR.Cutaneous calciphylaxis.An underrecognized clinicopathologic entity.Am J Clin Pathol,2000,113(2):280-287.
21 Mochel MC,Arakaki RY,Wang G,et al.Cutaneous calciphylaxis:a retrospective histopathologic evaluation.Am J Dermatopathol,2013,35(5):582-586.
22 Shmidt E,Murthy NS,Knudsen JM,et al.Net-like pattern of calcification on plain soft-tissue radiographs in patients with calciphylaxis.J Am Acad Dermatol,2012,67(6):1296-1301.
23 Bonchak JG,Park KK,Vethanayagamony T,et al.Calciphylaxis:a case series and the role of radiology in diagnosis.Int J Dermatol,2016,55(5):e275-279.
24 Paul S,Rabito CA,Vedak P,et al.The Role of Bone Scintigraphy in the Diagnosis of Calciphylaxis.JAMA Dermatol,2017,153(1):101-103.
25 Martin R.Mysterious calciphylaxis:wounds with eschar--to debride or not to debride?.Ostomy Wound Manage,2004,50(4):64-66,68-70; discussion 71.
26 Basile C,Montanaro A,Masi M,et al.Hyperbaric oxygen therapy for calcific uremic arteriolopathy:a case series.J Nephrol,2002,15(6):676-680.
27 Ross EA.Evolution of treatment strategies for calciphylaxis.Am J Nephrol,2011,34(5):460-467.

