新疆南部图兰扇头蜱及卵携带R. raoultii的分子检测
刘永宏,李贝贝,李凯瑞,何波,张敬博,蒲小峰,陈梅娟,潘姣姣,李飞,张路瑶,赵丽
新疆南部图兰扇头蜱及卵携带的分子检测
刘永宏1,李贝贝1,李凯瑞1,何波1,张敬博1,蒲小峰1,陈梅娟1,潘姣姣1,李飞2,张路瑶3,赵丽1
(1塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300;2新疆阿克苏地区动物疫病控制诊断中心, 新疆阿克苏 843000;3巴里坤哈萨克自治县畜牧兽医工作站,新疆哈密 839200)
【目的】世界上蜱类3科18属899种,中国有2科10属117种,新疆至少有2科10属45种,占全国蜱种类的1/3之多,分布也极其广泛。蜱直接危害和传播多种病原,且一些病原可经卵垂直传播,给畜牧业造成巨大经济损失,还严重威胁公共卫生安全。图兰扇头蜱是新疆南部荒漠及半荒漠地区常见种和优势种。确定新疆南部图兰扇头蜱及其卵是否携带立克次体,对该蜱及其传播立克次体病的防控意义重大。【方法】对新疆生产建设兵团塔里木畜牧科技重点实验室在新疆南部阿拉尔市某羊场收集的饱血雌性扇头蜱,置于一定湿度和一定温度的环境中产卵,随机取5个独立的卵样品及其对应的5只雌蜱为研究对象。通过对雌蜱及其卵分别处理后提取基因组DNA,进行PCR扩增蜱12S rRNA基因和立克次体16S rRNA基因,并对扩增产物测序,利用BLAST在线平台和多个分子生物学软件进行序列分析。【结果】5只雌蜱12S rRNA基因PCR扩增全部阳性,测序获得的4段蜱12S rRNA基因序列完全一致;Blast分析与GenBank数据库中图兰扇头蜱12S rRNA基因序列相似性高达99%以上,且高相似性前五基因序列均为图兰扇头蜱,其中包括来自新疆绵羊的图兰扇头蜱;本研究蜱12S rRNA基因序列提交GenBank数据库获得登录号为MG744514,与来自于GenBank数据库图兰扇头蜱、血红扇头蜱、微小牛蜱、边缘革蜱、草原革蜱、长角血蜱、小亚璃眼蜱、亚洲璃眼蜱、残缘璃眼蜱、全沟硬蜱及外围群尘螨的22个12S rRNA基因序列的进化树显示,研究所获得的蜱12S rRNA基因序列与图兰扇头蜱进化关系最近,聚在同一个小分支;确定了该扇头蜱为图兰扇头蜱。5只产卵后的雌蜱和相应蜱所产的全部卵立克次体16S rRNA基因PCR扩增,有1只蜱和其产的卵样品阳性,蜱携带率为20%;雌蜱及其卵立克次体16S rRNA基因测序结果完全一致;Blast分析与GenBank数据库中16S rRNA基因序列相似性高达99%以上,且高相似性前五基因序列为4个和1个sp.,其中包括来自新疆2011年的亚洲璃眼蜱和草原革蜱的立克次体;立克次体16S rRNA基因序列提交GenBank数据库获得登录号为MG744513,与来自于GenBank数据库的37个24种立克次体16S rRNA基因序列的进化树显示,研究获得的立克次体16S rRNA基因序列与进化关系最近,聚在同一个小分支,与其他15种立克次体同属于斑点热群立克次体;确定了本研究图兰扇头蜱及其卵均携带斑点热群立克次体。【结论】首次发现图兰扇头蜱及其卵携带。
劳氏立克次体;卵;图兰扇头蜱;新疆
0 引言
【研究意义】世界上蜱类3科18属899种[1],中国有2科10属117种[2]。新疆至少有2科10属45种[3],占全国蜱种类的1/3之多,分布也极其广泛。蜱直接叮咬造成动物出现炎症、贫血、瘫痪、中毒、过敏以及通过皮肤损伤处继发感染和发生蝇蛆病等,且蜱携带和传播多种病原体,不仅给畜牧业造成巨大经济损失,还是仅次于蚊的人类疾病第二大传播媒介,严重威胁公共卫生安全[4]。调查蜱种类及其携带病原情况,对当地蜱及蜱传病的防控意义重大。【前人研究进展】图兰扇头蜱()属于硬蜱科()扇头蜱亚科()扇头蜱属(),三宿主蜱,主要寄生于骆驼、牛、马、绵羊、山羊等家畜和野生动物[5]。图兰扇头蜱在中国分布于新疆、陕西、江苏、云南和广西,是新疆南部荒漠及半荒漠地区常见种和优势种,新疆周边国家分布也极为广泛[5-6]。【本研究切入点】已报道,经软蜱或硬蜱可垂直传播的病原有非洲猪瘟病毒[7]、新疆出血热病毒[8]、克里米亚-刚果出血热病毒[9]、伯氏疏螺旋体[10]、巴贝斯虫[11]、斑点热群立克次体[12]、西伯利亚立克次体、贝氏立克次体[13]、似柯克斯氏体属共生体、似立克次体属共生体[14]、[15]、和[16],等等。综上所述,一种病原是否经蜱的卵传播的研究是非常必要的,研究结果可对分析该病的蔓延和流行风险评估提供基础信息和科学参考。【拟解决的关键问题】本研究拟通过对新疆南部扇头蜱属蜱结合分子生物学进行蜱种类鉴定,然后对饱血雌蜱和其产的卵通过立克次体属基因扩增进行立克次体及其种类的鉴定与分析,以期为蜱及蜱传病的防控提供理论依据。
1 材料与方法
试验于2017年4—7月在塔里木大学动物科学学院实验室和新疆生产建设兵团塔里木畜牧科技重点实验室完成。
1.1 材料
1.1.1 扇头蜱及其卵 饱血雌蜱(图1),于2017年5月采集于新疆南部阿拉尔市某团场一个羊场,约50只,经形态学鉴定均为扇头蜱属蜱(图2);饱血雌蜱置于一定湿度和一定温度的环境中产卵,随机取5个具有独立空间的卵样品(1个卵样品为1只雌蜱所产全部卵,图3箭头所示)及其对应的5只产卵雌蜱为后续研究对象。
1.1.2 引物和参考基因序列 鉴定蜱种类的基因扩增引物为12S-F:5′-AAA CTA GGA TTA GAT ACC CT-3′,12S-R: 5′-AAT GAG AGC GAC GGG CGA TGT-3′,预期扩增产物大小为320 bp[17];鉴定立克次体种类16S rRNA基因扩增引物为16S-F:5′-ATC AGT ACG GAA TAA CTT TTA-3′,16S-R:5′-TGC CTC TTG CGT TAG CTC AC-3′,预期扩增产物大小为1 332 bp[18],由生工生物工程(上海)有限公司合成。
基因分析参考序列均来源于NCBI数据库,序列名称和GenBank登录号见图5和图6。
1.1.3 主要试剂及仪器 TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver. 5.0 (Code No. 9765)、Premix TaqTM(TakaRa TaqTMVersion 2.0)(Code No. R004A)和DL2000 DNA Marker(Code No. 3427A),购自宝生物工程(大连)有限公司。PCR仪(TC-5000, Bibby scientific Ltd),小型高速冷冻离心机(R134a, Hermetically sealed refrigeration system),电泳仪(DYY-12,北京市六一仪器厂),紫外分析仪(JY02S,北京君意东方电泳仪设备有限公司)等。
1.2 方法
1.2.1 DNA提取 雌蜱和卵分别用蒸馏水洗脱3次后,无菌滤纸吸干,置于2mL无菌管中,按照TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver. 5.0(Code No. 9765)试剂盒说明书操作,提取基因组DNA,最后用50 μL无菌水洗脱收集DNA,-20℃保存备用。
1.2.2 PCR 按照Premix TaqTM(TakaRa TaqTMVersion 2.0)(Code No. R004A)试剂盒说明书对蜱12S rRNA基因和立克次体16S rRNA基因进行扩增,PCR体系均为50 μL,PCR反应条件分别为:94℃ 5 min—5个循环(94℃ 15 s,51℃ 30 s,68℃ 30 s)—25个循环(94℃ 15 s,53℃ 30 s,70℃ 30 s)—70℃ 5 min和95℃ 5 min—30个循环(95℃ 45 s,58℃ 45 s,72℃ 90 s)—72℃ 5 min。
1.2.3 序列分析 扩增产物经1%凝胶电泳鉴定后,30μL阳性扩增产物与上下游引物一同送生工生物工程(上海)有限公司测序。测序结果利用BLAST在线平台(https://blast.ncbi.nlm.nih.gov/Blast.cgi? PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)、Primer Premier 5.0、DNAMAN、DNAStar和MEGA5.0软件,进行种系发育分析和构建系统发育树。
2 结果
2.1 PCR扩增
通过蜱12S rRNA基因扩增引物对产卵后的雌蜱基因组DNA进行PCR,结果5只雌蜱样品扩增全部阳性,产物与预期大小一致;通过立克次体16S rRNA基因扩增引物对产卵后的雌蜱和其所产的卵基因组DNA分别进行PCR,结果1只蜱和其产的卵样品(20%,1/5)扩增均为阳性,产物与预期大小一致(图4)。
2.2 Blast比对分析
蜱12S rRNA基因扩增产物全部送测序,获得的4段蜱12S rRNA基因序列完全一致,通过Blast在线分析,与数据库中图兰扇头蜱12S rRNA基因序列相似性最高,达99%以上,且高相似性前五基因序列均为图兰扇头蜱(表1),其中包括来自新疆绵羊的图兰扇头蜱,本研究蜱12S rRNA基因测序结果提交GenBank数据库获得的登录号为MG744514。产卵后的雌蜱和卵立克次体16S rRNA基因扩增产物送测序,来自雌蜱和卵的该基因测序结果完全一致,通过Blast比对分析,与数据库中基因序列相似性最高,达99%以上,且高相似性前五基因序列为4个和1个(表1),其中包括来自新疆2011年的亚洲璃眼蜱和草原革蜱的立克次体,本研究立克次体16S rRNA基因测序结果提交GenBank数据库获得的登录号为MG744513。
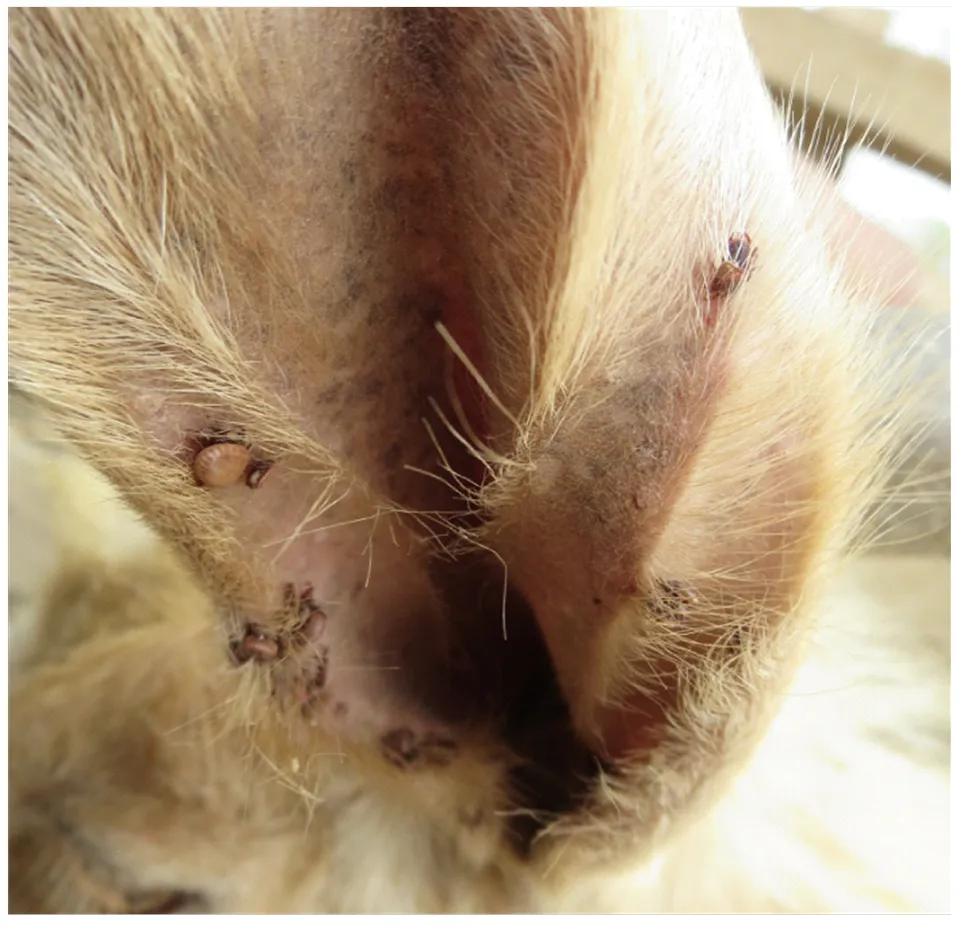
图1 寄生于新疆阿拉尔市绵羊耳部的蜱

图2 扇头蜱属蜱

图3 雌蜱产的卵
2.3 序列分析
来自于GenBank数据库图兰扇头蜱、血红扇头蜱、微小牛蜱、边缘革蜱、草原革蜱、长角血蜱、小亚璃眼蜱、亚洲璃眼蜱、残缘璃眼蜱、全沟硬蜱及外围群尘螨的22个12S rRNA基因序列,与本研究序列一同进行进化关系分析。进化树显示,本研究获得的蜱12S rRNA基因序列与图兰扇头蜱进化关系最近,聚在同一个小分支(图5)。
来自于GenBank数据库的37个24种立克次体16S rRNA基因序列,与本研究序列一同进行进化关系分析。进化树显示,本研究获得的立克次体16S rRNA基因序列与进化关系最近,聚在同一个小分支,与其他15种立克次体同属于斑点热群立克次体(图6)。

表1 蜱12S rRNA基因和立克次体16S rRNA基因Blast比对分析

M:Marker;1—5:蜱12S;6和9:阴性对照;7:蜱立克次体16S;8:卵立克次体16S

▲标注序列为本研究序列 The black trilateral tagging sequence is the sequence of this research

●标注序列为本研究序列 The black circles tagging sequence is the sequence of this research
3 讨论
对扇头蜱属蜱进行12S rRNA基因PCR扩增及测序,通过Blast比对分析,本研究获得GenBank登录号为MG744514的序列与数据库中多个图兰扇头蜱12S rRNA基因序列相似性达到99%以上。且与多种蜱及外围群尘螨的22个12S rRNA基因序列进化树显示,本研究12S rRNA基因序列与图兰扇头蜱进化关系最近,聚在同一个小分支。综合以上所述,本研究蜱样品为图兰扇头蜱。文献[5-6]也报道,图兰扇头蜱为新疆南部荒漠及半荒漠地区常见种和优势种,也有报道新疆伊宁县图兰扇头蜱具有生物多样性[19]。新疆南部图兰扇头蜱是否具有多样性及其他特征,需要进一步利用大量样本结合多个基因对其研究分析。另外一方面,本研究对雌性图兰扇头蜱及其产的卵进行立克次体16S rRNA基因PCR扩增及测序,其中一组蜱和卵样品PCR扩增均为阳性。测序结果通过Blast比对分析,本研究获得GenBank登录号为MG744513的序列与数据库中16S rRNA基因序列相似性达到99%以上。且与24种立克次体16S rRNA基因序列进化树显示,本研究获得的立克次体16S rRNA基因序列与进化关系最近,聚在同一个小分支。参照文献[18,20]分析本研究获得的与其他12种立克次体同属于斑点热群立克次体。
1999年,发现于短小扇头蜱和草原革蜱[21]。目前,欧洲、北美洲、南美洲和亚洲发现了这种立克次体[22]。中国,早在2008年吉林森林革蜱发现了[23],近年来西藏[24]、新疆[25-27]、黑龙江[28-29]等地区先后报道发现了。本研究补充了新疆南部发现,也证实了新疆确实存在,文献也报道为新疆的广布种[12]。2016年之前的报道,仅报道于蜱,至少有13种蜱(仅包括1种扇头蜱),多见于革蜱[22],尤其西藏地区革蜱携带率高达84.6%[24]。本研究首次在图兰扇头蜱中发现了,且在雌蜱产的卵中也发现了。图兰扇头蜱对是偶然感染还是可以长期稳定传播、卵是否可以稳定多代传递该病原、新疆南部地域地貌和特殊气候等是否对图兰扇头蜱感染有影响等等,诸多问题均需要进一步研究,分析大量样品证实。但是,结合2016年石河子大学报道[26]新疆羊蜱蝇和新疆医科大学报道新疆长尾黄鼠检测到[27],新疆生产建设兵团塔里木畜牧科技重点实验室分析的宿主分布和其他特征还存在诸多未知。另外,本研究采集的蜱样通过形态学鉴定,均为扇头蜱属蜱,且随机取的5只蜱样分子生物学鉴定获得的12S rRNA基因序列一致,鉴定为图兰扇头蜱,即本研究绵羊宿主体外寄生单一种类蜱。结合本研究图兰扇头蜱的感染率为20%,且卵中检测到了,新疆生产建设兵团塔里木畜牧科技重点实验室分析图兰扇头蜱对的感染和传播可能有其复杂机制和重要意义。此外,近年来包括中国的多个国家报道对人致病,引起蜱传淋巴结炎和蜱传坏死红斑淋巴结病,受到了卫生部门及相关研究机构的关注[29-30]。关于感染宿主细胞的机制和在动物群体的流行病学研究等,需要相关学者进一步研究。新疆南部地区需要长期对蜱、动物及人是否携带等蜱传病原进行监测,及时了解蜱传病原的动态,以便有效防控感染等蜱传病。
4 结论
在中国新疆南部首次发现图兰扇头蜱,其雌蜱及其卵携带斑点热群立克次体。这为深入研究经蜱传播奠定了基础。
[1] JOHN E. George present and future technologies for tick control., 2000, 916(12): 583-588.
[2] 陈秋语. 新疆伊犁州动物蜱传疾病分子流行病学调查[D]. 兰州: 中国农业科学院兰州兽医研究所, 2016.
CHEN Q Y. The molecular epidemiological investigation of tick-borne pathogens in kazak autonmous prefecture of Ili, Xinjiang, China[D]. Lanzhou: Lanzhou Institute of Veterinary Medicine, Chinese Academy of Agricultural Sciences, 2016 (in Chinese)
[3] 吴辉, 斯清, 朱玉涛, 宋瑞其, 巴音查汗. 新疆四种优势种革蜱超微结构观察. 昆虫学报, 2016, 59(1): 85-92.
WU H, SI Q, ZHU Y T, SONG R Q, BAYIN C H. Observation on the ultrastructure of four dominantspecies (Acari: Ixodidae) in Xinjiang, northwestern China., 2016, 59(1): 85-92. (in Chinese)
[4] GUO D H, ZHANG Y, FU X, GAO Y, LIU Y T, QIU J H, CHANG Q C, WANG C R. Complete mitochondrial genomes ofand comparative analyses with another hard tick., 2016, 169: 22-27.
[5] 孙响, 张桂林, 刘晓明, 赵焱, 郑重. 新疆和硕地区主要蜱类及蜱媒病原体调查. 中国媒介生物学及控制杂志, 2013, 24(1): 5-7, 10.
SUN X, ZHANG GL, LIU X M, ZHAO Y, ZHEN Z. Investigation of tick species and tick⁃borne pathogens in Hoxud county of Xinjiang Uyghur Autonomous Region, China., 2013, 24(1): 5-7, 10. (in Chinese)
[6] 陈泽. 中国蜱类的系统分类及两种硬蜱的生物学特性分析. 石家庄: 河北师范大学, 2010.
CHEN Z. Taxonomic and systematic research of Chinese ticks and biological characteristic analysis of two hard tick species. Shijiazhuang: Hebei Normal University, 2010. (in Chinese)
[7] COSTARD S, MUR L, LUBROTH J, SANCHEZ-VIZCAINOJ M, PFEIFFERD U. Epidemiology of African swine fever virus., 2013, 173(1): 191-197.
[8] 刘继荣, 米来, 王平福, 张艳艳, 薄新文. 准噶尔盆地硬蜱区系考察与名录记述. 中国动物传染病学报, 2013, 21(1): 60-65.
LIU J R, MI L, WANG P F, ZHANG Y Y, BO X W. Faunal distribution and checklist of ticks in the junggar basin., 2013, 21(1): 60-65. (in Chinese)
[9] GARGILI A, ESTRADA-PEÑA A, SPENGLER J R, LUKASHEV A, NUTTALL P A, BENTE D A. The role of ticks in the maintenance and transmission of Crimean-Congo hemorrhagic fever virus: A review of published field and laboratory studies., 2017, 144: 93-119.
[10] 万康林, 张哲夫, 王宏英, 侯学霞, 张金声. 中国莱姆病螺旋体宿主动物的初步调查研究. 卫生研究, 1999, 28(1): 7-9.
WAN K L, ZHANG Z L, WANG H Y, HOU X X, ZHANG J S. Prel iminary investigation on reservoir hosts ofin China., 1999, 28(1): 7-9. (in Chinese)
[11] 刘钟灵, 赵俊龙, 马丽华, 姚宝安. 寄生于中国水牛的巴贝斯虫一新种(梨形虫目: 巴贝斯科). 畜牧兽医学报, 1997, 28(1): 84-89.
LIU Z L, ZHAO J L, MA L H, YAO B A.sp. nov. parasitized in buffaloin China ()., 1997, 28(1): 84-89. (in Chinese)
[12] 徐军, 王安东, 罗丹, 徐新龙, 戴莉, 杨杰, 徐建军, 热依罕古丽, 萨尼叶古丽, 王丽娜, 杜景云, 李志远, 王远志. 中哈边境艾比湖湿地游离蜱斑点热群立克次体的分子流行病学研究. 中国兽医杂志, 2016, 52(8): 18-20.
XU J, WANG A D LUO D, XU X L, DAI L, YANG J, XU J J, RE YHGL, SA NYGL, WANG L N, DU J Y, LI Z Y, WANG Y Z. Molecular epidemiological study of the spotted fever groupin free-living ticks in the wetlands of Aibi Lake, China- Kazakhstan border., 2016, 52(8): 18-20. (in Chinese)
[13] 李颖. 我国东北森林景区媒介蜱感染与传播无形体的研究[D]. 苏州: 苏州大学, 2012.
LI Y. Investigation on the infection within ticks from forest area in northeast of China[D]. Suzhou: Soochow University, 2012. (in Chinese)
[14] WANG R, LI N, LIU J, LI T, LIU M, YU Z, LIU J. Symbiont dynamics of the Tibetan tick()., 2017, 25, 10(1): 259.
[15] BALDRIDGE G D, BURKHARDT N Y, SIMSER J A, KURTTI T J, MUNDERLOH U G. Sequence and expression analysis of the ompA gene ofan endosymbiont of the Rocky Mountain wood tick,, 2004, 70(11): 6628-6636.
[16] HARRIS E K, VERHOEVE V I, BANAJEE K H, MACALUSO J A, AZAD A F, MACALUSO K R. Comparative vertical transmission of Rickettsia byand., 2017, 8(4): 598-604.
[17] Beati L, Keirans J E. Analysis of the systematic relationships among ticks of the generaand(Acari: Ixodidae) based on mitochondrial 12S ribosomal DNA gene sequences and morphological characters., 2001, 87(1): 32-48.
[18] ANSTEAD C A, CHILTON N B. A novel Rickettsia species detected in Vole Ticks () from Western Canada., 2013, 79(24): 7583-7589.
[19] WANGY Z, MUL M, ZHANGK, YANG M H, ZHANG L, DU J Y, LIU Z Q, LI Y X, LU W H, CHEN C F, WANG Y, CHEN R G, XU J, YUAN L, ZHANG W J, ZUO W Z, SHAO R F. A broad-range survey of ticks from livestock in Northern Xinjiang: changes in tick distribution and the isolation ofsensu stricto., 2015, 8(1): 449.
[20] KIRSTINE KLITGAARD, MARIANN CHRIÉL, ANASTASIA ISBRAND, JENSEN T K, BØDKER R. Identification ofTicks crryingon Migrating Jackal, Denmark., 2017, 23(12): 2072-2074.
[21] MEDIANNIKOV O, MATSUMOTO K, SAMOYLENKO I, DRANCOURT M, ROUX V, RYDKINA E, DAVOUST B, TARASEVICH I, BROUQUI P, FOURNIER P E.sp. nov. , a spotted fever group rickettsia associated with Dermacentor ticks in Europe and Russia., 2008, 58(7): 1635-1659.
[22] 闻静, 焦丹, 鞠文东, 黄玉明, 王悦, 王建华, 时晓杰, 成洪艳, 程成, 孙毅. 新发蜱传病原体——劳氏立克次体的研究现状. 中国人兽共患病学报, 2015, 31(4): 361-364.
WEN J, JIAO D, JU W D, HUANG Y M, WANG Y, WANG J H, SHI X J, CHENG H Y, CHENG C, SUN Y. Emerging tick-borne pathogen - the research status on., 2015, 31(4): 361-364. (in Chinese)
[23] CAO W C, ZHAN L, DE VLAS S J, WEN B H, YANG H, RICHARDUS J H, HABBEMA J D. Molecular detection of spotted fever group Rickettsia infrom a forest area of northeastern China., 2008, 45(4): 741-744.
[24] WANG Y, LIU Z, YANG J, CHEN Z, LIU J, LI Y, YIN H.–like Bacteria inspp. Ticks, Tibet, China., 2012, 18(9): 1531-1533.
[25] TIAN Z C, LIU G Y, SHEN H, XIE J R, LUO J, TIAN M Y. First report on the occurrence ofandi inin China., 2012, 5: 191-194.
[26] LIU D, WANG Y Z, ZHANG H, LIU Z Q, WURELI H Z, WANG S W, TU C C, CHEN C F. First report ofand, the sheep ked., 2016, 9(1): 600-605.
[27] 郭刚. 新疆北疆地区鼠类和体外寄生生物病原携带及遗传特征研究[D]. 乌鲁木齐: 新疆医科大学, 2016.
GUO G. Distribution and genetic study on the rodents, ectozoic parasites and associated pathogens in northern region of Xinjiang[D]. Urumqi: Xinjiang Medical University, 2016. (in Chinese)
[28] WEN J, JIAO D, WANG J H, YAO D H, LIU Z X, ZHAO G, JU W D, CHENG C, LI Y J, SUN Y., the predominant Rickettsia found inticks in China-Russia border areas.2014, 63(4): 579-585.
[29] JIA N, ZHENG Y, MA L, HUO Q, NI X, JIANG B, CAO W. Human infections with, China., 2014, 20(5): 866-868.
[30] PAROLA P, ROVERY C, ROLAIN J, BROUQUI P, DAVOUST B, RAOULT D.andin tick-borne rickettsioses., 2009, 15(7): 1105-1108.
(责任编辑 林鉴非)
Molecular Detection ofand Its Eggs Carryingin Southern Xinjiang
LIU YongHong1, LI BeiBei1, LI KaiRui1, HE Bo1, ZHANG JingBo1, PU XiaoFeng1, CHEN MeiJuan1, PAN JiaoJiao1, LI Fei2, ZHANG LuYao3, ZHAO Li1
(1College of Animal Science, Tarim University/Key Laboratory of Tarim Animal Husbandry Science and Technology of Xinjiang Production & Construction Corps, Alar 843300, Xinjiang;2Animal Loimia Controlling and Diagnostic Center of Aksu Region, Aksu 843000, Xinjiang;3Animal husbandry and veterinary workstations of Barkol kazak autonomous county, Kumul 839200, Xinjiang)
【Objective】 There are 899 species of ticks in the world, belonging to 18 genera and 3 families, and there are 117 species in China, belonging to 2 families, 10 genera. There are at least 45 species in Xinjiang, accounting for more than 1/3 of the national ticks, and its distribution is extremely wide. Ticks can directly harm and spread many kinds of pathogens, and some pathogens can propagate vertically through eggs, causing huge economic losses to animal husbandry, and seriously threatening public health security.is one of the common species and dominant species in the desert and semi-desert region of southern Xinjiang. It is of great significance to confirm whetherand its eggs are carrying thein the southern Xinjiang of China, so as to prevent and control ofand its transmission of.【Method】 The satiated blood femalewere collected from a sheep farm in alar, southern Xinjiang, and oviposited eggs at a certain humidity and temperature. A random sample of 5 independent eggs and the corresponding 5 femalewere as the research object. The genomic DNA were extracted from the femaleand eggs, respectively. In this study, ticks 12S rRNA gene and16S rRNA gene were amplified by conventional PCR, and the amplification products were sequenced and underwent sequence analysis by using BLAST online platform and multiple molecular biology software.【Result】 The 12S rRNA gene PCR amplification of 5 female ticks were all positive, and 4 segment of 12S rRNA gene sequence obtained by sequencing were identical. The similarity of12s rRNA gene sequence and GenBank12s rRNA gene sequences in the database were more than 99% using Blast analysis, and the top five gene sequences of the high similarity were, includingfrom Xinjiang sheep. In this study, the12S rRNA gene sequence was submitted to the GenBank database and obtained the login number of MG744514. The phylogenetic tree from GenBank database,,,,,,,,,and12S rRNA gene sequence display, the12S rRNA gene sequence obtained in this study was closest within the evolutionary relationship and clustered in the same small branch.was identified asPCR amplification of all eggs16S rRNA gene and 5 oviposit female, 1and its eggs samples were positive, and the tick carrying rate was 20%. The sequencing results of 16S rRNA in femaleand its eggs were identical. The similarity was more than 99% of the16S rRNA gene sequences in the GenBank database using Blast analysis. The top five genes of high similarity were 4and 1sp, including theof theandfrom Xinjiang in 2011. In this study, the16S rRNA gene sequence was submitted to the GenBank database and obtained the login number of MG744513. Evolutionary tree of 3716S rRNA gene sequences belonging to 24 species from the GenBank database showed, the16S rRNA gene sequence obtained in this study was closest within the evolutionary relationship and clustered in the same small branch, belonging to the speckle thermal groupwith the other 15 kinds of rickettsia.and its eggs carriedofspotted fever group. 【Conclusion】were first found inand its eggs.
; eggs;;Xinjiang
2018-01-05;
2018-03-16
国家自然科学基金(31460655)、大学生创新创业训练计划(107572017009,107572017014)、新疆生产建设兵团塔里木畜牧科技重点实验室开放课题(HS201501,HS201801)
刘永宏,E-mail:lyhdky@126.com。通信作者赵丽,E-mail:zhaolidky@126.com
10.3864/j.issn.0578-1752.2018.15.0017

