人快速型肌球蛋白结合蛋白C原核表达载体的构建及表达
俞立强 陈瑜珏 张乐驰 蒋建华 方琪
作者单位:215000 苏州大学附属第一医院神经内科
炎性肌病(inflammatory myopathies,IM) 是一组亚急性、慢性或急性获得性异质性肌肉疾病,其共同特点是中至重度的肌无力及炎性细胞浸润[1-2]。现阶段根据IM临床表现、免疫病理方面、组织学表现、预后标准以及对于治疗不同程度的反应,将其分为多发性肌炎(polymyositis,PM)、皮肌炎(DM)、坏死性肌炎(NAM)及包涵体肌炎(sIBM)四种亚型[3-4]。由于IM的异质性、复杂性和病程的迁延性,IM临床研究受到多方面的限制。PM是一种慢性自身免疫性肌炎,其主要影响横纹肌。最主要的发病机制是免疫学说,但到目前为止引起异常免疫反应的具体抗原仍不清楚。实验性自身免疫性肌炎(experimental autoimmune myositis,EAM)是研究PM病理机制的重要动物模型,而目前该模型的制作多是以骨骼肌部分纯化的肌球蛋白作为抗原[5-8]。作为抗原的骨骼肌可以来源于兔、豚鼠以及人等不同物种。通过注射同种或异种部分纯化的肌球蛋白可以在大鼠、小鼠、豚鼠和兔等动物诱发肌炎。近几年日本学者采用纯化的肌球蛋白结合蛋白C(myosin-binding protein C,MyBP C)以及百日咳毒素、完全弗氏佐剂对B6小鼠进行背部、足趾等多点注射进行免疫,成功制作了EAM小鼠模型[9];且相比之下, MyBP-C2所诱发制作的模型组织病理学改变更为严重。本文作者尝试用MyBP-C2诱导出以CD8+T细胞炎性渗出为特征的EAM小鼠模型,为后续的一系列研究奠定基础。因此,本研究构建载体所表达的MyBP-C2作为IM动物模型的重要免疫诱导物,对于IM、PM的发病机制研究、未来靶向性治疗PM的研究方向有着重要的意义。本研究拟通过构建MyBP-C2原核表达载体 pET28a-MYBP-C2,进而纯化制备得到融合蛋白,期望为后续所需要构建的IM实验动物模型提供了良好的物质基础。
1 材料和方法
1.1材料pET28a(Novagen公司),限制性内切酶(Fermentas公司),marker(Zoonbio公司),四甲基乙二胺(TEMED,Thermo Fisher公司)、 Biologic LP层析系统、Mini Protean Ⅱ垂直平板电泳系统、Gel Doc2000成像系统、水平电泳系统(BIO-RAD公司),Tyrptone、Yeast Extract(OXOID公司), PCR 反应管(Fisher 公司), Agarose(上海基因公司),DNA 胶纯化试剂盒、质粒小提试剂盒(AXYGEN公司)。Allegra 21R台式高速冷冻离心机(BECKMAN公司),台式高速离心机(SORVAL公司),PTC-200基因扩增仪(MJ Research 公司),320-S pH 计(Mettler Toledo 公司),AR5120 电子天平(AHOM S公司),MultiTemp Ⅲ恒温水浴锅、Hofer ΜV-25紫外透射仪(Amersham Pharmacia公司),雪花状制冰机(SANYO公司),JY92-2D 超声波细胞粉碎机(中国新芝科技研究所),超净工作台(中国苏净集团)。
1.2方法
1.2.1目的基因的扩增:以人骨骼肌cDNA为模板,用F、R引物进行PCR扩增获得目的基因。参照GeneBank收录的人骨骼肌MyBP-C2的基因序列,设计MyBP-C2蛋白编码基因的PCR引物,然后在5′端引入NcoⅠ酶切位点,3′端引入XhoⅠ酶切位点。上游引物MYBPC2NcoIF(F引物):5′-ATATCCCATGGGCGACCTGACCCTCAAGTGG TTC-3′,下游引物MyBP-C2XhoIR(R引物):5′-ATATCCTCGAGCAGCCAGGTAGCGACGGG AGG-3′。反应体系:2.5 mmol/L dNTP mixture 1 μL,10×PCR Buffer 5 μL,Human MYBPC2 cDNA 0.1 μL,上、下游引物各0.5 μL,Pfu高保真DNA聚合酶1 μL,ddH2O 41.9 μL。PCR的反应程序如下:95 ℃预变性 5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共循环25次,最后于72 ℃延伸5 min。使用1%琼脂糖胶对PCR产物进行电泳分离,并进行切胶回收纯化。PCR扩增所得到MyBP-C2片段约为891 bp大小。
1.2.2表达载体的构建及鉴定:将目的基因的片段与pET28a质粒相连接,并筛选出阳性表达目的基因的质粒。分别将回收纯化的MyBP-C2目的基因片段和pET28a(+)质粒作NcoⅠ和XhoⅠ双酶切反应,37℃反应2 h。扩增产物经1%琼脂糖凝胶电泳检测,在近1000 bp处可见一条特异性条带,酶切产物在l%琼脂糖凝胶中电泳,回收目的片段,作下一步的连接反应。 于16℃在T4 DNA Ligase酶作用下反应2 h,获得连接产物pET28a-MYBP-C2基因片段。将连接产物转化到Top10感受态细胞中,将大肠杆菌BL21(DE3)菌液均匀涂布于含50 μg/mL卡那霉素(Kan)的LB平板上,37℃生化培养箱过夜培养。取菌液以PCR法鉴定含有目的基因的阳性克隆,PCR产物以含溴化乙啶(EB)的1%琼脂糖凝胶电泳分离,UVP凝胶成像系统成像。挑取阳性克隆,提取重组质粒pET28a-MYBPC2,经NcoⅠ与XhoⅠ双酶切后,对插入片段的DNA测序鉴定。采用BLAST分析,与Genebank中公布的MYBP-C2序列进行比对。测序由江苏省弗泰生物科技有限公司完成。
1.2.3融合蛋白的表达:将构建好的表达质粒pET28a-MYBP-C2转化到BL21(DE3)表达菌,挑取阳性单菌落接种于4 mL含氨苄青霉素和卡那霉素的LB液体培养基中,振荡培养过夜;次日以1︰100比例扩大培养,于37℃以220 r/min振荡培养2~3 h,使其D(λ)600mmol/L达到0.4~0.8,加入异丙基硫代半乳糖(IPTG)至终浓度为0.5 mmol/L,于25℃以180 r/min振荡培养5 h。于4 ℃以8000 r/min离心3 min后收集菌体,超声裂解以破碎细胞。裂解后,以12 000 r/min离心5 min,取上清进行SDS-PAGE电泳,分析各层析组分。用BL2l(DE3)pET28a空载体作为对照,分别对上清、沉淀、对照进行了SDS-PAGE电泳。目的蛋白相对分子质量约32 700,与His标签融合表达后相对分子质量约为37 500。目的蛋白在上清和沉淀中均有表达,沉淀中表达量较高。
1.2.4融合蛋白的纯化:将已转化有pET28a-MYBP-C2表达质粒的BL21(DE3)表达菌,接种阳性选择的单菌落于4 mL含氨苄青霉素和卡那霉素的LB液体培养基中,振荡培养过夜;次日以1︰100比例扩大培养,于37℃以220 r/min振荡培养2~3 h,使其DOD600mmol/L达到0.4~0.8,经IPTG诱导表达后,离心收集细菌,超声裂解,离心取上清,分别加人1 mL能够结合带His标签目的蛋白的Ni-NTA beads,进行层析纯化,洗脱样品进行SDS-PAGE电泳分离、洗脱,用离心过滤方法浓缩,乙醇沉淀,重复洗涤去除内毒素,得到纯化的MyBPC2融合蛋白。
2 结果
2.1目的基因扩增及表达载体的构建及鉴定PCR扩增得到891bp的产物,经1%琼脂糖凝胶电泳检测,在近1000 bp处可见一条特异性条带,大小与预期一致,表明PCR已成功扩增MyBP-C2目的片段。
测序结果BLAST分析,插入片段的序列与Genebank中公布的序列完全一致(测序图谱省略)。这表明基因MYBP-C2已成功克隆至原核表达载体pET28a中,重组质粒pET28a-MYBP-C2构建成功。
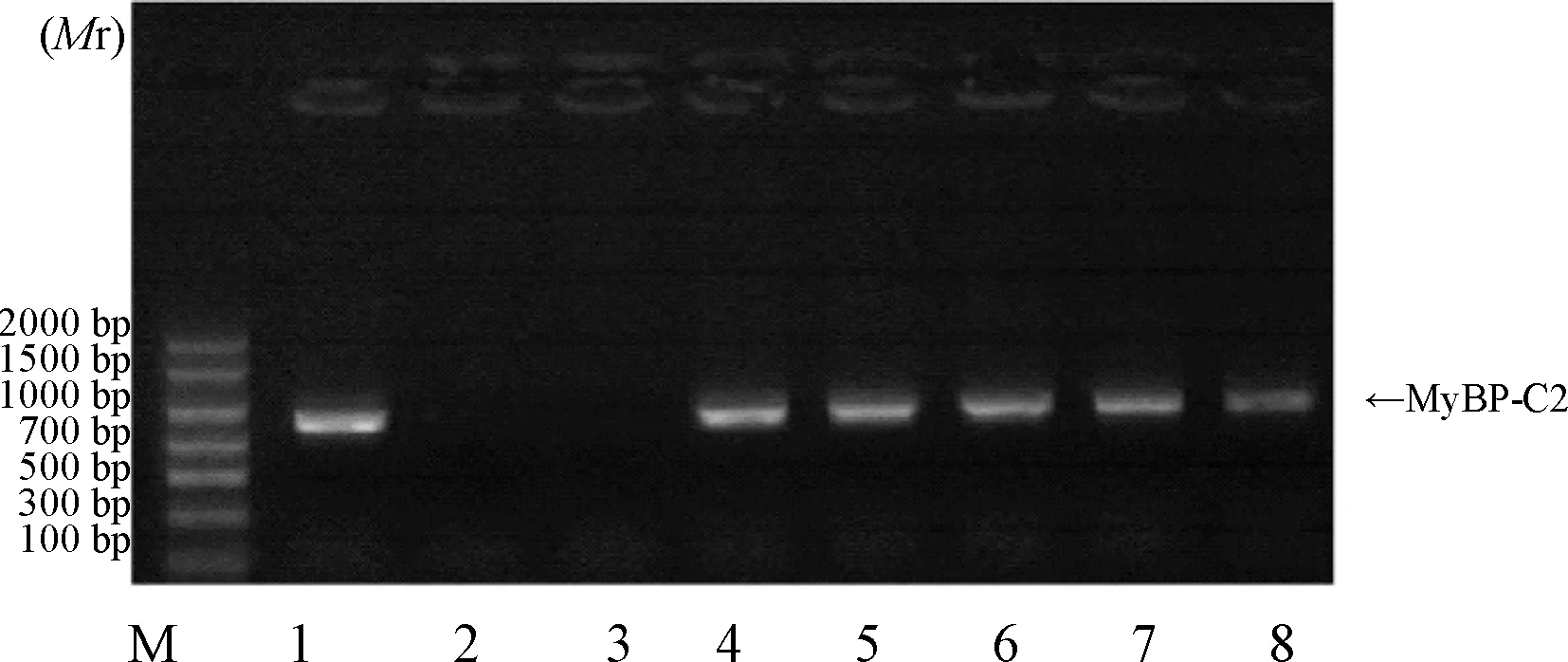
注:M:DNA Marker;1,4-8:阳性克隆(即MyBP-C2的PCR产物);2、3:阴性克隆 图 1 PCR扩增所得MyBP-C2片段
2.2融合蛋白的表达与纯化结果显示,融合蛋白条带大小在34 000~43 000之间(图2),表明已成功纯化得到目的蛋白。经纯化最终得到浓度为0.679 g/L的融合蛋白7.18 mg(图3)。
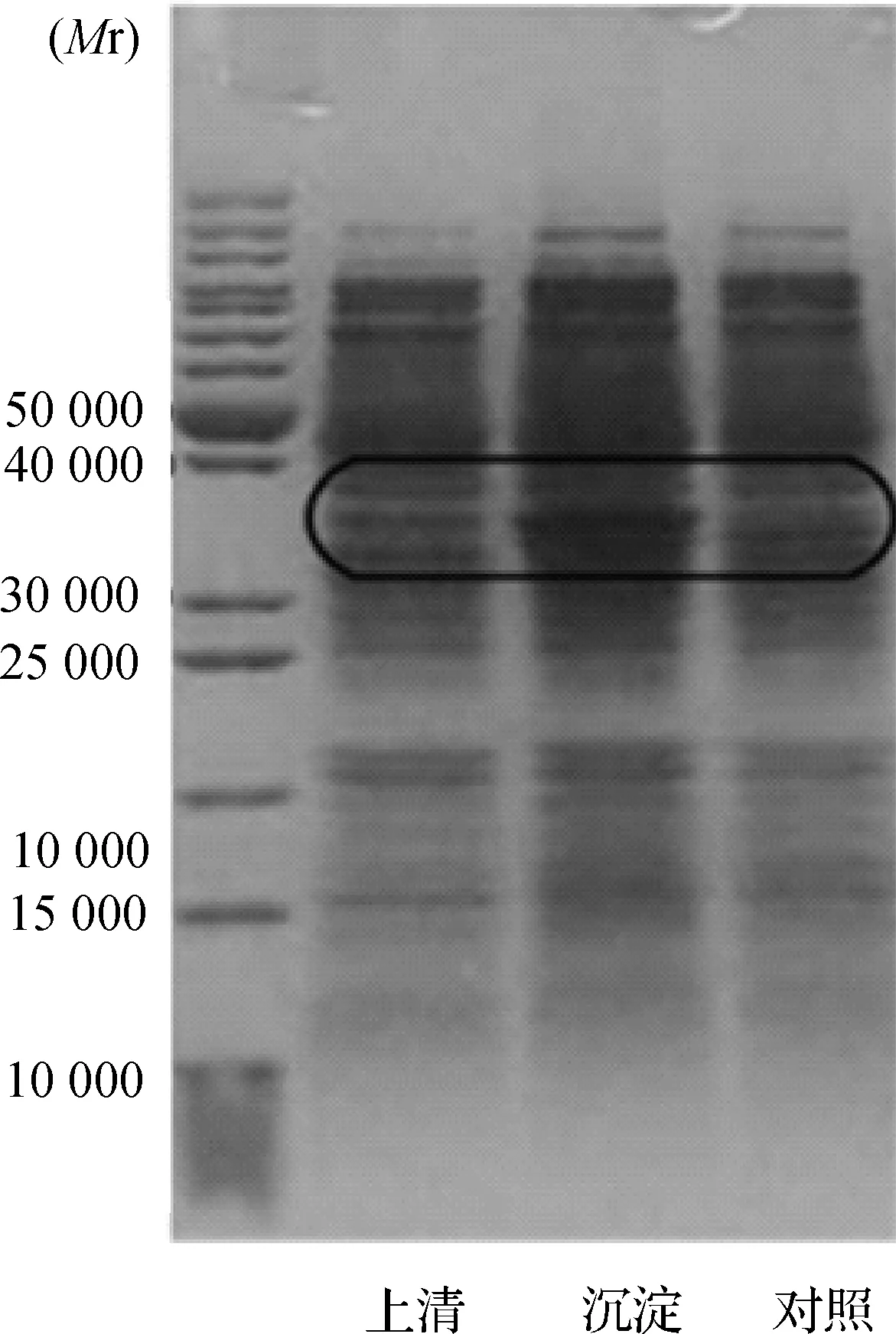
图 2 重组pET28a-MYBP-C2融合蛋白的表达(中间黑框为目的蛋白)

注:M:DNA Marker;1:上样;2:流出;3:50 mmol/L 咪唑1;4:50 mmol/L咪唑2;5:100 mmol/L 咪唑;6:150 mmol/LM 咪唑;7:250 mmol/L 咪唑;8:500 mmol/L 咪唑 图 3 BL21(DE3)-pET28a-MYBPc2融合蛋白的纯化。其中目的蛋白以150 mmol/L咪唑洗脱获得较高纯度蛋白
3 讨论
本实验在国内外学者及专家研究的基础上改进了MyBP-C2融合蛋白的表达和纯化体系且获得了良好的结果。
现对于IM的研究模型使用最多的为EAM,它是由肌匀浆或部分纯化的肌球蛋白免疫SJL/J小鼠获得的IM模型[8-9]。这种模型是PM的复杂表现,因为SJL/J小鼠有dysferlin基因变异从而导致自发性肌肉坏死和继发的肌肉炎性反应[10]。免疫组化研究已经显示坏死肌肉中的主要浸润细胞是CD4+T细胞,这表明EAM动物模型是由CD4+T细胞介导[11]。而现有研究表明,PM的发病机制是由以CD8+T细胞为主介导的细胞免疫导致,故需要一个更加符合PM发病机制的EAM动物模型以进行相关研究。
肌球蛋白结合蛋白C(myosin-binding protein C,MyBP-C或C-protein)位于横纹肌肌原纤维A带的横桥承载区[12-13],可用于介导新型动物模型[7]。生物化学纯化研究显示MyBP-C是利用Lewis大鼠诱导实验性肌炎动物模型时的原始骨骼肌肌球蛋白中的主要免疫成分[14-15]。肌小节是肌肉执行收缩功能的基本单位,有粗肌丝和细肌丝之分,包括MyBP-C、肌球蛋白结合蛋白H(MyBP-H)、肌球蛋白结合蛋白X(MyBP-X)等几种形式。其中MYBP-C只存在于横纹肌组织中。MYBP-C2是人肌球蛋白结合蛋白C的成员之一,这个家族还包括肌球蛋白结合蛋白C1(慢型)和C3(心肌型)[16]。MyBP-C相对分子质量为140 000,一级结构含1411个氨基酸残基,包含7个免疫球蛋白结构域,3个3型纤连蛋白,以及1个肌球蛋白结合蛋白基本序列[17]。MyBP-C2通过和肌球蛋白丝和肌动蛋白丝之间的相互作用,对粗肌丝的正确装配和稳定、调节横桥的形成和肌纤维的收缩起着重要作用[15,18]。
日本学者将MyBP-C2的基因与组氨酸(His)标签的PQE-30质粒连接形成重组基因并进行表达,再用镍柱纯化所表达的融合蛋白[7]。本实验前期也曾采用pQE-30质粒作为表达载体,表达质粒pQE-30-MyBP-C2构建成功,但在不同温度、不同IPTG浓度、不同诱导时间下,目的蛋白均没有得到成功表达;之后本文作者研究团队改用PET-28a载体对MyBP-C2蛋白进行原核表达。万娟等[19]的研究表明,pET-28a载体是经改造优化的带有His标签的原核表达载体,具有可溶性表达效率高、分离纯化简单等特点,使用了此载体,并对温度、IPTG诱导浓度以及诱导时间等相关条件进行摸索,确定了融合蛋白的表达条件并成功获得了融合蛋白。
目前国内张寅丽等[20]根据NCBI公布的人MYBPC2信使RNA序列(Gene ID:4606),设计出的引物为:上游引物序列为“5′-GACCTGACCCT.CAAGTGGrrrC-3′”。而本研究中的引物为参照GeneBank收录的人骨骼肌MyBP-C2的基因序列,设计出上游引物MYBPC2NcoIF(F引物):5′-ATATCCCATGGGCGACCTGACCCTCAAGTGG-TTC-3′,下游引物MyBP-C2XhoIR(R引物):5′-ATATCCTCGAGCAGCCAGGTAGCGACGGG-AGG-3′。由于所用引物的不同,实验中选取的酶切位点也不相同。在本次实验研究的融合蛋白纯化过程中,利用了多重梯度浓度的咪唑以洗脱,所得蛋白的纯度明显高于张寅丽等[20]的研究中所得到的蛋白纯度。
综上,本实验成功的扩增了MyBP-C2的全长cDNA,并将其连接至原核表达载体pET28a。确立了 pET28a-MyBP-C2融合蛋白的最佳诱导条件并纯化获得了pET28a-MyBP-C2融合蛋白,为下一步诱导建立新型EAM的动物模型奠定了坚实的基础,同时为研究自身免疫性肌炎的发病机制及治疗方法等诸多方面提供了新方法。

