CDX2基因通过NF-κB信号通路抑制结肠癌细胞增殖
陈 鳞 王恩湘 刘群友 钟 鹰 周国良 赵喜雁
近年来由于基因、蛋白质等生物工程的发展使得结肠癌在早期诊断和治疗方面有了新的突破,但结肠癌仍居我国各类恶性肿瘤死亡原因的前五位[1],其发生发展涉及到多种抑癌基因的失活和致癌基因的激活等复杂过程,目前对其发病机制还不是完全清楚。尾侧型同源转录因子2(Caual type homobox transcription factor 2,CDX2)是同源盒基因(Homobox genes,Hox genes)家族中的成员,不仅能调节肠上皮细胞的增殖、分化以及维持肠上皮细胞的表型,而且对消化道上皮细胞的发育起着关键作用[2]。目前研究发现CDX2的功能涉及肿瘤细胞周期、凋亡、增殖、迁移、侵袭,提示CDX2基因在肿瘤中起重要的作用[3-5]。CDX2基因是否与结肠癌细胞增殖和cyclin D1、核因子-κB(Nuclear factor-kappa B,NF-κB)信号通路有关,目前尚不清楚。本研究旨在探讨结肠癌HT-29细胞过表达CDX2基因前后HT-29细胞增殖能力变化及与NF-κB信号通路的关系。为揭示CDX2抑制结肠癌发生、发展机制提供实验依据。
1 材料与方法1.1 材料与试剂
1.1.1 细胞培养 人结肠癌细胞株HT-29细胞购自中科院上海细胞所。用含有10%胎牛血清(杭州四季青公司)的RPMI1640培养基培养,培养瓶放置于37℃、充分饱和湿度、含5% CO2的培养箱内培养,每2~3天传代1次,取对数生长期细胞用于实验。
1.1.2 试剂 RT-PCR试剂购自美国Invitrogen公司;CDX2为兔抗人单克隆抗体购自北京中杉金桥有限公司;G418购自美国AMRESCO公司;NF-κB抗体、p-NF-κB抗体购自CST公司;LipofectamineTM2000购自美国Invitrogen公司;真核表达质粒pcDNA3.1-CDX2、空载体pcDNA3.1由本校实验室长期保存。
1.2 实验方法
1.2.1 实验分组及细胞转染 实验阳性对照组:正常结肠黏膜;未转染组:HT-29细胞;空白质粒组:pcDNA3.1/HT-29细胞;转染组:pcDNA3.1-CDX2/HT-29细胞。具体转染方法:细胞转染与筛选在6孔板中常规培养,培养至达到80%左右细胞融合度;以Lipofectamine转染试剂分别介导1.2 μg重组质粒pcDNA3.1-CDX2和阴性对照空白质粒pcDNA3.1转染HT-29细胞。细胞转染9 h后换液,转染24 h后,按照1∶4传代,接种于24孔板中,待细胞贴壁生长后用G418进行抗性克隆筛选,直至获得稳定的细胞株,分别获得pcDNA3.1-CDX2/HT-29细胞、pcDNA3.1/HT-29细胞。
1.2.2 RT-PCR 实验在35 mm培养皿中常规培养pcDNA3.1/HT-29细胞及pcDNA3.1-CDX2/HT-29细胞和HT-29组细胞,按照TRIzol说明书提取总RNA。应用Revert Aid First Strand cDNA Synthesis Kit将总RNA逆转录为cDNA。CDX2引物F:5′-CTACATCACCATCCGGAGGAA-3′,R:5′-CTCCTTTGCTCTGCGGTTCT-3′;产物大小339 bp;β-actin引物F:5′-ACACCCCAGCCATGTACGTT-3′,R:5′-CGTCACCGGAGTCCATCAC-3′;产物大小598 bp。取3 μL cDNA按常规操作进行PCR产物扩增,并使用1%非变性琼脂糖凝胶电泳检测。
1.2.3 Western blot分析 分别选取转染实验处理的细胞,细胞裂解液提取总蛋白,用BCA法进行蛋白量测定,取40 g用不连续SDS-PAGE凝胶电泳,蛋白转移至硝酸纤维素膜,丽春红S染色,5%脱脂牛奶封闭2 h,加入CDX2抗体、NF-κB抗体、p-NF-κB抗体和β-actin抗体,均按1∶200稀释,4℃过夜,辣根过氧化物酶标记的二抗孵育4 h,然后用Millipore发光液显色。以β-actin为内参。
1.2.4 MTT法检测细胞增殖 分别选取对数生长期的3组细胞,以1×104个/孔的细胞密度接种于96孔板中。分别在培养0,1,2,3,4,5,6,7 d后,每孔加入MTT溶液(5 mg/mL)20 μL,继续培养4 h后小心吸出孔内培养液;每孔加入150 μL DMSO,振荡至结晶充分溶解,选择490 nm波长,在酶标仪上测定各孔吸光度值。以接种当天MTT吸光度值为起始点,以时间为横轴,吸光度值为纵轴绘制细胞生长曲线。
1.2.5 流式细胞仪分析 分别选取对数生长期的3组细胞,用70%乙醇固定,放置-20℃冰箱中过夜,PBS洗2遍,依次加入50 μg/mL碘化丙啶和1 mg/mL RNaseA,室温避光孵育30 min后进行检测。
1.3 统计学分析
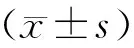
2 结果
2.1 RT-PCR检测转染CDX2基因对HT-29细胞CDX2 mRNA的影响
RT-PCR结果发现转染组pcDNA3.1-CDX2/HT-29于339 bp有明显的条带,而未转染组HT-29和空白质粒组pcDNA3.1/HT-29在该位呈低表达,表明稳定转染细胞株pcDNA3.1-CDX2/HT-29存在CDX2 mRNA的过表达(P<0.05),并且与正常结肠黏膜细胞比较,CDX2 mRNA表达水平无统计学差异(P>0.05)(图1)。
2.2 Western blot检测转染CDX2基因对HT-29细胞CDX2蛋白的影响
以未转染组和空白质粒组为对照,转染组pcDNA3.1-CDX2/HT-29细胞中CDX2蛋白表达水平明显增加88%(P<0.05),并且与正常结肠黏膜细胞比较,CDX2蛋白表达水平无统计学差异(P>0.05)(图2)。
2.3 过表达CDX2基因对HT-29细胞生长的影响
MTT结果显示,与未转染组HT-29和空白质粒组pcDNA3.1/HT-29相比,转染组pcDNA3.1-CDX2/HT-29增殖受到抑制,细胞生长速度逐渐下降,其中48 h和72 h细胞生长抑制率分别为27.8%、33.4%(P<0.05)(表1,图3)。

图1 转染CDX2基因对HT-29细胞CDX2 mRNA的表达Figure 1 The mRNA expression of CDX2 in wild type and over-expression CDX2 HT-29 cellsNote:M:Marker;1:HT-29 cells;2:Normal colonic mucosa;3:pcDNA3.1 plasmid transected HT-29 cells;4:pcDNA3.1-CDX2 plasmid transfected HT-29 cells.*P<0.05,compared with 1 and 3.
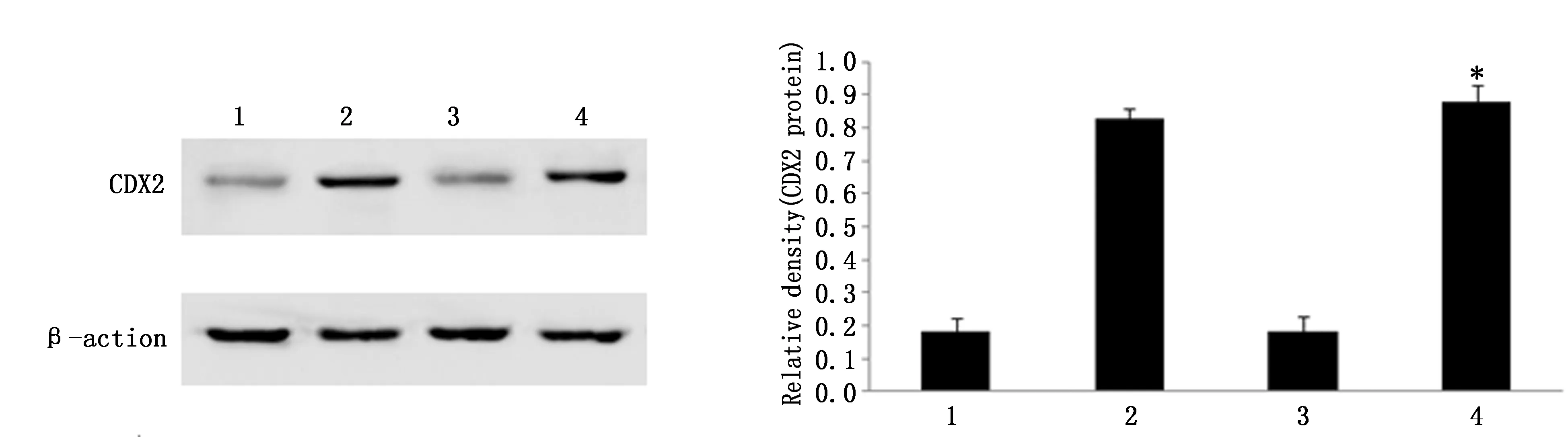
图2 转染CDX2基因对HT-29细胞CDX2蛋白的表达Figure 2 The protein expression of CDX2 in wild type and over-expression CDX2 HT-29 cellsNote:M:Marker;1:HT-29 cells;2:Normal colonic mucosa;3:pcDNA3.1 plasmid transected HT-29 cells;and 4:pcDNA3.1-CDX2 plasmid transfected HT-29 cells.*P<0.05,compared with 1 and 3.

GroupA490 valuesDay 1Day 2Day 3Day 4Day 5Day 6Day 7pcDNA3.1/HT-290.37±0.020.51±0.0250.66±0.0330.71±0.0320.83±0.0310.99±0.0511.22±0.041HT-290.37±0.020.47±0.021a0.59±0.032a0.68±0.035a0.78±0.048a0.93±0.053a1.13±0.053apcDNA3.1-CDX2/HT-290.37±0.020.44±0.018bc0.44±0.036bc0.46±0.043bc0.55±0.061bc0.59±0.062bc0.61±0.072bc
Note:Compared with the pcDNA3.1/HT-29 group at the same time.a.P>0.05;Compared with pcDNA3.1/HT-29 group at the same time,b.P<0.05;Compared with the HT-29 group at the same time,c.P<0.05.
2.4 过表达CDX2基因对HT-29细胞周期的影响
流式细胞仪分析细胞周期结果显示,与未转染组HT-29、空白质粒组pcDNA3.1/HT-29相比,转染组pcDNA3.1-CDX2/HT-29细胞G0/G1期细胞比例明显增加,而S期比例减少,差异有统计学意义(P<0.05)(表2)。
2.5 过表达CDX2基因对HT-29细胞Cyclin D1蛋白和NF-κB磷酸化水平的影响
Western blot分析结果显示,与未转染组和空白质粒组相比,过表达CDX2基因转染组HT-29细胞NF-κB表达上调(P<0.05),而Cyclin D1蛋白、p-NF-κB表达下调(P<0.05)。而未转染组HT-29和空白质粒组pcDNA3.1/HT-29比较NF-κB和p-NF-κB表达水平无统计学差异(P>0.05)(图4)。

表2 各组细胞周期比例的比较
Note:*P<0.05vs.HT-29 cells or pcDNA3.1/HT-29 cells group.
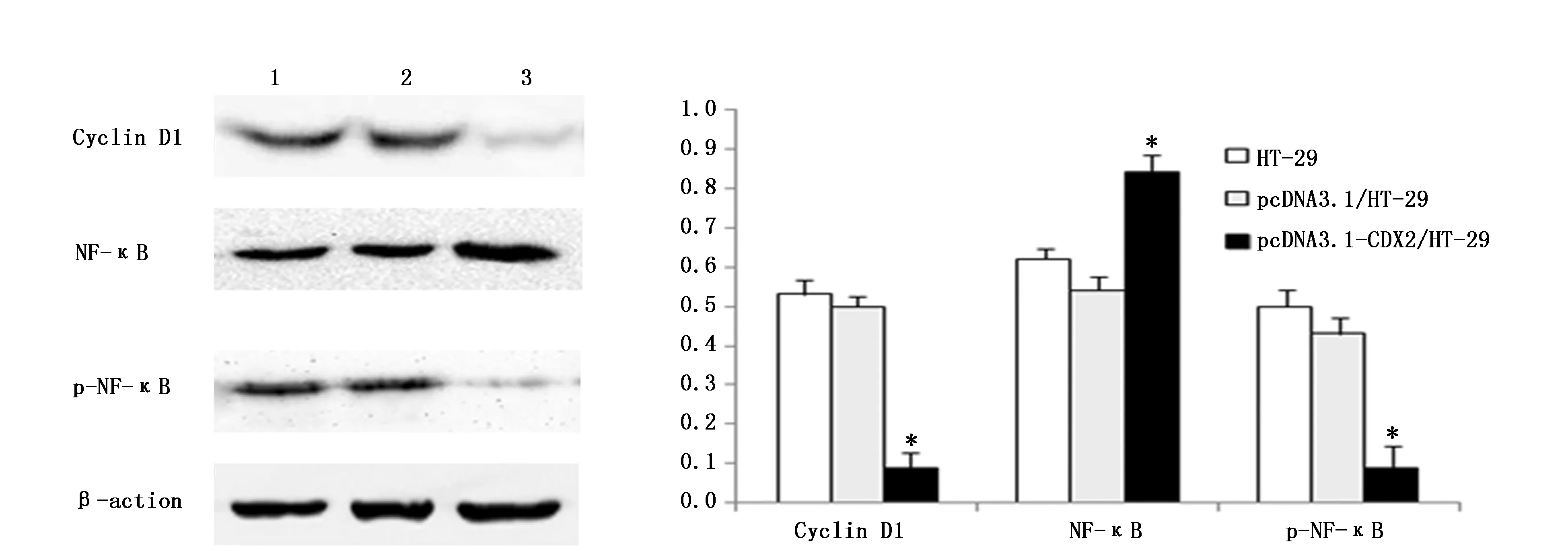
图4 过表达CDX2基因对HT-29细胞Cyclin D1蛋白和NF-κB的磷酸化水平的影响Figure 4 Effects of overexpression CDX2 gene on cyclin D1 protein and phosphorylation levels of NF-κB in HT-29 cellsNote:1:HT-29 cells;2:pcDNA3.1 plasmid transected HT-29 cells;3:pcDNA3.1-CDX2 plasmid transfected HT-29 cells.*P<0.05,vs. group 1 and 2.

图3 过表达CDX2基因对HT-29细胞生长的抑制作用Figure 3 Effects of over-expression CDX2 on proliferation of HT-29 cells
3 讨论
CDX2为CDX家族成员之一,位于染色体12q 12-13上,是一种肠特异性的转录因子,在胚胎发育肠道形成中起关键作用,并与细胞的凋亡、黏附、侵袭和迁移有关[2-5]。有研究发现当CDX2高表达时,它能同靶基因的启动子结合,促进靶基因表达,从而诱导胚胎极性的形成、器官的发生和组织的肠性分化,当CDX2低表达或不表达时,则促进细胞的增殖和加快细胞的代谢,并进一步导致肿瘤的发生[5-8]。Subtil等研究显示CDX2在结肠癌中的表达水平显著低于正常结肠组织,并随结肠癌恶性程度、异型性的增高而降低[9-10],亦发现CDX2通过上调SLC7A7基因的表达促进猪肠上皮细胞增殖[11]。而CDX2如何抑制结肠癌的发生目前机制仍未完全清楚,因此,本研究通过基因转染技术将CDX2过表达于人结肠癌细胞HT-29中,与未转染组和空白质粒转染组相比,CDX2基因转染组细胞的增殖速度明显下降;G0/G1期细胞百分比明显增加,处于S期的细胞百分数明显减少,这些结果提示CDX2基因可能诱导HT-29细胞的G1期阻滞,抑制结肠癌细胞的增殖。
众所周知,CDX2和NF-κB在细胞的增殖和凋亡中扮演着重要的角色,二者在结肠癌细胞增殖中同样起着重要的作用[12-13]。NF-κB是一类普遍存在的转录因子,由Rel家族中5种亚单位组成二聚体,其中最常见p65和p50组成的异二聚体,与许多基因启动子区域的核苷酸序列结合而启动基因转录,参与多种疾病的发病过程,不仅与细胞周期、增殖、凋亡、肿瘤血管形成、细胞间黏附、上皮间质转化及机体的免疫应答状态有关,而且还与肿瘤的发生发展和浸润转移有密切关系[12,14-18]。NF-κB通常以无活性的方式存在胞质中,受到某些基因刺激后p65磷酸化激活,其通路的异常激活可能导致一系列抑癌基因的异常表达,抑制肿瘤细胞的调亡、细胞的分化及肿瘤细胞的迁移[19]。研究NF-κB和CDX2蛋白之间在结肠癌细胞中是否存在相互作用,有助于更好探索结肠癌发生、发展的过程。本实验结果表明经基因转染后过表达CDX2基因HT-29细胞内NF-κB表达上调,p-NF-κB表达明显低于对照组,这些结果提示CDX2基因通过抑制磷酸化p-NF-κB的活性,抑制其对下游靶基因激活,进而导致肿瘤细胞增殖下降,与p-NF-κB表达呈负相关。这些实验结果提示CDX2通过与NF-κB相互作用,抑制NF-κB磷酸化,阻碍了NF-κB DNA复合体的形成,影响下游抑癌基因在人类结直肠癌中的表达,抑制结肠癌细胞的增殖。
目前研究表明细胞周期Cyclin Dl基因的启动子上存在与NF-κB结合的位点[20],同时还有研究显示NF-κB为Cyclin D1的上游基因,与周期蛋白启动子的抑制蛋白(Rb)位点结合后启动Cyclin D1基因转录表达,当NF-κB表达激活过程被阻滞后,其下游靶基因Cyclin D1基因的转录蛋白表达受抑制[21-22]。Cyclin D1是定位于人染色体11q13的CCND1基因编码,全长约15 kb,含有5个外显子和4个内含子,编码产物为Cyclin D1蛋白,该蛋白属细胞周期调节蛋白,是由295个氨基酸构成,分子量为34 kD,含量随细胞周期呈周期性变化,同时调控细胞周期G1期的关键蛋白,在调节细胞从G1期进入S期发挥重要作用。Cyclin D1已被公认为是一种原癌基因[32],其过度表达可致细胞增殖失控而导致肿瘤发生。研究发现在多种肿瘤中Cyclin D1基因过表达和基因扩增,包括结肠癌、乳腺癌、肝癌、食管癌等[20-25]。本研究结果表明转染后过表达CDX2基因HT-29细胞内Cyclin D1表达明显低于未转染组和空白质粒组,这些结果提示CDX2基因通过Cyclin D1影响细胞周期,从而抑制结肠癌细胞增殖。
综合上述,过表达CDX2基因能够抑制人结肠癌HT-29细胞增殖,诱导细胞G0/G1期阻滞,并能影响Cyclin D1、NF-κB在细胞中的表达,提示其可能是通过NF-κB信号通路抑制细胞周期蛋白Cyclin D1,抑制结肠癌细胞的增殖。推测如果使用NF-κB信号通路抑制剂再检测过表达CDX2基因的结肠癌细胞中Cyclin D1蛋白及细胞增殖能力,更能完善本课题的机制探索。

