幽门螺杆菌感染胃组织基因芯片生物信息学分析
付 伟,谢 东,班春梅,邓亚婕,代 芳,王 松,曹 洁
(解放军联勤保障部队 第925医院消化血液科,贵阳 550009)
目前幽门螺杆菌感染(Helicobacter pylori,HP)已经非常常见,平均大约50%的人群有感染[1],特别是在贫困地区,因为自然环境、饮食卫生条件、及民俗习惯等感染率会更高。HP感染者可能会导致慢性活动性胃炎,糜烂性胃炎,以及消化道溃疡等消化道疾病,甚至造成食管腺癌,胃萎缩,胃癌和结直肠癌的潜在治病因素[2]。目前对于HP感染已经有多种根治治疗方案,但由于耐药菌的增多,部分患者效果较差[3]。同时一部分感染者并不是都会出现炎性改变或者癌变,为了认识HP感染对于胃粘膜组织损伤的分子机制,设计了对于HP相关芯片的生物信息学分析。
1 材料和方法
1.1 芯片数据来源
从GEO网站下载相关的基因芯片数据(GSE5081)[4]。该芯片使用微阵列比较了HP阳性和HP阴性胃糜烂和正常相邻粘膜的全基因组基因表达谱,对HP感染后mRNA表达模式进行分析。从8例HP阴性糜烂性胃窦炎患者和8例HP阳性糜烂性胃窦炎患者的冷冻活检标本中提取总RNA。同时,从所有16名患者的邻近(距离侵蚀至少3 cm)肉眼可见的正常窦腔样品取样。其中本研究涉及HP阴性患者包括三名男性患者和五名女性患者,年龄为50~88岁(中位数67.5岁)。组织学炎症程度轻度6例,中度2例。其中两人患有肠化生。本研究涉HP阳性感染者年龄为32~75岁(中位数58.5岁),5名男性和3名女性患者。组织学炎症程度轻度3例,中度1例,严重4例。其中两人有中度萎缩,一人有局灶性肠化生。在内镜检查时,没有患者接受质子泵抑制剂或抗生素治疗。所有患者属于高加索人种族。他们都没有吸烟,还有其他已知的疾病。
1.2 芯片数据生物信息分析
首先芯片的质量评估[5],通过分组差异基因的筛选[6],并功能分析、注释。把组织样本分为4组,A) ER(+)HP(+),B) ER(+)HP(-),C) ER(-)HP(+),D) ER(-)HP(-),其中HP为幽门螺杆菌,而ER为损伤粘膜组织。分别分析受损组织,健康组织组内的HP感染与否的差异基因变化,最后合并分析。具体是A、B组进行了差异分析得到分析结果差异分析1。C、D组进行了差异分析得到分析结果差异分析2(Q值<0.05,Foldchange≥1.2,阈值设定为分析软件推荐值)。将两组获得的差异基因取并集,随后进行GO分析、通路分析,以及基因共表达网络分析,基因相互作用网络分析。
1.3 实时定量PCR验证
收集2016年1月至2016年6月,在解放军联勤保障部队第925医院 C14尿素氮呼气试验阳性者(CPM>100)为感染者,检测阴性者为健康对照各10例,考虑诊断为慢性糜烂性胃炎,并且在内镜检查时,没有接受质子泵抑制剂或抗生素治疗,排除其他疾病。感染者与对照组一般临床特征无统计学差异,均取受损黏膜组织,在获取胃黏膜组织后,使用Trizol试剂(Invitrogen,Carlsbad,CA)提取总RNA,然后进行反转录。 cDNA被适当稀释并用于PCR。使用SYBR Premix EX Taq(TAKARA)和ABI PRISM 7300实时PCR系统(Applied Biosystems,Life Technologies,Carlsbad,CA)以β-actin作为参考对照,一式三份进行实时PCR。引物由上海生工公司合成,CXCR4 引物上游:5’-CCTATGCAAGGCAGTCCATGT-3’,下游:5’CCTATGCAAGGCAGTCCATGT 3’,内参基因β-actin 引物:上游:5’-TGGCACCCAGCACAATGAA -3’,下游:5’-CTAAGTCATAGTCCGCCTAGAAGCA-3’。CXCL2上游引物:CGCAGCAGGAGCGCC 下游引物: TGGATGTTCTTGAGGTGAATTCC CXCL5 上游引物:GGAAGGAAATTTGTCTTGATCC 下游引物: TTTCCTTGTTTCCACCGTC。参与本研究的所有HP感染患者和正常人均已签署知情同意书,并通过医院伦理委员会批准。
1.4 统计方法
差异基因筛选主要利用文献的常用方法(Significance Analysis of Microarray,SAM)。两组间计量资料采用使用T检验(平均数±SD),计数采用卡方检验,p<0.05,有统计学差异。统计及分析软件使用spss23,以及GCBI在线实验室分析软件。
2 结果分析
2.1 芯片质量分析
总样本数量共31个。对获得的样本,首先进行质量分析,每张芯片的RLE(Relative Log Expression)计算了芯片信号值估计在整体芯片中的相对变化率,进而反映了所检测基因的变化特征。本芯片RLE一致性较高,芯片本身质量无问题(见图1)。质量较高的芯片,才有必要进行下一步的研究分析,否则需要舍去不合格的样本。

图1 基因芯片质量分析箱形图Fig.1 Quality analysis box chart
2.2 差异基因筛选
应用SAM法[7]分析在预先设定的分组下筛选具有显著性差异的基因。通过分析A,B组,得到在受损的胃粘膜组织,HP(+)vs HP(-)的差异基因1,共28个(见图2)。
通过分析C,D组,我们得到在健康的胃粘膜组织,HP(+)vs HP(-)的差异基因(见图3),共27个。同时两个差异基因集取并集获得上调差异基因44个。提示在HP感染后,这些基因的高表达与疾病的发生发展有关。
2.3 功能分析
基因功能注释的目的是发现这些差异基因在生物学功能,代谢途径中的地位和意义,研究基因表达调控网络,及其功能机制。Go分析[8]发现这些差异基因主要涉及免疫反应,炎症反应,抗原提呈,细胞间信号通路等,而KEGG信号通路分析[9],主要包括:细胞因子信号通路,因子受体相互作用,细胞粘附等通路。
2.4 核心节点基因网络分析
基因相互作用(Gene signal network)分析解构了KEGG数据库,突破限制获得单一信号通路中基因之间的相互作用。因此,可以获得一些基因的上下游分子关系。通过分析发现差异基因的相互作用:CXCR4,CCL20,CXCL13,CXCL3,CXCL5,CXCL2,HLA-DMA,HLA-DQA1,HLA-DPA1,HLA-DOA,HLA-DQB1存在有网络作用,其中核心分子为CXCR4(见图4)。
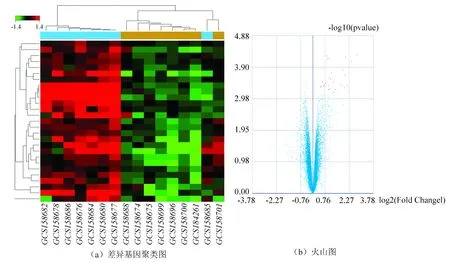
图2 A、B组差异分析1聚类分析和火山图Fig.2 Cluster analysis chart of Group A and B, volcano map in DEG1
注:(a)中红色代表上调基因,绿色代表下调基因(颜色详见电子版http://swxxx.alljournals.cn/ch/login.aspx.(2019年第1期));(b)中横坐标代表差异倍数,纵坐标代表P值均取log
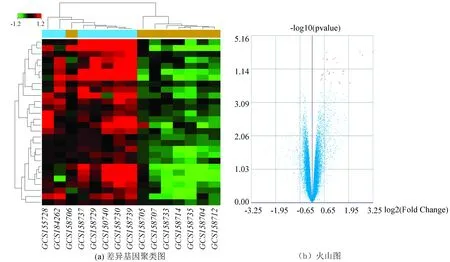
图3 C、D组差异分析2聚类分析和火山图Fig.3 Cluster analysis chart of Group C and D volcano map in DEG2
共表达网络清楚的揭示了两基因之间的关系,并找到调控网络的关键基因。这是通过基因间相关系数来拟合基因无标度网络关系实现的。分析基因共表达得到CCL20,PLEK,HLA-DMA,JAK3,BCL2A1,TNFAIP2,CXCL13,PTPRC,CXCL3,FGR,FAM65B,C3,CXCL5,MMP9,VNN2,ADAMDEC1,GZMK,TLR10之间共表达关系,其中重要的节点分子为CCL20,JAK3,TNFAIP2,PLEK,HLA-DMA,PTPRC,CXCL13,BCL2A1(见图5)。
2.5 实时定量PCR验证相关基因表达
通过实施定量PCR方法,验证在感染后的胃黏膜组织部分相关基因的表达情况。研究发现CXCR4,CXCL5,CXCL2在HP阳性的胃黏膜组织表达高于HP阴性对照组,且具有统计学意义(P<0.05)(见图6)。

表1 主要涉及GO基因分类(前10)Table 1 Top 10 GO mainly involved gene classification

表2 主要涉及的信号通路(前10)Table 2 Top 10 mainly involved signaling pathway

图4 基因相互作用网络图Fig.4 Gene interaction network diagram
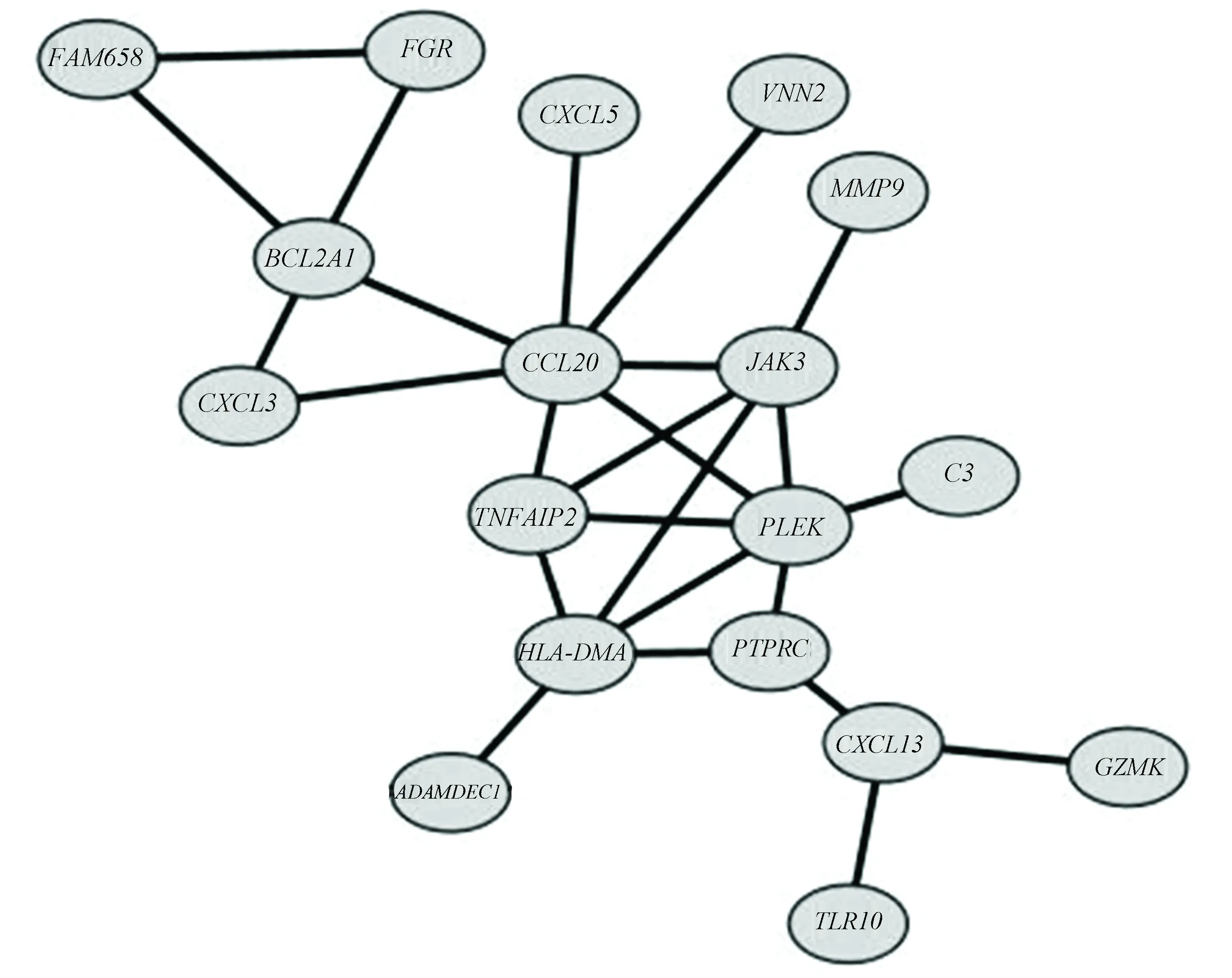
图5 基因共表达分析网络图Fig. 5 Gene co-expression network diagram
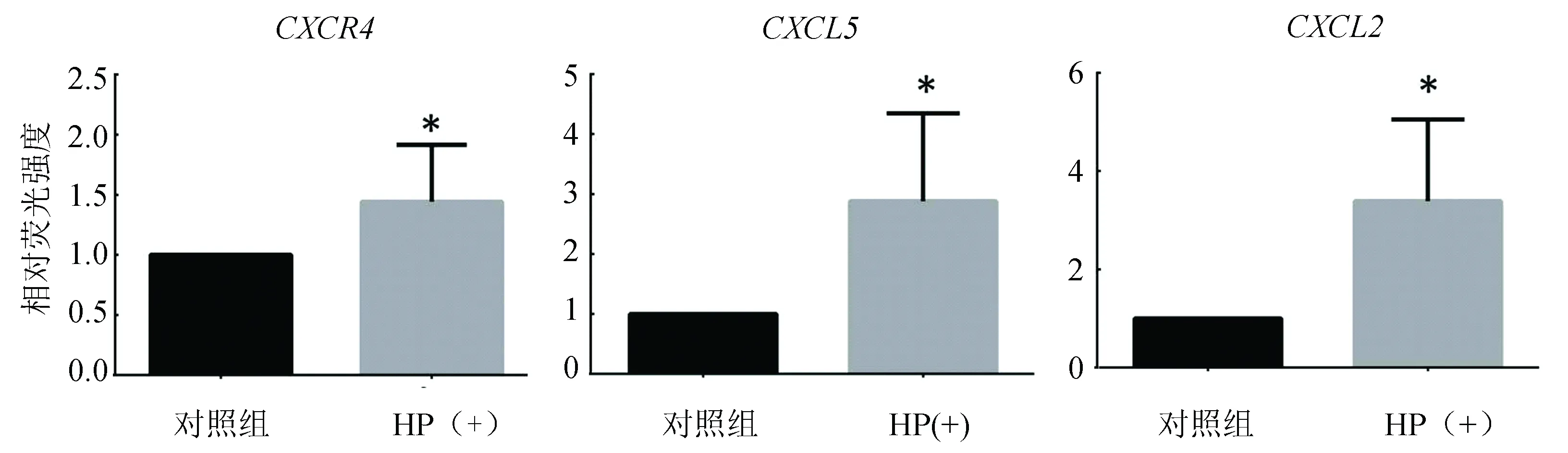
图6 实时定量PCR检测CXCR4,CXCL5,CXCL2在胃黏膜组织中的表达(*提示P<0.05)Fig. 6 Real-time quantitative PCR detection of CXCR4, CXCL5, and CXCL2 expression in gastric mucosa
3 讨 论
幽门螺旋杆菌是一种革兰氏阴性细菌,最初是由Warren和Marshall于1983在胃上皮的管腔表面发现,并分离出来,从第一次发现幽门螺杆菌,研究其与临床消化道疾病关系以来,已经经历三十多年[10]。 绝大多数HP感染患者不会有任何临床意义上的表现,仅仅在部分患者当作引起消化道疾病治病因素,其中毒力因子空泡毒素(VacA)[11],细胞毒素相关基因A (CagA)[12]被认为是重要的治病因素。为了认识该细菌,以及了解其致病机制,做了许多研究,包括体内以及体外研究。
目前发现幽门螺杆菌与消化道疾病关系紧密,但同时与心血管疾病,贫血,脑梗,糖尿病等疾病均有关联[13-16]。为了进一步认识幽门螺杆菌对胃粘膜组织的分子层面影响,分析幽门螺杆菌相关芯片。Go分析:主要涉及免疫反应,炎症反应,抗原提呈,细胞信号通路等。Pathways通路分析:提示主要涉及的信号通路包括:细胞因子通路,因子受体关联,细胞粘附分子等。
基因相互作用分析中发现重要的CXCR4基因,与趋化因子的互相作用,在人类发育、免疫应答、癌转移均起到了重要的作用。已经有临床研究证明CXCR4在HP患者当中高表达[17],部分的HP感染患者可能会引起消化道肿瘤,CXCR4与消化道肿瘤的高表达有关系[18],这是否和CXCR4的过度激活有关?同时在已有研究中发现胃淋巴瘤观察到CXCR4和Ki-67表达之间的相关性,并提示CXCR4可作为诊断和治疗MALT型胃淋巴瘤潜在靶点[19]。不仅如此,近年来研究表明在慢性幽门螺杆菌感染过程中,骨髓间充质干细胞迁移到胃组织,也可能是胃腺癌的起源[20]。
基因共表达分析中重要的节点分子为趋化因子CCL20[21],CXCL13[22],CXCL5[23],CXCL2[24]以及其他包括增殖,炎症,免疫,凋亡相关重要分子JAK3,TNFAIP2,PLEK,HLA-DMA,PTPRC,BCL2A1的激活,而这些基因与胃癌的发生发展有密切关系[25-28]。有研究证实幽门螺杆菌诱导的STAT3激活直接上调JAK3,可能有助于胃癌的发生和发展[25]。为了进一步验证分析相关分子的表达情况,进行了实时定量PCR实验验证,CXCR4,CXCL5,CXCL2在幽门螺杆菌感染后的胃黏膜组织均高于对照组,更多的机制探讨需要进一步实验验证。
4 结 论
幽门螺杆菌感染后,存在多个信号通路的激活,包括炎症,免疫反应,细胞凋亡信号,而后出现组织细胞修复、增殖活化等。而这些在组织细胞间异常表达的基因,提示我们是否可能通过相关信号通路药物,从而避免幽门螺杆菌感染所造成的严重后果,同时也给我们提供了进一步研究的方向。

