子痫前期孕妇外周血sFlt-1、PIGF、PP-13、sEng的表达及其与子宫动脉血流的相关性研究
颜露春 朱广源 李小林 叶蔚
子痫前期(preeclampsia, PE)是一种常见的产科并发症之一,其发病机制复杂,起源于胎盘,以滋养细胞浅侵入母体子宫螺旋动脉重铸不足为特征[1],可累及全身各系统各脏器,但具体病因至今尚未完全阐明。目前认为母体血管内皮损伤及胎盘滋养层细胞功能障碍为子痫前期的主要致病因素[2]。基于PE起源于胎盘的病理解剖特点,在子痫前期的病理进程中,子宫动脉的重铸存在显著异常,血管的阻力较高、血供相对不足[3-4]。子宫动脉多普勒指数改变与子痫前期/血管阻力增加与子痫前期及胎儿生长受限(fetal growth restrict,FGR)发生有关[5],并能反映妊娠早期滋养细胞侵入程度[6]。本研究评价子痫前期胎盘来源的血管生长因子-胎盘生长因子(placental growth factor, PIGF)、胎盘蛋白 13(placental protein ,PP-13)及其衍生物可溶性血管内皮生长因子受体1(soluble Fms-like tyrosine kinase 1,sFlt-1)、可溶性内皮糖蛋白(soluble endothelial glycoprotein ,sEng)的表达及其与子宫动脉血流收缩期与舒张期流速比(S/D)和搏动指数(pulsatility index, PI)、阻力指数(resistance index, RI)的相关性,探讨它们在子痫前期子宫动脉血流中的作用。
对象与方法
一、研究对象
选择2015年6月—2017年6月在广东医科大学附属医院行常规产前检查并诊断为妊娠期高血压疾病的孕妇87例。入组条件包括:(1)单胎;(2)年龄18~45岁的初产妇或经产妇;(3)符合子痫前期或妊娠期高血压的诊断标准[7],子痫前期组42例,妊娠期高血压组45例。选取同期18~45岁的单胎健康孕妇为对照组80例。所有孕妇均已签署知情同意书,同意其废弃的血清标本用于本研究。
二、方法
1. 临床资料分析:收集各组孕妇的基本临床信息,包括年龄、孕周、孕产次、体质指数(BMI)、合并症、妊娠结局等。
2.诊断标准:妊娠期高血压及子痫前期的诊断标准参照全国高等教育教材《妇产科学》(第8版)[7]。妊娠期高血压:孕20周后血压≥140/90 mmHg,尿蛋白阴性或24小时尿蛋白定量<0.3 g/L。子痫前期:妊娠20周后首次出现收缩压≥140 mmHg或舒张压≥90 mmHg,蛋白尿即尿蛋白≥0.3 g/24 h。
3.血清中sFlt-1、PIGF、PP-13、sEng水平检测:孕妇在住院时抽取外周静脉血5 ml,置于含有乙二胺四乙酸(EDTA)抗凝剂的试管内,-70 ℃储存待测。于检测前1 d置于4 ℃冰箱缓慢融化。采用电化学发光免疫分析法检测sFlt-1、PIGF、PP-13、sEng水平(Roche cobas E 610型免疫分析仪,试剂盒均由南京圣比澳生物科技有限公司提供,产品按照说明使用。
4. 多普勒超声检查评估母胎血液动力学:采用PHILIPS IE33彩色多普勒超声诊断仪检查,探头频率3.5 MHz,均采用仰卧位,充分暴露腹部,在孕妇腹部子宫体、子宫颈交界处,使用彩色多普勒超声显示子宫动脉,观察双侧子宫动脉血液情况。使用脉冲多普勒模式进行取样,取样线与血管夹角应小于30o,取样容积2 mm。根据脉冲多普勒频谱数据分别测量子宫双侧动脉舒张末期(diastolic peak velocity,Vd)和收缩期最大血液流速(systolic peak velocity,Vs)、搏动指数(PI, PI=S-D/Vm)和阻力指数(RI, RI=S-D/S)及Vs和Vd的比值(S/D),同时观察孕妇动脉舒张早期“V”切迹情况,每次数值进行3次测定取平均值,记录每位孕妇的测量数据。
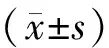
结 果
一、研究对象一般特征
各组孕妇年龄、产次、孕前体质指数(BMI)比较,差异均无统计学意义(P>0.05)。子痫前期组分娩孕周及新生儿出生体质量均低于妊娠期高血压组与对照组,两组比较,差异均有统计学意义(P<0.05),见表1。
二、各组血清sFlt-1、PIGF、PP-13及sEng水平比较
子痫前期组血清sFlt-1、PIGF、PP-13、sEng与对照组比较,差异均有统计学意义(P<0.05);子痫前期组sFlt-1、sEng与妊娠期高血压组比较,差异均有统计学意义(P<0.05);妊娠期高血压组PIGF、PP-13、sEng与对照组比较,差异均有统计学意义(P<0.05),见表2。
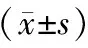
表1 研究对象一般特征
Note:*Compared to control,P<0.05;#Compared to Gestational hypertention,P<0.05

表2 各组血清sFlt-1、PIGF、PP-13、sEng比较
Note:*Compared to control,P<0.05;#Compared to Gestational hypertention,P<0.05
三、各组PI、RI、S/D比较
子痫前期组子宫动脉血流收缩期与舒张期流速比(S/D)和搏动指数(PI,PI=S-D/Vm)、阻力指数(RI,RI=S-D/S)与对照组比较,差异均有统计学意义(P<0.05),见表3。
四、sFlt-1、PIGF、PP-13、sEng与PI、RI、S/D的相关性
血清PIGF表达与RI呈负相关(r=-0.114,P=0.025)。血清sFlt-1表达与RI呈正相关(r= 1.75,P=0.031),见表4。
五、PI、RI、S/D与临床指标的相关性
子痫前期RI水平与分娩孕周、新生儿体重呈负相关(r=-0.257,P=0.001;r=-0.687,P=0.035),见表5。

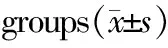

GroupNPIRIS/DPreeclampsia421.6±0.31.0±0.24.2±0.2∗Gestational hypertention451.3±0.30.8±0.13.1±0.7Control800.9±0.20.7±0.32.5±0.6
Note:*Compared to control,P<0.05
表4sFlt-1、PIGF、PP-13、sEng与PI、RI、S/D的相关性系数
Table4Correlation coefficient between sFlt-1, PIGF, PP-13, sEng and PI, RI, S/D

IndicatorsPIRIS/DsFlt-10.7801.75∗0.175PIGF0.051-0.014∗0.752PP-130.0750.0650.405sEng0.9150.4791.075
Note:*P<0.05
表5临床指标与PI、RI、S/D的相关性系数
Table5Coefficient of correlation between clinical indicators and PI, RI, S/D
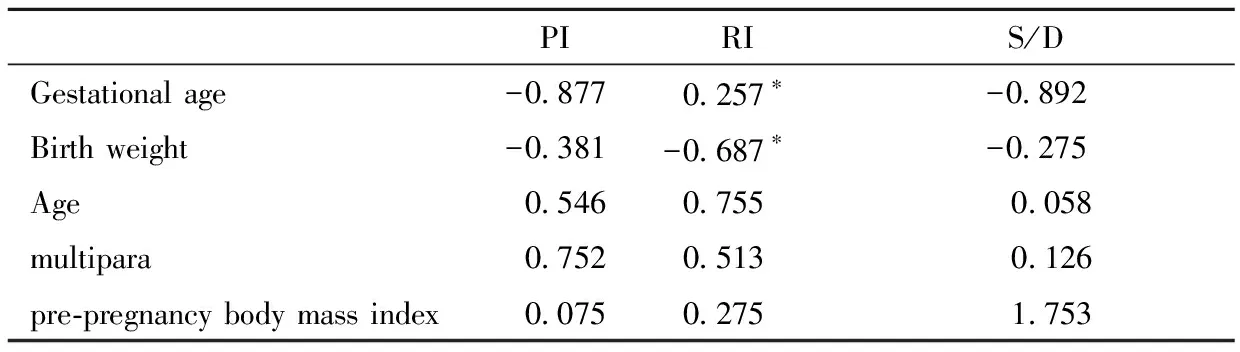
PIRIS/DGestational age-0.8770.257∗-0.892Birth weight-0.381-0.687∗-0.275Age0.5460.755 0.058multipara0.7520.513 0.126pre-pregnancy body mass index0.0750.275 1.753
Note:*P<0.05
讨 论
正常妊娠时,胎盘绒毛间隙的血液灌注主要依靠子宫动脉,由子宫动脉注入子宫的母体血液进行灌注。滋养细胞从孕5~7周开始对子宫螺旋动脉进行侵袭并逐步取代动脉内皮细胞,动脉管壁平滑肌弹性组织发生纤维样重塑,管壁失去弹性、管腔扩张、阻力降低、血流量明显增加[8]。研究表明胎盘绒毛间隙的充足的血液灌注可有效的供应胎儿胎盘生长代谢的基本物质,且能够去除胎盘代谢的产物[9]。而子痫前期的发病过程中,存在滋养细胞的侵袭能力不足,仅能侵入蜕膜层、未能侵入并取代血管肌层,未能完成子宫螺旋动脉的重塑,血管仍处于高阻低排状态[10-11]。子痫前期早期表现为绒毛浅着床及血管痉挛导致胎盘灌流下降,最终发展孕妇全身血管内皮细胞的广泛激活和(或)损伤,导致多系统器官不同程度的损伤[12]。因此,检测子宫动脉RI、PI、S/D变化是有效评估子宫动脉阻力的敏感性指标之一。本研究通过彩色多普勒超声对子宫动脉的血流情况和阻力情况进行了评估,结果显示:PE组孕妇的S/D、PI、RI均显著高于正常对照组,其中RI与分娩孕周及新生儿出生体重呈负相关。说明子痫前期患者子宫动脉内血流的异常情况,其发病与胎盘浅着床、滋养细胞侵入不足有关[13]。血管高阻力指征RI是反映子痫前期独立危险因素,并影响分娩孕周及新生儿出生体重。有报道,RI增加超过0.58或超过第90~95 百分位数或存在单侧或双侧舒张期切迹表明血流阻力增加,具有预测子痫前期作用[14]。
多种促血管新生细胞因子和抗血管新生因子参与了子宫螺旋动脉的重塑,胎盘来源的血管生长因子P1GF及其衍生物sFlt-1与子痫前期的发生密切相关[15]。PIGF是具有促血管新生效应的细胞因子,能够促进滋养细胞向螺旋动脉的侵袭、增加血管通透性以及新生血管的数目[16]。子痫前期的患者子宫动脉变化较复杂,首先子宫动脉的管径逐渐狭窄,机制是滋养层细胞对螺旋动脉的侵蚀,并且循环阻力增高,滋养细胞中的PP-13 mRNA 表达可能参与子痫前期的发病[17]。但妊娠早期 PP-13对子痫前期的预测价值尚需继续研究[18]。而妊娠中期 hCG 高水平可能是激素漏出或低灌注相关刺激引起。有研究表明妊娠中期hCG 水平升高与日后发展成子痫前期有关[19]。然而,母血清hCG 独自作为预测指标效果不满意。文献报道hCG预测FGR的检出率为5.1%~8.4%[20]。我们对两组孕妇血清中血管新生相关细胞因子含量的测定显示,PE组孕妇血清中sFlt-1、sEng的含量显著高于正常对照组且与RI呈负相关,PE组孕妇血清中PIGF、PP-13的含量显著低于正常对照组,仅PIGF与RI呈负相关关系。说明彩色多普勒超声所测定的S/D、PI、RI不仅能够反映子痫前期孕妇体内血管新生相关细胞因子的含量,同时体现子痫前期孕妇体内细胞侵袭的情况。
综上所述,sFlt-1可能参与影响子痫前期子宫动脉血流,其机制可能是通过上调sFlt-1介导抑制PIGF的分泌引起子宫动脉内皮功能障碍。目前临床上缺乏子痫前期的有效辅助检查方法,仅仅通过监测血压、检测蛋白尿等方法很难达到早期诊断或预测的目的[21-22]。由于子宫动脉的血供情况能够直接影响子宫胎盘循环状况,因此子宫-胎盘-胎儿循环有无出现异常改变可以通过准确检测子宫动脉的各项血流指标进行早期评估,且可较准确预测病变的严重程度,将对子痫前期的早期诊断及预测有着重要的意义。

