福建省南美白对虾幼体急性肝胰腺坏死病病原分离与PCR检测
郭书林,陈信忠,尤颖哲,陈何东,王艺红,丁亦男,龚艳清,杨俊萍
(1.厦门海关,福建厦门 361016;2.漳州市水产技术推广站,福建漳州 363000)
近年来新出现的对虾传染病常造成大批对虾发病死亡,给全球对虾养殖业带来巨大经济损失,其中最主要的疫病为急性肝胰腺坏死综合征(acute hepatopancreas necrosis syndrome,AHPNS)[1]。该病主要发生于虾苗放养后7~30 d,亦称为早期死亡综合征(early mortality syndrome,EMS)。该病从发生至今的10年间,给全球三大对虾生产国——泰国、中国和越南的对虾养殖业造成30%~40%左右的减产[2],给我国海南、广东、福建、广西等省份的养殖场造成了严重影响。为此,世界动物卫生组织(OIE)将其列入须通报水生动物疫病名录。2013年5月,国际水产联盟(GAA)和联合国粮农组织(FAO)先后宣布,导致AHPNS的病原体是副溶血弧菌(Vibrio parahemolyticus,VP)的特异变种。本研究利用泰国专家Flegel等[3]报道的PCR检测方法,对福建省多家规模化南美白对虾养殖场进行了AHPNS检测。
1 材料与方法
1.1 材料
1.1.1 试验材料 采集福建省9家规模化南美白对虾苗种繁育基地的患病对虾幼体各10只,共获得90份样本。VP分离纯化用培养基:青岛海博公司产品;PCR mix反应液:天根生物科技有限公司产品;PCR引物:上海生工科技有限公司合成。
1.1.2 主要仪器设备 PCR扩增仪:美国ABI公司生产;VITEK-2全自动细菌鉴定系统:法国生物梅里埃公司生产。
1.2 方法
1.2.1 样品处理 取南美白对虾幼体肝胰腺,按国家标准GB 4789.7—2013中的副溶血性弧菌分离纯化鉴定方法,将得到的VP菌株作为PCR检测用模板。
1.2.2 PCR检测 PCR检测通过引物AP3F:5'-ATGAGTAACAATATAAAACATGAAAC-3'(SEQ ID NO:1) 和 AP3R:5'-GTGGTAATAGATTGTACAGAA-3'(SEQ ID NO:2)扩增质粒pVA1的基因片段(以纯化的VP作为模版),目的片段大小为336 bp。PCR产物经测序、Blast比对后,确定分离所得的VP是否为携带质粒pVA1的特异性VP菌株。反应体系为:10×PCR buffer(Mg2+Plus)2.5 μL,AP3上下游引物各(10 μmol/L)1 μL,dNTP(10 mmol/L)2 μL,TaqDNA 聚合酶 0.5 μL,抽提物 5 μL,加水补至 25 μL。按照以下程序进行扩增:94 ℃5 min,然后进行32次循环(94 ℃ 30 s,53 ℃ 30 s,72 ℃ 40 s),72 ℃ 5 min,4 ℃ 保温。
1.2.3 不同样本处理方式对检测结果的影响分析取肝胰腺,按DNA抽提试剂盒说明书提取DNA样本,并以此作为PCR检测模板;取肝胰腺,按1:10 的比例放入含1.5% NaCl的 TSB培养基中,30 ℃,250 r/min,振荡培养 5~6 h。荡结束后,取菌液放入1.5 mL离心管中,3 000 r/min,离心5 min,弃上清,加PBS 悬浮,将增菌后的增菌液作为PCR检测用DNA模板。将上述2种处理方式的检测结果进行比较,分析不同样本处理方式对检测结果的影响。
2 结果
2.1 VP分离和PCR检测
从9家规模化南美白对虾养殖场分别取10只患病幼虾,共获得90份样本,增菌后从其中33份样本的弧菌显色培养基平板上分离到疑似VP。挑取其中5个单菌落进行确认,发现氧化酶阳性,革兰氏染色阴性,且VITEK-2全自动细菌鉴定系统确认为VP。鉴定确认的VP菌株分别来自于27份样本,共81株(表1)。
对81株VP进行PCR检测,检出阳性菌株72株,PCR电泳结果见图1。阳性菌株分别来自23份样本,其中16份样本的所有受检VP菌株均为特异性菌株,6份样本的部分受检VP为特异性菌株,1份样本的所有受检VP均非特异性菌株,说明患病幼虾肝胰腺存在不同基因型VP同时感染情况。
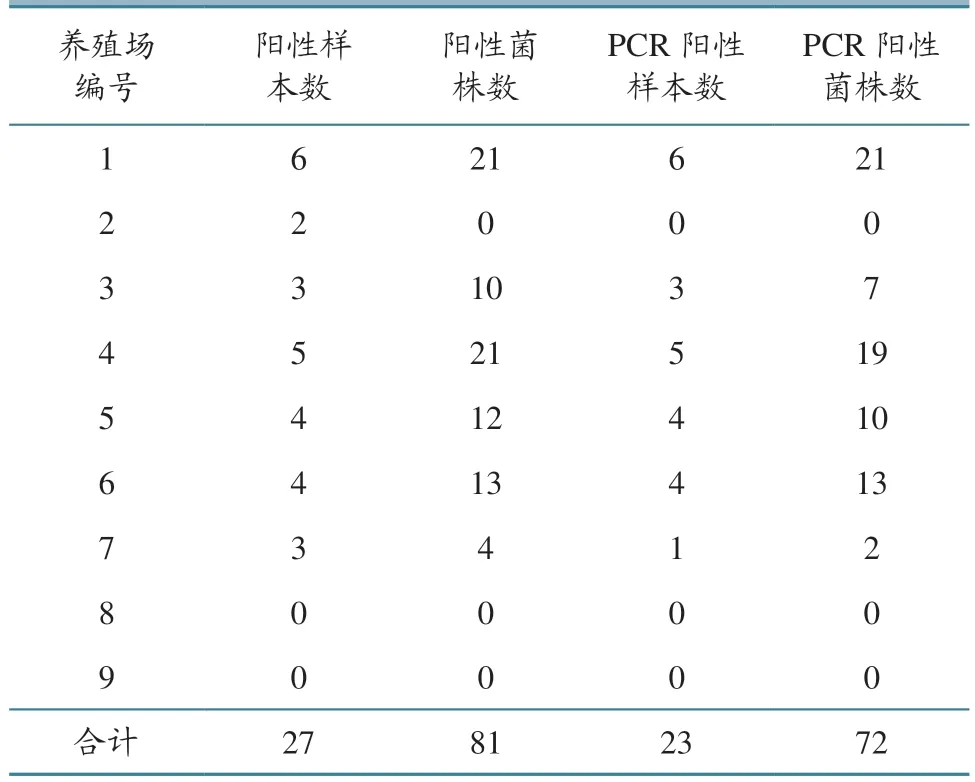
表1 VP分离和PCR检测结果 单位:株/份
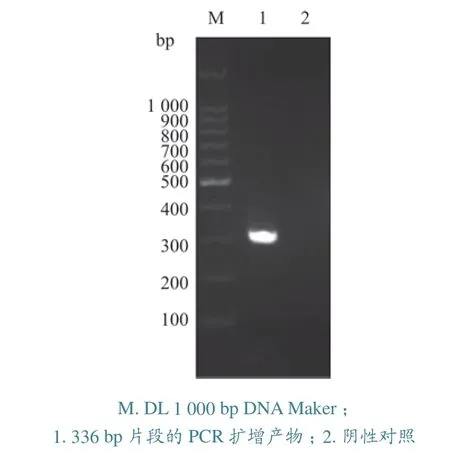
图1 AP3引物扩增PCR产物电泳分析
2.2 以肝胰腺DNA进行PCR检测
90份样本中,8份样本的PCR检测结果为阳性,包含于2.1结果中的22份PCR检测特异性VP阳性样本中,说明直接以肝胰腺DNA进行PCR检测的方法灵敏性较低,较之于2.1方法的检出率降低了约63%。
2.3 以肝胰腺增菌液进行PCR检测
90份样本中的25份样本检测结果为PCR阳性,其中22份样本与2.1的检测结果相吻合,而另3份样本在2.1方法中的检测结果为VP分离阳性而PCR阴性。两种方法的检测结果略有差距。
3 讨论
2014年,有关AHPNS的病原学研究取得了重要进展,通过比较VP致病株与非致病株的基因序列,发现了与致病性相关的pVA1质体,并证明致病性VP的毒素蛋白PirA和PirB是引起AHPNS的关键。Flegel等[3]公布了一种通过引物AP3检测急性肝胰腺坏死病(AHPND)VP分离株的新方法。该方法基于一种12 kDa蛋白质的基因序列,AP3引物优于之前公布的AP2引物,与先前推荐的100%敏感性、97.7%特异性、97.4%阳性预测值和100%阴性预测值相比,新方法具有100%的敏感性、特异性、阳性预测值和阴性预测值。Flegel等认为,AP3扩增法对细菌分离株的DNA提取液具有足够的敏感性,不建议将此方法应用于嵌套的PCR。但是,对于来自虾组织、小虾或幼虾粪便、整个幼体和其他疑似携带者以及来自池塘沉积物等环境源样品,建议在含有1.5% NaCl补充物的TSB中进行初步富集,在30 ℃左右的温度下振荡培养4 h。此后,让所有碎片沉淀,然后将混浊的上清液离心,收集细菌,丢弃上清液。从细菌颗粒中提取DNA,并使用大约100 ng的模板进行PCR测试。本试验中,以从幼虾肝胰腺中分离到的VP为DNA模板进行PCR检测的灵敏性高,直接以幼虾的肝胰腺为DNA模板进行PCR检测的灵敏性较低,检出率降低了63%。以肝胰腺增菌液进行PCR检测,检出3份阳性样本,但经VP分离后再进行PCR检测的结果为阴性,推测可能PCR检测试验中未挑取到AHPNS阳性VP,造成了漏检。另一种可能是以肝胰腺增菌液进行的检测出现了假阳性;或者虾体曾经感染过AHPNS阳性VP,目前仅携带其DNA,而未携带VP活菌。因本试验未进行回归感染试验,所以无法验证以肝胰腺增菌液进行的PCR检测与VP法的PCR检测结果差异是否由假阳性导致。
将本试验的VP PCR检测结果与张娜等[4]的结果进行比较,发现该方法具有很好的检出率和灵敏性,推测原因可能是对虾样本的选择不同导致。本试验中,对虾样本为患病幼虾,而张娜的试验对象是随机采取的亲虾,而患病幼虾肝胰腺中AHPNS阳性VP丰度可能较高,使得AHPNS阳性VP的检出率显著提高。
本试验对福建省9家规模化对虾养殖场的90份患病幼虾样本进行AHPNS检测,从27份样本中分离鉴定出81株VP,其中从22份样本中分离到AHPNS阳性VP,显示发病养殖场具有较高的VP感染风险和AHPNS暴发风险。

