55例生长受限胎儿染色体微阵列分析
马玉红,韩 瑾,陆军燕,陆 萍,陈基强,杨济敏,彭拥花,刘玉娟
(1.东莞康华医院产前诊断中心,广东 东莞 523080;2.广州市妇女儿童医疗中心产前诊断中心,广东 广州 510623)
胎儿生长受限(fetal growth restriction,FGR)又称宫内生长受限,是指胎儿体重低于其孕龄平均体重的第10百分位数或低于其平均体重的2个标准差,是产科最常见也是最复杂的病症之一[1]。FGR可增加胎儿窘迫、新生儿窒息等围产期并发症发病率和围产儿死亡率,可导致出生后发育及智力发育落后,成年后代谢综合征易感性增加。FGR病因复杂,孕妇、胎儿、胎盘和脐带的异常因素均是其危险因素,其中胎儿染色体异常是导致FGR的重要原因之一。染色体微阵列分析(chromosome microarray analysis,CMA)技术可以检测全基因组水平染色体拷贝数变异(copy number variation,CNV),还可检测嵌合体(嵌合比例>20%)、杂合性缺失(loss of heterozygosity,LOH)及单亲二倍体(uniparental disomy,UPD)等,目前已被广泛应用于胎儿结构畸形、原发性智力低下、生长发育迟缓、自闭症、多发畸形等异常的诊断及肿瘤遗传学诊断等领域[2]。本研究应用全基因组CMA技术对55例产前超声诊断的FGR胎儿进行检测,探讨FGR胎儿的基因组学病因及CMA技术在该类胎儿中的诊断应用价值。
1资料与方法
1.1研究对象
选择2015年1月至2018年6月在东莞康华医院产前诊断中心和产科诊断为FGR病例55例,孕妇年龄为28~42岁,孕周为22~34周。将FGR胎儿分为单纯性FGR组(33例)和FGR合并其他超声异常组(22例)。
1.2方法
产前诊断孕妇均填写基本信息登记表,包括年龄、体重、末次月经、种族、生育史、疾病史、家族遗传病史,孕妇在本次妊娠期间是否接触过病毒及明显致畸物质。所有病例需排除由明确母体因素引起的FGR,如妊娠期高血压疾病及母体营养因素异常等。所有研究对象均签署知情同意书,取得本院伦理委员会批准。
1.3仪器的选择
CMA的检测按照美国Affymetrix公司生产的CytoScan HD芯片检测标准流程进行操作,应用配套的ChAS软件及生物信息学方法进行数据分析。参照人类细胞遗传学国际命名体制(ISCN2009)标准进行染色体核型分析诊断,CytoScan HD芯片同时具备195万个CNV探针和75万个SNP探针。
1.4产前诊断
在孕妇及家属知情同意下,自愿选择超声引导下羊膜腔穿刺术(16~24周)或脐带血穿刺术(>24周),获得胎儿羊水或脐血样本。孕妇取仰卧位,常规腹壁消毒,超声引导下行羊膜腔穿刺或脐带血穿刺术,获取胎儿标本(羊水20mL或脐带血1.5mL)。同时抽取其家系成员外周血2mL注入EDTA抗凝管中,颠倒混匀后置于4℃冰箱中保存,剩余标本置-80℃保存。
1.5 CMA数据分析
采用ChAS 2.0软件,选取长度≥100kb缺失/重复片段(可信度≥90%)进行分析,数据为CEL文件格式。根据CNVs的性质不同,将其分为致病性CNVs、不明确意义CNVs(variants of unknown significance,VOUS)及良性CNVs三类。数据分析包括实验室内部数据库及在线公共数据库,如OMIM(http://www.omim.org)、DGV(http://www.projects.tcag.ca/variation)、DECIPHER(http://www.sanger.ac.uk/PostGenomics/decipher)、USCS(http://genome.ucsc.edu)及PubMed(http://www.ncbi.nlm.nih.gov/pubmed)。
1.6统计学方法
采用SPSS 16.0软件进行统计学分析。计数资料用例数和百分数表示,应用校正χ2检验进行组间比较,以P<0.05为差异有统计学意义。
2结果
2.1 CMA的研究情况
在55例FGR样本中,致病性CNVs检出8例,检出率为14.5%(8/55),病理性CNV病例见表1;其中单纯性FGR组致病性CNVs检出率为9.1%(3/33),FGR合并其他超声异常组致病性CNVs检出率为22.7%(5/22),片段小于5Mb致病性CNVs占5.4%(3/55),检出VOUS占3.6%(2/55)。
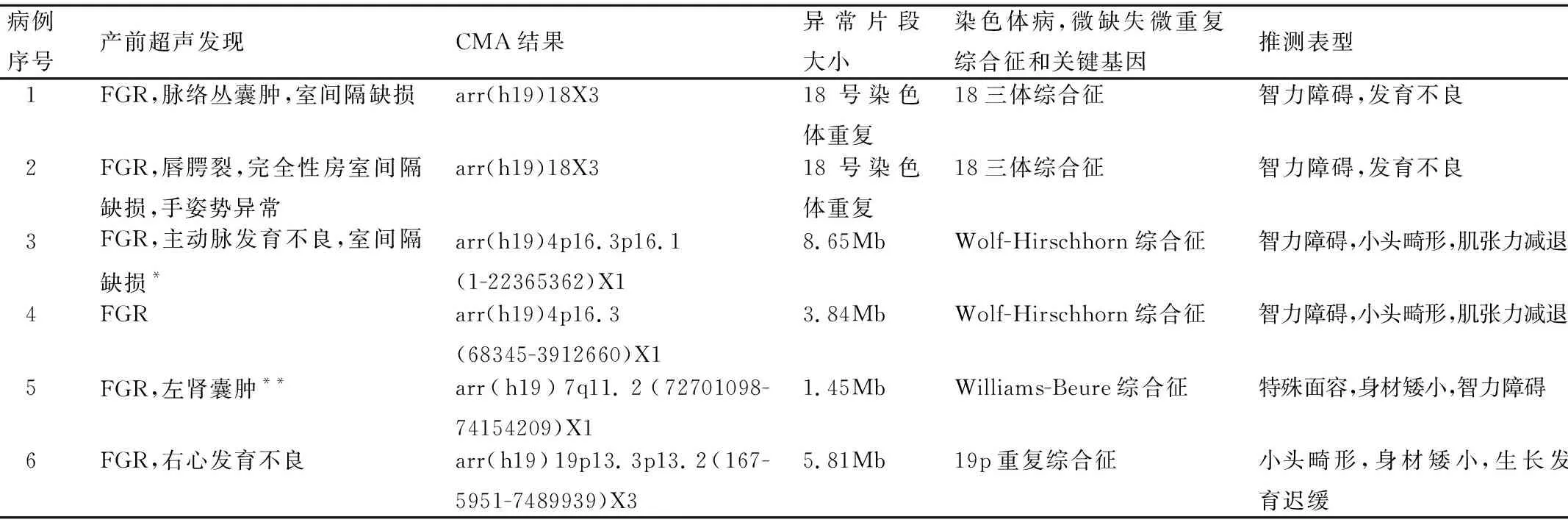
表1 8例病理性CNV产前超声和CMA结果
(转下表)
(续上表)
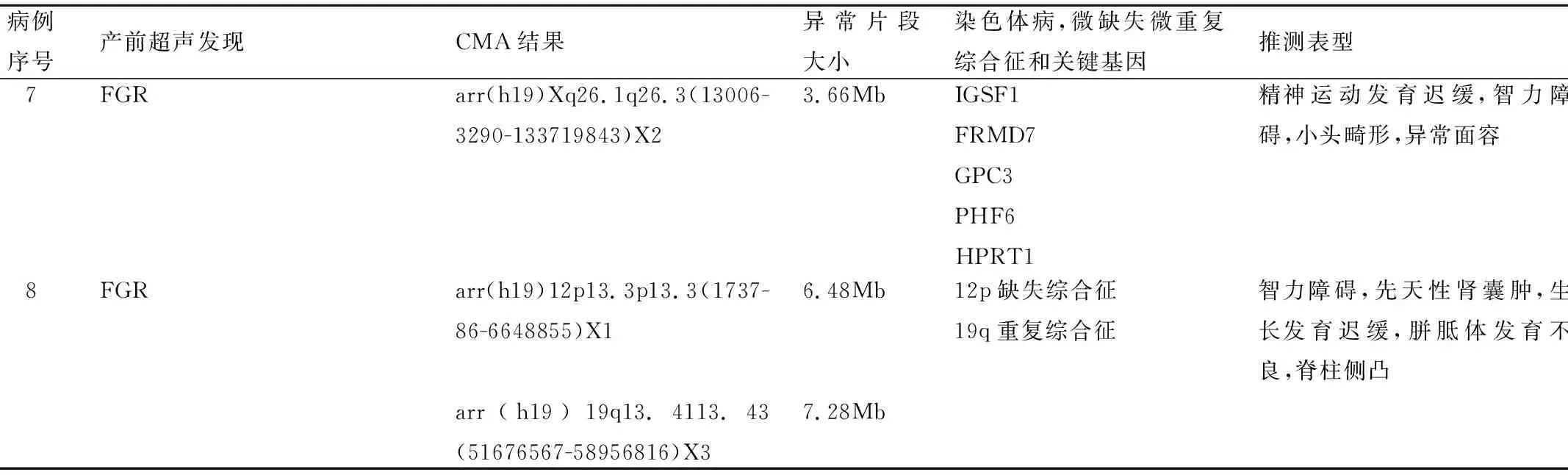
病例序号产前超声发现CMA结果异常片段大小染色体病,微缺失微重复综合征和关键基因推测表型7FGRarr(h19)Xq26.1q26.3(13006-3290-133719843)X23.66MbIGSF1FRMD7GPC3PHF6HPRT1精神运动发育迟缓,智力障碍,小头畸形,异常面容8FGRarr(h19)12p13.3p13.3(1737-86-6648855)X1arr(h19)19q13.4113.43(51676567-58956816)X36.48Mb7.28Mb12p缺失综合征19q重复综合征智力障碍,先天性肾囊肿,生长发育迟缓,胼胝体发育不良,脊柱侧凸
注:*见图1,**见图2。
2.2产后随访情况
对全部病例进行了电话随访及产后超声复查,了解患者妊娠结局,其中12例选择引产,40例分娩,3例失访;在40例分娩的病例中,除1例出现精神运动发育迟缓外,其余生长发育评估基本正常。
2.3单纯性FGR组与FGR合并其他超声异常组CNVs检出情况
单纯性FGR组、FGR合并其他超声异常组CNVs检出率分别为9.1%(3/33)和22.7%(5/22),两组比较差异无统计学意义(χ2=0.843,P=0.358)。不同性质CNVs的检出率见表2。

表2 55例FGR病例不同性质CNVs的检出比较结果[n(%)]

图1 Wolf-Hirschhorn综合征(WHS)典型病例3的CMA图

图2 Williams-Beure综合征(WBS)典型病例5的CMA图
3讨论
3.1 FGR发病原因及机制
FGR发病原因及机制较为复杂,母体因素、多胎、胎儿感染和遗传因素等均可能导致FGR。在遗传因素中,染色体异常是导致FGR的重要原因之一,其中最常见的是染色体三体,如18三体和13三体综合征,还有染色体结构异常等病因[3]。随着现代分子生物学技术的不断发展、基因研究方法的不断涌出及基因组序列改变引发胚胎发育异常相关研究的深入,越来越多的基因组异常疾病被发现与FGR有关。本研究所使用的CNVs检测技术具有高分辨识别基因组不平衡CNV、UPD及较低水平嵌合体的CMA技术,在快速识别和鉴定疾病相关基因方面具有较高的优势。2014年8月,国内亦达成了“CMA技术在产前诊断中的应用专家共识”,进一步明确了CMA在产前诊断中的应用价值[4]。
3.2 CMA检测结果分析
本研究采用Affymetrix公司的CytoScan HD芯片平台共计对55例FGR病例进行了检测,对临床实践具有较好的指导意义。本研究显示,FGR合并其他超声异常组的CNVs检出率为22.7%(5/22),显著高于单纯性FGR组的9.1%(3/33),两组比较差异无统计学意义(P>0.05),合并的畸形主要为心血管畸形和神经系统异常。吴星等[5]的研究中提出单纯性FGR和合并其他结构畸形的检出率分别为11.1%和18.4%,与本研究结果类似。
3.3核型分析与CMA技术优缺点的比较
染色体核型分析作为传统的检测方法用于产前诊断多年,可检测全基因组水平染色体数目或较大的结构异常。本研究中有2例为常见的18三体病例。常规的G显带核型分析只能检测到10Mb以上的染色体片段异常,即使高分辨G显带核型分析也较难检出小于5Mb的染色体变异,而且对细胞培养要求较高,临床实施困难。在本研究8例CMA异常病例中,有3例CNVs片段小于5Mb,更说明应用CMA的临床价值;采用CMA技术不仅可以检测出常规染色体核型异常,还可额外检出5.4%(3/55)染色体组的异常。另外在本研究的病例中,致病性片段染色体的分布分别为4p16.3、7q11.2、12p13.3、19p13.3、19q13.4和Xq26.1,分布在不同的染色体,且无明确的规律性,进一步证实了FGR的遗传学病因除了与染色体结构异常或非整倍体有关,还与不同染色体亚显微结构异常有关。因此说明高分辨全基因组水平检测技术对FGR的病因学检测具有一定的优势[6]。无论是单纯性还是合并其他结构畸形的FGR患者,首先推荐CMA进行遗传学病因的检测。
3.4特殊病例的分析
本研究发现病例3和病例4诊断为Wolf-Hirschhorn综合征(WHS),该病新生儿的发病率为1/50 000,关键区域在染色体4p16.3的165kb范围内,为开始形成受精卵的早期发育过程中随机出现的染色体缺失,也可为4号环状染色体或父母一方为4号染色体短臂的平衡异位携带者等原因所造成,由于其患儿临床特征性的外貌,即宽鼻梁、前额突出、眼距宽、大而突出的眼睛、小下颌、嘴角下垂等表现,也称为“希腊武士头盔”的面容,该类患儿出生后有生长发育障碍、智力低下、肌张力减退、癫痫、先心病、骨骼畸形等各种异常。WHS的典型体征和症状与4号染色体短臂末端多种基因的丢失有关,丢失片段的大小决定了个体体征异常的程度,丢失片段大的较片段小的有更严重的智力障碍。本研究2例的缺失片段大小分别为8.65Mb和3.84Mb,属于较为常见的类型[7],可在出生后很大程度上表现出WHS的表型特征。
本研究中还发现病例5为Williams-Beure综合征(WBS),超声显示除生长发育迟缓,还存在肾脏发育异常,产前诊断为7号染色体长臂1.45Mb缺失,包括25~30个基因,7q11.23区域低拷贝重复序列(low copy repeats,LCR)重排是WBS患者发病的原因,大约95%的WBS患儿存在的1.5~1.8Mb缺失,即典型缺失,这些缺失中2/3是因减数分裂过程中7号染色体同源重排所致,1/3是由染色体内的重排所致,此类父母的WBS区域发生了7号染色体臂内倒位是重要原因之一。WBS患儿出生后的临床表现为特殊面容,表现为“精灵面容”,张嘴突唇、牙齿稀疏、咬合不正、心血管主动脉瓣上狭窄是最常见的临床表现,患儿有智力发育迟缓,语言能力和听觉机械记忆能力很强,视觉空间的构建能力很差,15%有特征性地先天性高钙血症[8]。
病例6为羊水CMA发现为19p重复综合征[9]。病例7是男性胎儿,为IGSF1、FRMD7、GPC3、PHF6、HPRT1缺失,主要临床表现为精神运动发育迟缓、智力障碍、小头畸形、共济失调等[10]。病例8为12p6.48Mb缺失和19q7.28Mb的重复,12p13.33微缺失综合与19q13.4重复相互协同,也主要表现为智力障碍,生长发育迟缓,脑发育异常和器官的异常,建议对父母行染色体的检查,排除其中一方患有染色体的平衡易位[11]。但由于本研究中的病例绝大多数来自外院转诊,在获知胎儿存在病理性CNV后,多选择终止妊娠,因而缺乏对CMA结果和相应病例远期预后的随访评估结果。
CMA技术也有一定的局限性,在临床实践中可能会发现大量的临床意义不明确的VOUS,这将会给遗传咨询与临床处理带来困难,VOUS的检出率取决于微阵列芯片的类型和研究的群体,因此建议对病例的父母进行基因组DNA的检测。CMA检测前与检测后的遗传咨询非常重要,检测前需要孕妇及其家属签署知情同意书,内容包括CMA技术的优势、局限性和可能的结果,检测后也应具备对不同的临床报告结果解读的能力,并能够提供与之相对应的具体的临床处理方式和流程。

