特发性膜性肾病患者外周血单个核细胞中GRα和GRβ的表达与临床缓解的相关性①
孙艳玲 谢 华 林洪丽 刘 颖 张圣坤
(大连医科大学附属第一医院,大连116011)
特发性膜性肾病(Idiopathic membranous nephropathy,IMN)是成人原发性肾病综合征的主要病理类型,国外研究报道IMN的患病率占成人INS的25%~40%[1],而我国IMN的患病率以每年1.3%的速度升高并已达24.9%[2]。随着血清PLA2R等特异性抗体的发现,IMN的发病机制有了新的进展,但目前仍建议激素联合免疫抑制剂进行治疗[3]。糖皮质激素(Glucocorticoid,GC)是通过结合其特异受体糖皮质激素受体(Glucocorticoid receptor,GR)而发挥作用的,其中GRα和GRβ是影响其生物学效应的主要亚型,GRα由于其主导作用一直被认为是GC发挥作用的核心,但随后的研究发现GRβ对GRα的潜在拮抗作用可能在激素抵抗众多因素中占有主要地位,GRβ的高表达状态可能与激素抵抗的发生过程有直接关系[4]。外周血单个核细胞(Peripheral blood mononclear cell,PBMC)中表达丰富的GR,本文通过检测IMN患者发病和缓解时PBMC中GRα与GRβ的表达,分析其与IMN疾病活动的相关性,探寻能反映IMN激素治疗的生物标志物。
1 资料与方法
1.1临床资料 选择2013年10月至2015年3月于大连医科大学附属第一医院肾内科经肾活检确诊为IMN的患者26例。所有入组患者均签署知情同意书,并经过大连医科大学附属第一医院伦理委员会批准(注册号:ChiCTR-RCH-13003503)。入选标准:①年龄:18~70岁;②血清白蛋白≤30 g/L,24小时尿蛋白定量≥3 500 mg;③eGFR>60 ml/(min·1.73 m2);④首次发病的IMN未应用激素或免疫抑制剂;⑤高血压能够有效控制≤130/80 mmHg或无高血压;⑥服用ARB或ACEI药物8周以上。排除标准:①各类继发性膜性肾病,如过敏性紫癜性肾炎、糖尿病肾病、肝炎病毒相关性肾炎、狼疮性肾炎以及肿瘤相关性肾病等;②合并中重度高血压、心脏病、脑血管疾病、肝脏疾病、糖尿病、恶性肿瘤等其他疾病。
入组患者的治疗方案:①激素序贯治疗:年龄<60岁,予甲基强的松龙500 mg/d连续静脉输液3 d,续接强的松40 mg/d口服8周;年龄≥60岁,予甲基强的松龙250 mg/d连续静脉输液3 d,续接强的松30 mg/d 口服8周;此后以每半月减量2.5 mg至20 mg/d,维持8周。如达到完全缓解,继续按照规律减量至5 mg/d后维持8周停药;如未达到完全缓解,则20 mg/d维持12周,再按规律减量至10 mg/d。②联合免疫抑制剂应用:在规律足量糖皮质激素治疗8周后,联合应用他克莫司,以0.05 mg/(kg·d)为起始量,监测血药浓度维持在4~7 ng/ml。
疗效判定及随访:治疗后尿蛋白定量≤300 mg/24 h,血清白蛋白≥35 g/L,血清肌酐正常为完全缓解(CR);治疗后尿蛋白定量下降>50%,或尿蛋白定量降至3 500 mg/24 h,血清白蛋白≥35 g/L,血清肌酐正常为部分缓解(PR),总缓解(TR)= CR+PR;所有患者每月随访1次,到达CR的患者3个月随访1次。记录患者随访过程中的24 h尿蛋白定量、血清白蛋白(ALB)、血脂、血清肌酐和血压。
健康对照组:选择来大连医科大学附属第一院进行健康体检,经询问病史、体格检查、影像学及化验等检查确认为健康,年龄、性别与肾病综合征组匹配的志愿者10例作为对照。
1.2方法
1.2.1标本采集、外周血单个核细胞(PMBC)的分离及总RNA提取 健康志愿者于入选后抽取空腹静脉血12 ml,置于EDTA抗凝;肾病综合征患者分别留取入组患者基线(激素治疗前)、联合应用免疫抑制剂前(规律糖皮质激素治疗8周)、达到完全缓解或部分缓解时1周内的各抽取清晨空腹静脉血12 ml,置于EDTA抗凝。密度离心法用人淋巴细胞分离液常规分离PBMC,Trizol法提取总RNA,琼脂糖凝胶电泳检测RNA完整性,紫外分光光度法测定RNA浓度和纯度。
1.2.2RNA逆转录成cDNA 按SYBR®PrimeSc-riptTMMaster Mix ( Perfect Real Time )RT-PCR 试剂盒说明书进行反转录,反应体系组成:5×PrimeScript RTMaster Mix (2 μl)+ Total RNA(2 μl)+ RNase Free dH2O(6 μl),PCR仪运行程序37℃ 15 min,85℃ 5 s,4℃ 保存。
1.2.3实时荧光定量PCR 在primer bank中分别查得GRα、GRβ和GAPDH(内参)引物序列,并通过NCBI的Primer BLAST功能对引物进行验证,由大连TaKaRa公司合成。GRα引物:上游5′-CTATGCATGAAGTGGTTGAAAA-3′,下游5′-TTTCAGCTAACAT-CTCGGG-3′;GRβ引物:上游5′-GAAGGAAACTCCAG-CCAGAA-3′,下游5′-CCACATAACATTTTCATG-CATAGA-3′;GAPDH引物:上游5′-AGAAGGTGGTGAAGCAGGC-3′,下游5′-TCCACCACCCTGTTGC-TGTA-3′。PCR 反应按SYBR®PrimeScriptTMRT-PCR 试剂盒说明书进行,采用荧光定量扩增仪LightCycler 使用方法进行操作,PCR 反应体系组成:2×SYBR®Premix Ex TaqTM(10 μl)+10 μmol/L PCR Forward Primer(0.8 μl)+10 μmol/L PCR Reverse Primer(0.8 μl)+Rox Refernce Dye(50×)(0.4 μl)+cDNA溶液(2 μl)+dH2O(6 μl)Q-PCR反应条件:95℃ 30 s,95℃ 5 s,60℃ 30 s,40 循环。GRα和GRβ mRNA表达水平以GAPDH作为内参,以目的基因/GAPDH的比率作为其mRNA的表达量,所有实验均重复3次,结果应用2-ΔΔCT法进行分析。
1.2.4Western blot分析 将收集的PBMC中加入冰冷蛋白裂解液200 μl,冰浴30 min,以1 200 r/min,4℃离心10 min。吸取上清,考马斯亮蓝G250检测试剂盒法测定蛋白浓度。50 μg蛋白样品上样,SDS-PAGE凝胶电泳后分离蛋白,将蛋白转移至PVDF膜上,3%BSA室温封闭1.5 h,加一抗4℃振荡过夜(稀释GRα及GRβ两种一抗终浓度为1∶500,GAPDH一抗稀释的终浓度为1∶2 000),次日TBST洗膜,加辣根过氧化物酶标记的二抗(终浓度为1∶2 000),室温孵育1.5 h,TBST洗膜,用含有辣根过氧化物酶底物的化学发光液显色并扫描结果,通过UVP凝胶图像处理系统Labworks4.6软件扫描胶片,并分析目的条带的灰度值进行半定量分析。

2 结果
2.1IMN患者基线资料及随访资料 26例IMN患者男女比例为3∶1,进行12个月的随访,其中达到CR 9例,PR 6例,NR 11例,临床缓解率为53.8%,随访过程中尿蛋白定量及血白蛋白的变化情况:根据t检验计算,基线时24 h尿蛋白定量为(8 409.56±2 810.01)mg,血清白蛋白为(23.49±4.50)g/L;激素治疗8周时24 h尿蛋白定量为(4 855.91±1 894.00)mg,血清白蛋白为(27.85±3.88)g/L;总缓解时24 h尿蛋白定量为(871.76±1 044.03)mg,血清白蛋白为(39.83±6.83)g/L。
2.2qRT-PCR检测GRα和GRβ mRNA表达变化 以GAPDH为参照,与Control组相比,IMN组PBMC中GRα的表达降低(P<0.05),而GRβ的表达明显升高(P<0.05),如图1所示。IMN组患者PBMC中GRα/GRβ较Control组明显降低(P<0.05)。
激素治疗8周的IMN患者GRα相对含量较基线时无明显变化(P=0.916),缓解时GRα相对含量较基线时有所增加(P<0.05);激素治疗8周的IMN患者GRβ相对含量较基线时有所增加(P<0.05),缓解时GRβ相对含量较基线时无明显变化(P=0.172),如图2所示。
2.3Western blot检测GRα和GRβ蛋白的表达 以GAPDH为参照,统计学分析两组样本的表达差异,与Control组相比,IMN组GRα的表达无变化(P>0.05),而GRβ表达明显增高(P<0.05),如图3所示。
与基线组相比,激素治疗8周时 GRα的表达无明显变化(P=0.685),缓解时GRα的表达变化不明显(P=0.674),缓解时GRα较激素治疗8周时无明显变化(P=0.419);与基线组相比,激素治疗8周时GRβ的表达明显升高(P<0.05),缓解时GRβ的表达不明显(P=0.179),缓解时GRβ较激素治疗8周时明显下降(P<0.05),如图4所示。
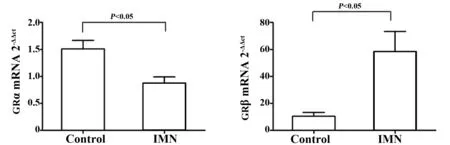
图1 qRT-PCR检测IMN组与Control组GRα和GRβ mRNA的表达Fig.1 qRT-PCR method detected expressions of GRα and GRβ mRNA of IMN patients and controls

图2 qRT-PCR 检测IMN患者GRα和GRβ基因的表达Fig.2 qRT-PCR method detected expressions of GRα and GRβ gene of IMN patientsNote: GC.Glucocorticoid,baseline;GC 8 weeks.Glucocorticoid treatment 8 weeks;TR(Total remission)=CR(Complete remission)+PR(Partial remission).

图3 Western blot检测GRα和GRβ蛋白的表达Fig.3 Western blot method detected expressions of GRɑ and GRβ protein of IMN patients and controls
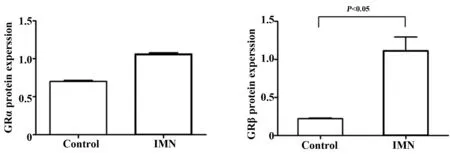
图4 Western blot检测IMN患者GRα和GRβ蛋白的表达结果Fig.4 Western blot method detected expressions of GRα and GRβ protein of IMN patientsNote: GC.Glucocorticoid,baseline;GC 8 weeks.Glucocorticoid treatment 8 weeks;TR(Total remission)=CR(Complete remission)+PR(Partial remission).
表1 IMN患者临床及病理指标与临床缓解的COX回归分析
Tab.1 COX regression analysis between clinical indexes,pathological indexes and clinical remission of IMN patients

Influence factorP for TrendGender0.444Age0.907Course of disease0.285Blood pressure0.43224 h urine protein0.404Serum albumin0.436Serum creatinine0.458Cholesterol0.373Triglyceride0.456Fibrinogen0.504Baseline of GRα mRNA0.022Baseline of GRβ mRNA0.915Baseline of GRα/β mRNA0.016Baseline of GRα0.516Baseline of GRβ0.623Baseline of GRα/β0.298
2.4COX回归分析 生存分析结果显示,年龄、病程、血压、24 h尿蛋白定量、Alb、Scr、CH、TG、Fib、与临床缓解无明显相关性(P>0.05)。而基线时GRα基因表达P<0.05、基线时GRα/β基因表达P<0.05,提示其与临床缓解相关如表1所示。
3 讨论
IMN患者很大程度上对激素存在抵抗,为改善激素抵抗患者的临床效果及其预后,近年来关于IMN患者激素抵抗[5]的机制,始终是学者们研究的热点问题。糖皮质激素首先需与GR结合而发挥生物学作用。有研究显示,GRα和GRP具有协同作用,GRα与GRP比例失衡可能会导致激素反应性改变[6]。GRα能够结合糖皮质激素发挥生理学、药理学的作用,而GRβ可以抑制GRα的作用,从而阻止GRα发挥作用,两者之间的比例也会影响糖皮质激素的作用[6]。
在所有被检测的组织与细胞中,GRα蛋白几乎均有表达[7],是介导GC发挥抗炎作用、引起免疫抑制反应的主要功能性受体,GC的疗效与GRα的数量、GC与GR的亲和力密切相关[8]。GRβ主要存在于细胞核内,多种细胞和组织中可以检测到GRβ的表达,GRβ含有独特的C端氨基酸序列,该序列使其无法结合GC配体,因此阻断其直接激活基因的表达[4]。GRβ能够降低GRα介导GC的生物学效应,首次提出了GRβ是一种内源性GC效应拮抗因子[9,10]。有学者检测不同GC反应患者的PBMC细胞浆和细胞核中GR的表达水平,因此我们推断激素抵抗的患者PBMC内可能存在GRα核转位过程中的障碍,致使核内GRα水平无明显增高,GC也就无从发挥其相应的作用,从而产生激素抵抗。针对IMN患者激素抵抗的分子机制目前仍然处于探索与假设的阶段,其发病机制值得我们深入探讨与研究。本次研究主要以基因及分子的表达水平为切入点来探讨GRα及GRβ表达的变化与激素抵抗的相关性。
本次实验分别从基因和蛋白水平对GRα与GRβ两种主要亚型在PBMC内的表达差异进行分析。发现IMN组患者及Control组均有GRα mRNA和GRβ mRNA的表达,并且以GRα mRNA为主,其中IMN组的GRβ mRNA的表达与Control组相比明显增高,GRα mRNA的表达与Control组相比明显减低。比较GRα mRNA与GRβ mRNA的比值,可见IMN组GRα mRNA/GRβ mRNA较Control组降低,而GRβ mRNA/GRα mRNA增加,这进一步提示,GRβ mRNA表达的增高及GRβ mRNA/GRα mRNA的增高可能影响激素抵抗的形成过程。Western blot结果提示:IMN组患者PBMC内GRα蛋白的水平与Control组比较未见明显改变,而GRβ蛋白的水平明显增高,同样支持GRβ的高表达可能为激素抵抗的因素之一。
COX回归分析结果显示,基线时α基因表达P=0.022<0.05;基线时β基因表达P=0.915;基线时α/β基因表达P=0.016<0.05,提示基线时基因α与α/β与临床缓解呈相关性。本研究提示,无论IMN组患者GRβ的表达水平还是GRβ mRNA/GRα mRNA表达的比值,均高于Control组,因此提示GRβ的过表达可以导致IMN患者激素敏感性的下降,导致激素抵抗。这一结果提示阻断GRβ mRNA的表达,可能成为治疗IMN一种理想的免疫干预手段。因此,我们可以通过增强GRα与GC的亲和力、降低GRβ受体的数量、提高GRα/GRβ等方式来减少患者的激素抵抗,提高临床治疗效果。

