顺铂诱导肾毒性的分子机制及中药干预研究进展
尹连红,张一萌,彭金咏
(大连医科大学药学院,辽宁 大连 116044)
恶性肿瘤已经成为全世界最主要的死亡原因之一。目前,化疗、放疗和手术是治疗肿瘤的主要方法,而化疗是晚期或不可手术患者的主要治疗手段。在放化疗联合方案中常以铂类药物为基础,其中最常用的化疗药物顺铂(cisplatin,DDP)是美国FDA批准的首个用于肿瘤治疗的铂类药物。DDP自1978年起在美国上市,属细胞周期非特异性药物,可有效抑制癌细胞的DNA复制,损伤癌细胞膜结构,具有较强的广谱抗癌作用,临床广泛用于睾丸癌、卵巢癌、宫颈癌等的治疗[1]。据统计,我国70%~80%的抗癌化疗方案是以DDP为主或DDP参与配伍,其抗癌活性与浓度成正比,呈剂量依赖性,但往往会产生严重的毒副作用,其中肾毒性是DDP最主要的毒副反应之一,发生率高达1/3左右。中药以其多组分、多途径、多靶点的综合作用在治疗DDP肾毒性方面具有较大的优势和广阔的临床应用前景。本文对DDP肾毒性的发病机制及中药预防和治疗研究进展简要综述,旨在为抗DDP肾毒性天然产物及创新药物研发提供资料。
1 DDP的抗肿瘤作用机制
DDP通过影响多个细胞凋亡信号通路发挥抗肿瘤作用,其中重要的是影响DNA合成和修复,导致细胞周期停止。研究发现,DDP与肿瘤细胞内活性氧(reactive oxygen species, ROS)的生成有关。DDP通过影响肿瘤细胞抑制蛋白p53的表达,调节死亡受体的肿瘤坏死因子(tumor necrosis factor α, TNF-α)等表达,导致细胞线粒体功能障碍,通过调控细胞内质网应激影响钙信号转导,增加ROS表达水平[2]。
2 DDP肾毒性的发病机制
DDP进入机体后,90%可与血浆蛋白结合,且大部分直接经肾脏排泄,并在肾脏中具有高聚集、高排泄、高代谢的特点。大剂量或连续给予DDP可引起肾脏近端肾小管上皮细胞不可逆急性坏死,肾脏结构和功能紊乱,严重时会导致肾衰竭甚至死亡。DDP进入肾小管细胞,会发挥多重作用,最终导致细胞凋亡或坏死,其中最常见的是细胞毒作用(核DNA损伤)、细胞器功能障碍(转运体)、诱导细胞凋亡、氧化应激、炎症信号通路等,如Fig 1所示。
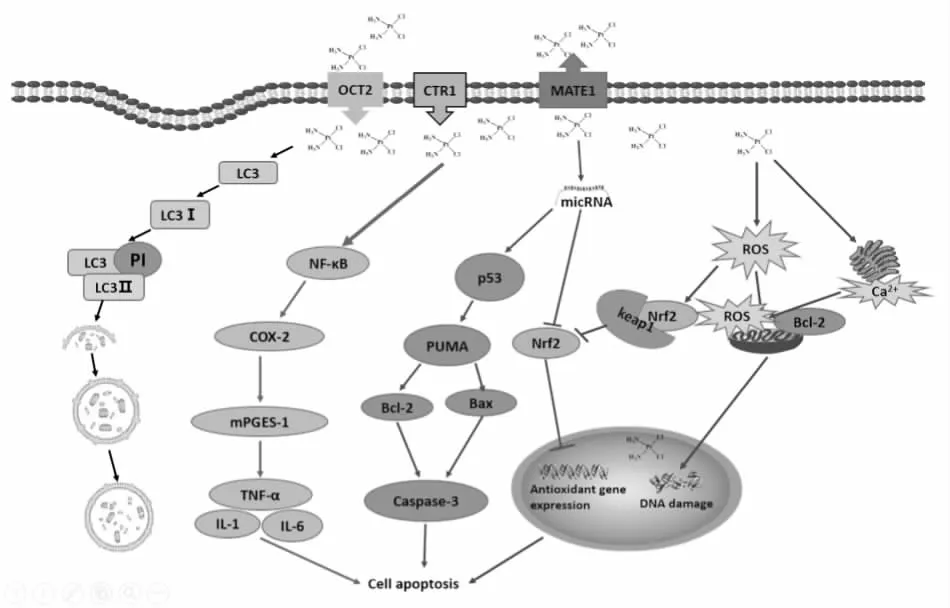
Fig 1 Pathogenesis of DDP nephrotoxicity
2.1 DDP细胞毒作用DDP是由与2个氯离子和2个氨分子连接的中心铂离子组成的一种简单的顺式无机分子,其进入体内后结合成加合物展现出较好的抗癌活性[1]。DDP诱导的细胞毒性不是因为重金属本身,而是高浓度DDP转化成的反应性代谢物进入细胞内环境引起的。随着现代医学的发展,DDP细胞毒作用的发病机制日渐清晰:(1)肾脏细胞通过被动扩散的方式摄取高浓度的DDP,被转化成1个或2个氯化物配体被细胞内含有的氧、氮、巯基等大量亲核基团取代形成新加合物,受DNA静电引力的作用,向细胞核迁移,与DNA结合形成加合物,抑制DNA的合成和复制,从而抑制细胞分裂。(2)DDP可以抑制除DNA之外的RNA、影响蛋白质和磷脂等细胞成分合成。(3)抗氧化剂防护作用缺失。DDP使还原性谷胱甘肽耗竭或失活,还能产生一种具有肾毒性的代谢产物,导致肾细胞毒性的发生[3]。
2.2 氧化应激与DDP肾毒性当机体受到某些内在或者外在因素异常刺激时,会释放出如氧自由基和氮自由基等高活性分子,破环机体氧化和抗氧化作用平衡,产生炎性细胞浸润,而对组织造成破坏。人体内绝大多数的自由基是ROS,正常浓度的ROS可参与到细胞增殖,但当ROS异常表达或过量时,则会以多种途径和方式对机体造成损伤,并且会破坏机体内的许多物质,如DNA和蛋白质等,诱使机体细胞和组织发生氧化性损伤[4]。DDP肾毒性的氧化应激反应机制主要分为两方面:一是DDP结构中亲核氨基可与水分子作用产生大量的ROS。细胞内ROS增加会使线粒体膜脂质过氧化,线粒体功能失效,从而导致Na+,K+-ATP酶活性下降,导致细胞内离子分布不均衡,抑制氧化呼吸链的正常传递,进而导致能量合成障碍,促发级联损伤反应,使线粒体功能失效,破坏蛋白质、核酸及染色体,促进DNA损伤和细胞凋亡,损害几乎所有的细胞成分;二是自由基清除剂减少或受到抑制。研究表明,番茄红素、辣椒素、维生素C、维生素E、谷氨酰胺等抗氧化剂可减轻或避免DDP的肾脏毒性作用[5]。此外,DDP在水合代谢过程中会产生大量ROS,紊乱细胞内代谢,激活内质网钙泵从而导致细胞钙稳态失衡,从而使Ca2+介导的代谢活化,造成细胞内代谢紊乱。细胞内Ca2+失调也是DDP肾毒性的重要因素。线粒体的电子传递系统在DDP的作用下,还能产生大量的自由基,也是DDP诱发ROS增加的原因之一。由此可见,大量ROS与细胞内Ca2+超载共同作用,促进DDP产生肾毒性,氧化应激成为加剧DDP肾毒性的关键影响因素。
2.3 炎性反应与DDP肾毒性炎症级联反应是DDP肾毒性的又一主要原因。研究表明,TNF-α、白细胞介素-1(interleukin-1, IL-1)和白细胞介素-6(interleukin-6, IL-6)等炎症基因的表达在DDP致急性肾损伤中均有增加[6]。TNF-α可以直接诱导细胞释放大量炎症细胞因子和炎症介质,触发众多细胞因子启动、乃至全身炎症反应的关键性因子,对炎症和机体免疫都有重要的作用。DDP在体内产生的羟基自由基(-OH)也可以通过调控核转录因子(nuclear transcription factor-k B, NF-κB),参与p38信号通路和环氧合酶-2(cyclooxygenase-2, COX-2)/mPGES-1(microsomal prostaglandin E synthase-1)信号通路,使TNF-α表达量增加,诱导炎症级联反应的发生。
2.4 细胞凋亡与DDP肾毒性自主调控细胞凋亡是机体为了适应生存环境和维持机体内环境的平衡,在非病理条件下主动进行的一种死亡过程。凋亡在机体的生存中具有特殊的意义,可以促进机体正常发育,维持细胞的更新和机体内各组织器官的体积。当凋亡细胞过少时,受损伤的细胞大量存活和累积,机体会出现癌症或自身免疫性疾病;而凋亡细胞过多时,则会出现神经退化性疾病和心肌缺血等疾病。研究发现,DDP肾毒性与细胞凋亡密切相关,DDP可以通过调控线粒体的凋亡信号分子p53、Bcl-2、Bax、含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)等表达,使线粒体膜通透性增加,诱导肾小管上皮细胞触发线粒体凋亡途径[7]。DDP也可以通过调控细胞膜上的肿瘤坏死因子受体(tumor necrosis factor receptor type 1,TNFR1),上调Fas/Fas-L系统表达,诱发由死亡受体介导的细胞外源性途径凋亡,引起肾毒性。另有研究发现,DDP与内质网细胞色素P450相互作用,通过调控凋亡信号分子Caspase等的表达,激活肾小管上皮细胞中的内质网凋亡途径,引起细胞凋亡,加剧肾毒性[2]。
2.5 其他DDP肾毒性参与者
2.5.1转运体 研究显示,DDP主要通过膜转运体向肾小管上皮细胞内转运,而有机阳离子转运体2 (organic cation transporter 2,OCT2)、铜离子转运蛋白(copper transporter 1,CTR1)和肾脏有机阳离子反向转运体—多药物和有毒化合物排出转运蛋白1(multidrugandtoxic compound extrusion protein 1,MATE1)参与了肾小管细胞摄入DDP的过程。OCT2和CTR1 时肾小管上皮细胞基底膜侧高表达的两种膜转运体,OCT2可将血液中多种阳离子以易化扩散的方式转入肾小管上皮细胞中;CTR1参与体内铜离子的转运,同时,也可以介导肾小管上皮细胞对DDP的主动转运[8]。有研究表明,OCT2抑制剂—西咪替丁,可有效减轻DDP对肾小管上皮细胞的毒性作用,其机制主要是抑制了新分离的人近端肾小管上皮细胞对DDP的摄取。另有研究表明,MATE1参与肾小管细胞中DDP的泵出过程,介导DDP外排,使DDP在肾脏组织中蓄积减少,从而减轻肾损伤。
2.5.2miRNA 微小RNA(microRNA,miRNA)是一类长度一般约为22个核苷酸的内源性非编码单链RNA。成熟的miRNA主要通过与靶mRNA的3’端非编码区(3’-UTR)碱基配对的方式,对靶mRNA进行切割,或者抑制其翻译、表达,进而影响多种生理病理过程。研究发现,多种miRNA与DDP肾毒性的生物学特性有着密切的关系,有望成为最有前景的DDP肾毒性的生物标志物。Bhatt等[9]研究发现,在DDP肾毒性体内外模型中,miR-34a可通过激活p53信号通路发挥重要作用;Zhu等[10]研究发现,DDP作用于人肾小管上皮细胞(HK-2细胞),上调miR-181a可以激活Bcl-2信号通路启动凋亡相关信号通路;Joo等[11]研究发现可以通过调控核因子NF-E2相关因子(nuclear factor-erythroid 2-related factor 2,Nrf2)增加miR-125b的转录抑制碳氢化合物受体阻遏剂(hydrocarbon receptor repressor,AhRR),从而保护DDP诱导的肾损伤。
3 DDP肾毒性的药物治疗
目前,临床上仍缺乏有效预防和治疗DDP肾毒性的药物。近几年临床用于保护DDP肾损伤的药物主要集中在两个方面:一是血管扩张药(血管紧张素抑制剂);另一方面则建立在水化和利尿的基础上,常用的药物包括高浓度氯离子溶液、利尿药、脱水剂等。近年来如抗氧化剂(谷胱甘肽)、血小板活化因子拮抗剂和激素等新的肾功能保护剂也被开发上市。天然药物具有多靶点、多效应、不易产生耐药性等优点,因此很多研究者将目光集中于天然药物抗DDP肾毒性的研究,并从天然产物中发现了很多高效低毒的抗DDP肾毒性药物,有望在抗DDP肾毒性药物研究方面取得质的飞跃。
4 用于预防和治疗DDP肾毒性的中药复方
中药复方是以中医理论为基础,依据君臣佐使原则,选择多味中药(两种或两种以上)按照一定的比例进行配伍而制成的方剂。由于DDP肾毒性的发病机制复杂,涉及多个方面,因此根据药物之间的相互作用,按照适当比例配制,提高治疗效果和减少不良反应,以达到防治和治疗DDP肾毒性的目的。曹思思等[12]研究发现,由大黄、丹参、土茯苓、枳壳、生牡蛎和甘草组成的肾复舒颗粒能够明显降低顺铂肾毒性,其机制与上调Nrf2抗氧化通路和外排蛋白的表达有关;李淑贞等[13]研究发现,由黄连、肉桂和玄参组成的新交泰饮可以有效改善DDP肾毒性大鼠肾功能,减轻肾脏的病理变化;连燕娜等[14]研究发现,由人参、黄芪、当归、何首乌、茯苓和枸杞子等组成的益气补肾方可以显著性降低DDP引起的大鼠肾脏系数,肾组织Pt含量、血尿素氮(blood urea nitrogen,BUN)和血肌酐(creatinine,Cr)含量增高。
5 用于预防和治疗DDP肾毒性的中药提取物
中药提取物是利用物理化学的方法从动植物中定向获取和浓集而得到的某一种或多种结构未被改变的有效成分。中药提取物疗效稳定、服用方便、质量可控,在抗DDP肾毒性方面有显著疗效(Tab 1)。
6 用于预防和治疗DDP肾毒性的中药活性成分
中药有效成分是从药用动植物中分离制备出的结构明确的单体化合物,大量实验研究证明,中药活性成分在抗DDP肾毒性中发挥着越来越重要的作用。目前可用于DDP肾毒性预防和治疗的中药活性成分有黄酮类、生物碱类、多酚类、萜类、皂苷类和蒽醌类等。
6.1 黄酮类槲皮素(quercetin)是一种常见的黄酮类化合物,具有抗炎和抗氧化等作用。研究发现,槲皮素具有抗DDP肾毒性的作用,它可以显著减少肾脏脂质过氧化、激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和NF-κB信号转导通路,减少促炎细胞因子和Caspase表达,抑制细胞凋亡。进一步研究证实槲皮素对DDP诱导的肾脏功能损害具有保护作用[15]。
芦丁(rutin)是一种天然黄酮类化合物,存在于多种植物中。研究表明,芦丁可以降低DDP诱导的肾毒性大鼠中BUN和Cr水平,抑制NF-κB、TNF-α和促炎因子的表达,减轻细胞凋亡来改善DDP肾毒性[16]。
水飞蓟素(silymarin)属二氢黄酮醇类化合物,来源于菊科植物水飞蓟种子中,成分为水飞蓟宾(silibinin)、异水飞蓟宾(isosilybin)、水飞蓟宁(silydianin)和水飞蓟亭(silychristin)等,水飞蓟宾是水飞蓟素的主要成分。水飞蓟素在治疗糖尿病、神经变性疾病、肝脏疾病和癌症等疾患中具有潜在的临床价值。Gaedeke等[17]研究发现,水飞蓟宾可以减轻蛋白尿的产生,保护肾小管功能,从而起到抗DDP诱导的肾脏损伤作用;Bokemeyer等[18]研究发现,水飞蓟宾在不影响DDP抗癌活性的同时,清除自由基,改善肾组织病理状态发挥抗DDP诱导的大鼠肾毒性。
橙皮苷(hesperidin)是一种来源充足的二氢黄酮类化合物,存在于自然界多种植物中,尤其在芸香科属植物的果皮中含量丰富。橙皮苷可以降低血清中BUN和Cr水平,抑制DNA降解,升高超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)、谷胱甘肽(glutathione,GSH)和过氧化氢酶(catalase,CAT)活力,降低肾脏内TNF-α和抗氧化防御系统的损伤,通过抑制氧化应激抗大鼠DDP肾毒性作用[19]。
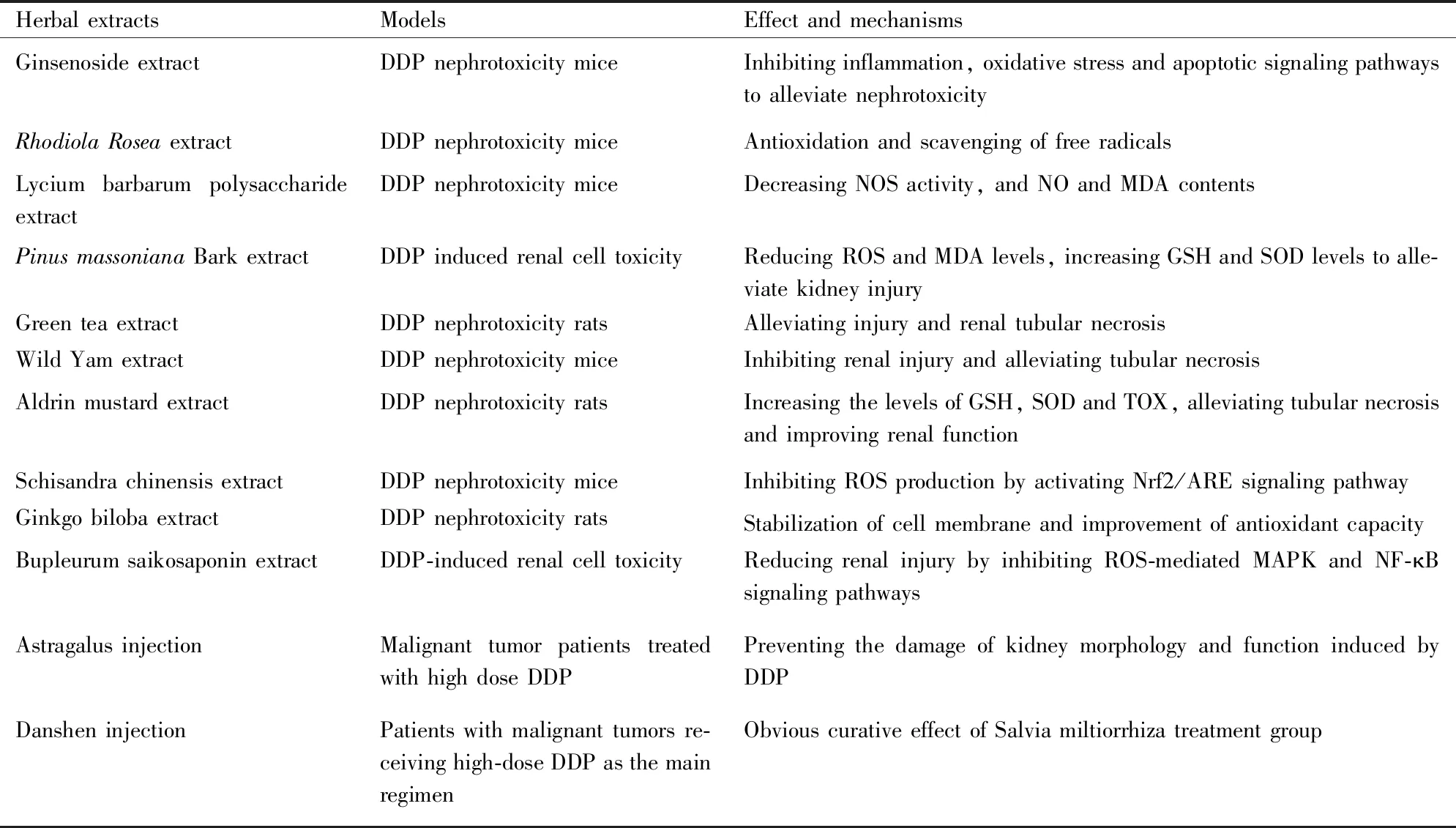
Tab 1 Anti-DDP nephrotoxicity effect of Chinese herbal extracts
6.2 生物碱类小檗碱(berberine)是从中药黄连、黄柏等小檗属植物根茎中提取得到,又称黄连素,是一种常见的异喹啉生物碱。研究发现小檗碱可以降低DDP诱导的肾毒性大鼠血清中BUN和Cr水平,减轻抗氧化防御系统的损伤。同时发现,小檗碱可以抑制大鼠肾脏组织中DDP诱导的TNF-α和NF-κB的表达,活化p53以及caspase-3,通过改善氧化应激、抗炎和抗细胞凋亡发挥抗DDP肾损伤作用[20]。
川芎嗪(ligustrazine)属吡嗪类生物碱,可从伞形科植物川芎、姜科植物温莪术、大戟科植物痛风麻疯树根茎中提取。Sohu等发现川芎嗪可以显著降低DDP诱导的氧化应激和组织学损伤,改善肾脏功能,抑制促炎反应和管状细胞凋亡[21]。
6.3 多酚类姜黄素(curcumin)是从姜科姜黄属植物中提取的一种天然多酚类色素,具有良好的生物学活性。研究表明,姜黄素可以恢复DDP引起的内源性抗氧化剂的消耗,通过抑制NF-κB、促炎因子和粘附因子的表达,抑制DDP引起炎症反应,减轻炎症反应防御系统的损伤;姜黄素降低肾组织中丙二醛(malondialdehyde,MDA)活性,提高NAD-依赖性去乙酰化酶Sirtuin-1(Sirt1)和Nrf2基因表达,减轻抗氧化防御系统和线粒体介导的凋亡损伤,减轻抗氧化反应和抗细胞凋亡防御系统的损伤[22]。
鞣花酸(ellagic acid)是一种广泛存在于蔓越桔、石榴、苹果、黑莓、草莓和胡桃等软果、坚果中天然多酚组分。研究表明,鞣花酸通过抑制肾损伤的早期肾脏损伤分子(kidney injury molecule 1, Kim-1)和簇蛋白表达,改善DDP肾毒性;提高肾小球滤过率,减轻肾小管上皮细胞扩张和凋亡;提高抗氧化酶的活力,抑制氧化应激反应,减少炎症介质和凋亡标志物的产生,从而缓解DDP肾毒性[23]。
白藜芦醇(resveratrol)是从虎杖、花生、葡萄、决明子等植物性食物或药物中提取的一种天然多酚类物质。研究表明,白藜芦醇可以通过激活Sirt1和Nrf2介导的内源性抗氧化防御系统来减轻DDP肾毒性;降低血清BUN和Cr水平,削弱NF-κB的活化,从而抑制DDP引起的炎症反应;下调p53和Sirt1乙酰化,恢复Bax/Bcl-2蛋白比率,在不影响DDP抗癌活性的基础上,通过细胞凋亡信号通路抑制DDP肾毒性发生。
6.4 萜类β-石竹烯(β-caryophyllene)多来源于丁香叶油、丁香茎油、肉桂叶油中,是一类双环倍半萜类化合物。Osman等[24]研究发现β-石竹烯可以降低NADPH氧化酶2(NADPH oxidase 2,NOX-2)和NADPH氧化酶4(NADPH oxidase 4, NOX-4)等蛋白表达,通过抑制氧化应激反应、炎症反应和触发细胞凋亡途径来减轻DDP肾毒性。另有研究表明β-石竹烯通过激活大麻素受体2(cannabinoid receptors 2,CB2)对DDP肾毒性起保护作用。临床实验也证明,β-石竹烯具有良好的安全性和耐受性可被开发为新一代具有肾脏保护作用的药物。
鼠尾草酸(carnosic acid)属双萜类化合物,来源于迷迭香、鼠尾草等唇形科植物的叶中。体内外实验已证实鼠尾草酸具有抗氧化、延缓衰老、抗菌、抗肿瘤、神经保护和抑制脂肪细胞分化等多种生理活性,可降低血脂,用于治疗肥胖、心血管病及癌症。研究表明,鼠尾草酸可以通过降低血清BUN和Cr水平,降低细胞色素酶P450 2E1(cytochrome P450 2E1,CYP2E1)活性,降低血红素氧合酶-1(hemeoxygenase-1,HO-1)、NF-κB等表达水平,减少4-羟基壬烯酸的表达,抑制caspase-3活化来缓解DDP肾毒性[25]。
6.5 皂苷类薯蓣皂苷(dioscin)是从穿山龙、山药等植物中分离纯化到的一种甾体皂苷类化合物。Zhang等[26]研究发现,薯蓣皂苷可以通过调控miR-34a/Sirt1信号通路改善炎症和氧化应激反应发挥对DDP肾毒性的保护作用,分子对接技术初步预测Keleh样环氯丙烷相关蛋白-1(epoxy chloropropane Keleh sample related protein-1, Keap1)和NF-κB p65可能是薯蓣皂苷抗DDP肾毒性的药物作用靶点。
人参皂苷(ginsenoside)是从人参等植物中提取分离的一种三萜皂苷类化合物。Baek等[27]经研究发现人参皂苷可以降低乳酸脱氢酶(lactatedehydrogenase, LDH)泄漏,增加肾小管上皮细胞的生存能力,从而减轻DDP肾毒性;人参皂苷也可通过抑制DNA损伤的细胞凋亡生物标志物,如磷酸化c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)、p53和活化Caspase-3表达来减轻炎症反应、抑制细胞凋亡改善DDP诱导的肾损伤。
桔梗皂苷D(platycodin D)是从双子叶植物桔梗科植物桔梗根中提取分离的一种三萜皂苷类化合物。研究表明,桔梗皂苷D可以通过降低血清BUN和Cr水平,抑制一氧化氮合酶(inducible nitrfic oxides synthase, iNOS)和COX-2表达,抑制NF-κB的核易位,缓解DDP肾毒性;也可通过抑制ROS的产生,减轻肾小管上皮细胞凋亡,缓解DDP诱导的肾损伤[28]。
6.6 蒽醌类大黄素(emodin)具有抗菌、抗炎、抗氧化、抗病毒、降糖、调脂和免疫调节等药理作用,属于蒽醌类化合物。研究表明,大黄素对DDP诱导人肾小管上皮细胞(HK-2细胞)损伤具有保护作用。此外,大黄素可以通过抑制近端肾小管溶酶体中N-乙酰-β-D-氨基葡萄糖苷酶的表达,减轻DDP诱导的肾损伤。Liu等[29]研究发现,大黄素通过调节腺苷酸激活蛋白激酶(adenosine 5′-monophosphate (AMP)-activated protein kinase, AMPK)/ 哺乳动物雷帕霉素靶点(mammalian target of rapamycin, mTOR)信号通路,使Caspase-3活性下降,激活自噬发生,改善体外DDP肾毒性。
7 展望
DDP肾毒性发病机制复杂,早期诊断困难,且缺乏有效的治疗方案。天然药物副作用较少,且具有很好的抗DDP肾毒性的作用,在治疗DDP肾毒性中具有广阔的开发前景。因此,在抗DDP肾毒性的研究中阐明天然药物抗DDP肾毒性的成分和靶点具有十分重要的作用。我国拥有丰富的自然资源将会在抗DDP肾毒性创新药物研发中发挥重要作用。

