微血管张力测定技术在血管内皮去除中的应用
张文文,唐 娜,孙瑞霞,钟 华,何 芳
(1.新疆石河子大学第一附属医院重症医学科,新疆 石河子 832002;2. 新疆石河子大学医学院病理生理教研室,新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002)
高血压是全球范围内影响人类健康最常见的心脑血管病之一,已成为目前重大的公共卫生问题。其患病率居高不下,且呈持续上升的趋势[1],目前我国高血压控制现状低于发达国家,因此,我国高血压防治任重而道远。
已知长期过高的血压导致血管内皮功能障碍,而血管内皮功能障碍与心脑血管疾病也紧密相关,是其发生发展的病变基础,因此改善血管内皮功能已成为心脑血管疾病治疗的关键靶点[2]。
目前,关于微血管测量技术在疾病研究中应用的报道逐年增多,但是由于该技术操作步骤复杂、费时,限制了该技术在国内的应用普及[3]。尤其对于血管内皮功能障碍的研究,国内尚无统一的标准;已有关于血管内皮去除方式的研究,存在大小动脉相互混淆的现象,并不完全适用于所有微动脉的研究。而笔者对微血管压力肌动血管内皮的去除所作的研究汇报,有助于血管内皮去除的标准化,提高微血管测量技术研究数据的可信度。
1 材料
1.1 实验动物12周龄 ♂ ,体质量(200~250)g,自发性高血压大鼠(spontaneous hypertensive rats,SHR)和正常血压大鼠(Wistar-Kyoto rats,WKY),每组各6只,购自北京维通利华实验动物技术有限公司(动物合格许可证编号SCXK(京)2007-0001),符合SPF清洁级标准。饲养条件:温度(20±2) ℃、湿度(48±2)%。大鼠分笼饲养,饲养期间,大鼠自主饮食,自由饮水。适应性饲养1周后开始实验,所有实验均在符合动物实验伦理要求下进行。
1.2 实验试剂及配制苯肾上腺素(phenylephrine,PE,批号:LRAA9501)、硝普钠(sodium nitroprusside,SNP,批号:LRAA2556)、吲哚美辛(indomethacin,批号:WXBC4210V)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA,批号:0915S04)均购自美国Sigma公司;乙酰胆碱(acetylcholine,ACh,批号:BCBR3675V)购自美国APexbio公司;L-NAME(批号:S287702)购自美国Selleck公司;其余试剂均为国产分析纯。
溶液配制:生理盐溶液(physiologic saltsolution, PSS)成分(mmol·L-1):NaCl 118.9, KCl 4.69,MgSO4·7H2O 1.17,KH2PO41.18,CaCl22.5, NaHCO325,EDTA 0.026,G 5.5。高钾外液(high potassium physiological salt solution,KPSS,相当于60 mmol·L-1KCl)成分(mmol·L-1):KCl 123. 70,MgSO4·7H2O 1. 17,KH2PO41. 18,CaCl22. 5,NaHCO325,EDTA 0.026,G 5.5。充分摇匀溶解后,充入混合气体(95%O2+5%CO2),氧饱和10~15 min,时间过久易致液体中气体过多,最后粘附于血管上,pH调节至7.40后使用。所配置的液体均放置在冰箱(4 ℃)中保存,使用前充分摇匀。
1.3 仪器压力肌动图系统(DMT,110P型)(丹麦Denmark公司)、倒置相差显微镜(美国Olympus公司)、光学显微镜(日本Olympus公司)、P-97微电极拉制仪(美国Sutter公司)、微型负压吸引器(GL-802型)(海门市其林贝尔仪器制造有限公司)、撕囊镊和角膜剪(苏州六六视觉科技有限公司)、Dumont镊子(意大利)等。
2 方法
2.1 大鼠血压测量使用BP-6鼠尾无创血压测量仪检测大鼠清醒安静状态下尾动脉血压,每只不少于3次,结果取平均值。
2.2 标本制备大鼠腹腔注射戊巴比妥钠 40 mg·kg-1,待动物麻醉后断头处死,迅速取出肠管,注意:误用力牵拉肠管,置于4 ℃、氧饱和的PSS液中。在装有固定胶的培养皿中固定标本,注意:固定时不宜过度牵拉。在显微镜下仔细分离2级肠系膜动脉血管分支,注意区分动静脉(动脉细、圆,弹性好,色浅;静脉扁、宽,弹性差,色深)。仔细清除动脉周围脂肪、结缔组织,注意手法一定要轻柔,勿用力牵拉血管,碰触血管,避免损伤血管内皮,降低血管活性。剪取无分支的血管段(长度2~3 mm)备用。
2.3 血管套接及血管内皮去除(Fig 1) 首先,排空微电极两端的气体,将血管一端套接在玻璃微电极上(直径约50 μm),注意误碰及玻璃微电极尖端,防止电极断裂或电极玻璃碎渣进入血管,平衡升压阶段,随压力升高,液体流动,划破血管,致数据不准或实验失败。用10-0眼科尼龙线固定血管。用装有过滤PSS液注射器缓慢冲走血管内的残留物,注意手法要轻,误用力过猛,损伤血管内皮。而微血管内皮去除,国内目前尚未见标准的方法。本研究方法其实施步骤如下:对于去除内皮的血管环,用撕囊镊夹取血管的无需测量部分,将血管围绕电极尖端轻轻旋转1圈[4],破坏血管内皮的完整性,注意:手法要轻,误刺穿血管。然后血管一端套接完成后,用注射器向血管内推注气体,再次破坏血管内皮完整性。之后用装有过滤PSS液的注射器缓慢冲洗血管,以相同的方法套接血管的另一端。给予血管活性药物之前,先给予吲哚美辛(环氧合酶抑制剂)、L-NAME(NO合酶抑制剂)共同预孵育血管20 min,且其持续存在于整个实验过程[5]。将血管固定好的灌流槽迅速转移至倒置显微镜台上,开启光学显微镜,调整放大倍数为10 (物镜)×10 (目镜)。将与电极两端相连的玻璃瓶盖用力旋紧,使其形成一个密封系统。接着进行管路气体的排除,用装有5 ml过滤PSS液的注射器将P1端管路里的气体排至装有过滤PSS液(100 mL)的玻璃瓶中,P2端管路里气体排至废液瓶中,整体形成一个液封状态,确保整个循环中无残留气体,以防气体流动至血管腔中,造成血管损伤。操作期间注意手法要轻缓,步骤要清晰,以免损坏压力换能器。在恒温(37 ℃)的水浴槽中持续恒速通以(95% O2和5% CO2)混合气体。
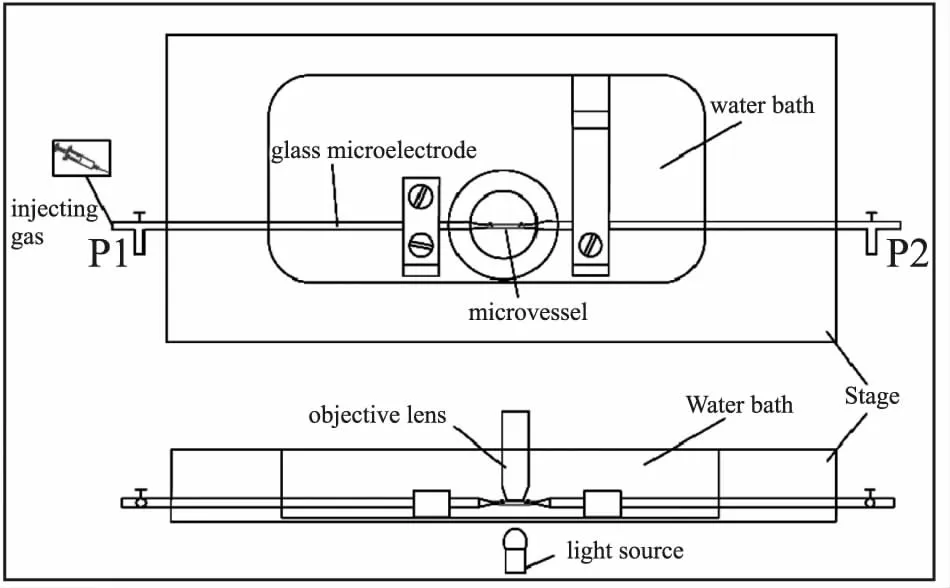
Fig 1 Vascular socket and endothelial removal in water bath of pressure motor system
2.4 压力平衡及血管活性检测初始平衡阶段保持液体流动,参数设定(首先开启压力、温度,P1端20 mmHg,P2端5 mmHg),以便冲走血管内的残留物,平衡持续时间约为3 min;然后调整参数(P2端上调至20 mmHg,时间 5 min,之后以10 mmHg为一个梯度,每个梯度稳定5 min,使管腔内压力逐渐升至60 mmHg稳定);之后血管在60 mmHg稳定孵育1 h,平衡孵育期间每20 min更换1次水浴槽内的PSS液体。平衡稳定1 h后进行标准化检测。先用血管收缩剂KCl(60 mol·L-1)收缩血管,激发最大血管活性,收缩平稳后,用内皮依赖性血管舒张剂ACh (10-5mol·L-1)舒张血管——舒张幅度大于70%~80%可认为内皮完整,小于10%则认为血管内皮去除。之后用PSS液连续冲洗3次,再次平衡稳定20 min后开始实验。
2.5 记录药物对血管舒缩活动的影响检测血管符合实验标准后,正式开始实验时,打开负压吸引器(给药期间负压吸引器处于持续开启状态),水浴槽内的PSS液控制在5 mL,采取累积给药法依次加入不同浓度PE、ACh和/或SNP (10-9mol·L-1,10-8mol·L-1,10-7mol·L-1,10-6mol·L-1,10-5mol·L-1和10-4mol·L-1),在血管反应达稳定状态后,依次逐渐加入高一级别浓度的药物,分别观察并记录该药物对血管直径的作用。用Myoview软件控制血管内压力并记录实验数据。
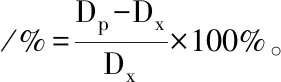

3 结果
3.1 大鼠血压值比较如Fig 2所示,与WKY大鼠相比,SHR的血压值(SBP、DBP、MAP)明显增高(P<0.01)。
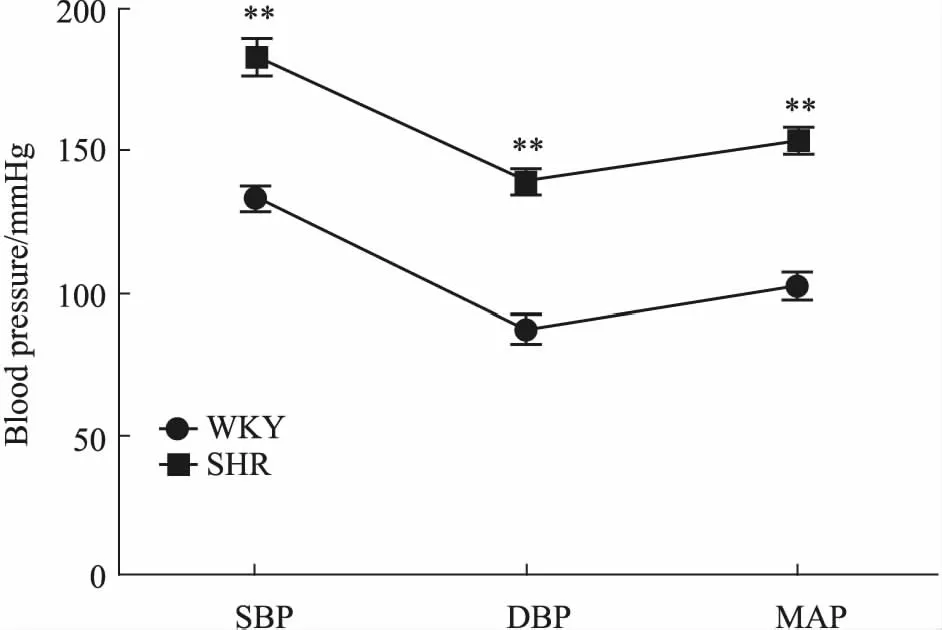
Fig 2 Comparison of blood pressure values between
3.2 血管内皮对大鼠肠系膜动脉血管收缩反应的影响给予不同浓度的PE收缩血管,观察其对大鼠肠系膜动脉血管直径的影响(Fig 3),WKY和SHR肠系膜动脉对PE的收缩反应呈现明显的浓度依赖性,随PE浓度增加,血管收缩逐渐增大;无论内皮完整还是去除时,各浓度PE诱发的SHR血管收缩反应均明显大于WKY大鼠(P<0.05)。内皮完整时,当PE浓度为10-7mol·L-1~10-4mol·L-1时,WKY和SHR肠系膜动脉收缩率分别为(3.21±0.32)%vs(8.96±1.00)% (P<0.01)、(7.56±0.90)%vs(15.93±0.92)% (P<0.01)、(30.59±1.00)%vs(40.78±0.63)% (P<0.01)、(34.52±0.40)%vs(44.56±0.68)% (P<0.01)。内皮去除时,当PE浓度为10-8~10-4mol·L-1时,WKY和SHR肠系膜动脉收缩率分别为(1.45±0.23)%vs(5.87±0.20)% (P<0.01)、(2.84±0.27)%vs(12.65±0.36)% (P<0.01)、(23.72±0.53)%vs(30.46±0.47)% (P<0.01)、(37.71±0.51)%vs(46.15±0.46)% (P<0.01)、(39.17±0.43)%vs(48.16±0.41)% (P<0.05)。而WKY和SHR内皮去除组分别与其内皮完整组相比,收缩反应增强,当PE浓度为10-6mol·L-1~10-5mol·L-1时,WKY肠系膜动脉收缩率分别为(7.59±0.90)%vs(23.72±0.53)% (P<0.01)、(30.59±1.00)%vs(37.71±1.25)% (P<0.01)。当PE浓度为10-8mol·L-1~10-5mol·L-1时,SHR肠系膜动脉收缩率分别为(5.16±0.92)%vs(5.87±0.20)% (P<0.05)、(8.96±1.00)%vs(12.65±0.36)% (P<0.01)、(15.93±0.92)%vs(30.46±0.47)% (P<0.01)、(40.78±0.63)%vs(46.15±0.46)% (P<0.01)。
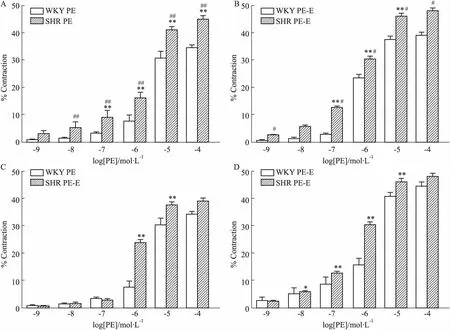
Fig 3 Comparison of contractions and diastolic amplitudes of mesenteric artery inWKY and n=6)
3.3 血管内皮对大鼠肠系膜动脉血管舒张反应的影响给予不同浓度的ACh、SNP舒张血管后,观察其对大鼠肠系膜动脉血管直径的影响(Fig 4),WKY和SHR肠系膜动脉对ACh、SNP的舒张反应呈现明显的浓度依赖性,随ACh、SNP浓度的增加,血管舒张逐渐增大。内皮完整时,各浓度ACh诱发的SHR血管舒张反应均明显小于WKY大鼠(P<0.01);内皮去除时,各浓度SNP诱发的SHR血管舒张反应均明显大于WKY大鼠(P<0.01),当ACh浓度为10-7mol·L-1~10-6mol·L-1时,WKY和SHR肠系膜动脉舒张率分别为(48.00±3.68)%vs(17.50±2.87)% (P<0.01)、(61.40±2.32)%vs(26.50±1.89)% (P<0.01)。当SNP浓度为10-7mol·L-1~10-5mol·L-1时,WKY和SHR肠系膜动脉舒张率分别为(2.86±0.50)%vs(21.59±0.30)% (P<0.01)、(7.37±0.68)%vs(40.10±0.40)% (P<0.01)、(13.78 ±1.22)%vs(46.41±0.12)% (P<0.05)。
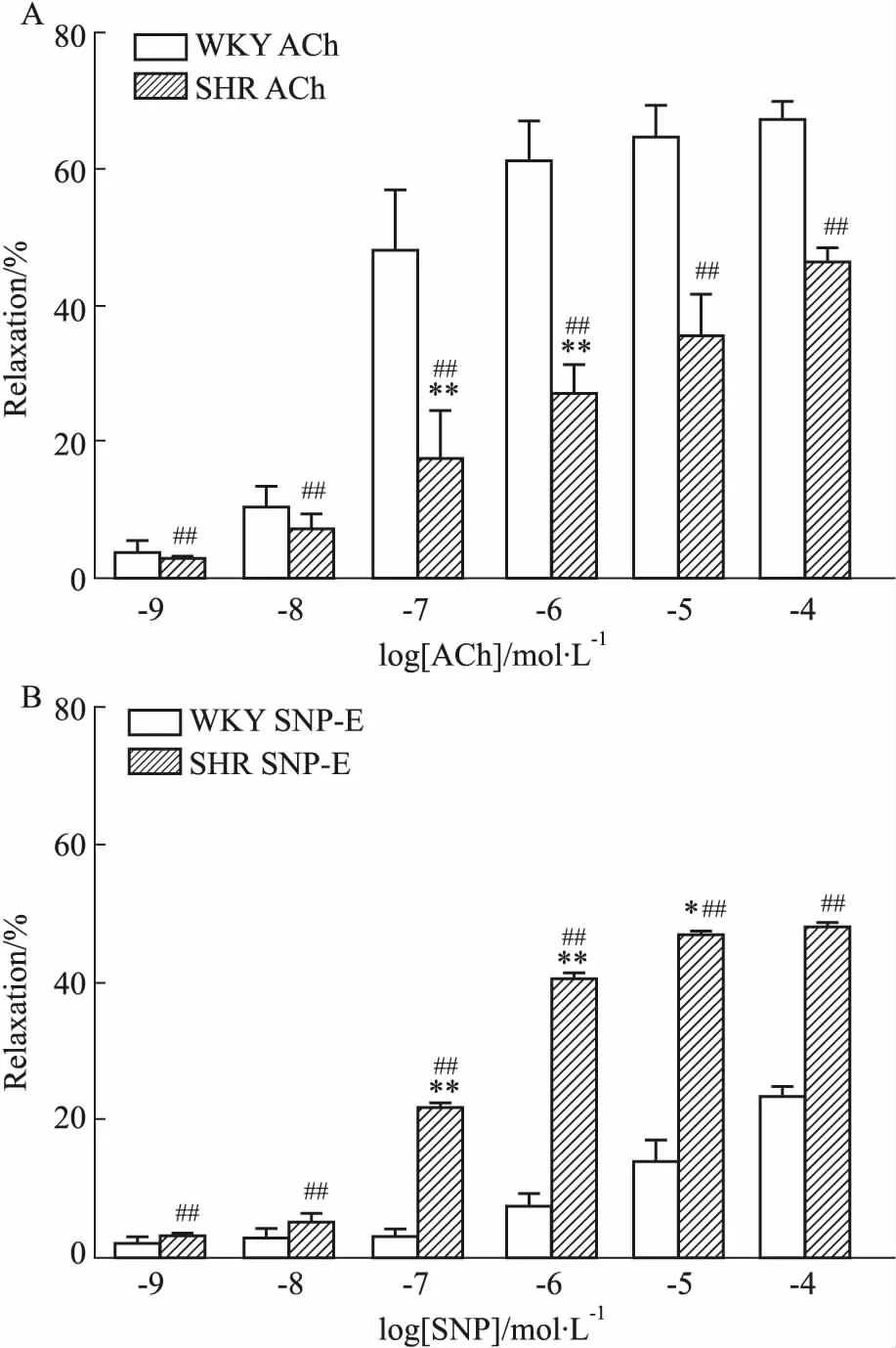
Fig 4 Comparison ofcontractions and diastolic amplitudes of mesenteric artery inWKY and SHR n=6)
4 讨论
机体微血管对组织器官的血流供应以及正常血压的维持发挥着重要作用[7],微血管结构功能障碍也是高血压、冠心病、中风等疾病的危险因素。研究表明,高血压为心脑血管疾病的主要诱因,发病的关键部位在血管,直接发病环节为外周血管阻力增高[8],严重影响着人们的身心健康;同时微动脉与大动脉血管功能损伤也是高血压发病的主要原因。完整的血管内皮在调节血管张力、正常血压的维持、抑制血小板粘附和聚集以及白细胞的粘附、平滑肌细胞增殖等生理过程中具有重要作用[9]。在高血压的发生发展过程中,血管内皮在受到高血糖、高血脂、氧化应激及体内高浓度的同型半胱氨酸等一系列有害因素作用时,内皮细胞释放的舒血管因子减少,缩血管因子增多,打破了血管平衡稳态,从而导致血管收缩功能异常等一系列心脑血管事件的发生[10-11]。本研究结果也表明:SHR肠系膜动脉呈现明显的血管收缩和舒张功能障碍。
血管内皮细胞是衬于心、血管和淋巴管内表面的单层扁平或多角形细胞,可通过分泌一系列血管活性物质发挥调节血管紧张性、抗血栓形成、抑制平滑肌细胞增殖及血管壁炎症反应等功能[12]。内皮功能障碍是多种心血管疾病的标志(血管收缩、血栓形成和炎症反应),通过合成和释放内皮源性收缩因子(超氧阴离子、血栓素A2、内皮素、血管紧张素II等)、舒张因子(NO、前列环素I2、ACh、内皮源性超极化因子等),在血管张力、血压调节、凝血、炎症等过程中发挥关键作用。因此,对于维持血管内环境稳定,血管内皮起着至关重要的作用。所以,微血管、血管内皮已成为心脑血管疾病研究的重要方向。
已有的血管张力、压力肌动技术报道,对大动脉和小动脉的血管功能研究报道也是相互混淆。目前已有的血管内皮去除的研究报道多为机械(棉签、钢丝、头发丝摩擦等)和药物(注射Triton X-100溶液)去除两种方式[13-14]。笔者认为已有研究报道的血管内皮去除方式多适用于大动脉、血管张力的研究,由于微血管压力肌动研究属于等张收缩研究,且血管直径过小,操作困难,对血管活性的要求高于普通血管张力系统的研究,已有报道的血管内皮去除方式并不完全适用于微动脉的研究。本研究采取压力肌动技术检测微血管功能,该技术的优点在于对血管本身及血管活性损伤较小,更好的模拟动物体内环境。本技术不同于普通血管张力研究,钢丝需穿过血管的方式,容易损伤血管内皮,使实验结果缺乏准确性[15]。本研究采取血管套接在玻璃微电极(直径约50μm),镊子只需捏住套接电极的部分,而需要检测的血管段保留其血管结构和功能的完整性,降低实验数据的误差。对于血管内皮的去除,本研究摒弃以往棉签、钢丝摩擦的方式,采取机械和药物相结合的方式,将血管围绕玻璃微电极尖端轻轻旋转1圈[4],血管一端套接完成后,向血管内推注气体,破坏血管内皮。上述方式保证血管的良好活性,但不能保证血管内皮完全去除,所以给药阶段继续给予吲哚美辛(环氧合酶抑制剂)、L-NAME(NO合酶抑制剂)共同预孵育血管20 min,抑制内皮源性舒张因子(NO、前列环素I2)的释放,且吲哚美辛和L-NAME持续存在于整个实验过程[5]。本研究方法不同于已有研究报道的单纯将血管围绕玻璃微电极尖端旋转1圈[4]或者向血管内推注气体,容易损伤血管,降低血管活性,不能更好的模拟动脉生理状态,且不能保证血管内皮去除的程度。本研究在综合既往研究报道的基础上,经过反复实践,证明本血管内皮去除的方法,可以大大降低对血管活性的损伤,更好的保证了血管的活性,结构、功能的完整性,提高实验数据的准确性。在本研究中,每个内皮去除的血管环,均给予KCl收缩血管,待稳定后,给予ACh舒张血管,幅度小于10%,可以认为血管内皮的去除。本研究结果显示:血管内皮去除后,WKY和SHR的血管收缩增强,以10-5mol·L-1最明显(P<0.01)。对血管舒张的检测,内皮完整时,与WKY大鼠相比,SHR的舒张功能明显减弱;内皮去除后,给予内皮非依赖性血管舒张剂SNP,WKY大鼠的舒张反应明显减弱,本研究结果与已有的研究相似,高血压大鼠血管收缩反应增强,舒张反应减弱。笔者认为此血管内皮去除的技术方法可以用于之后的微血管内皮功能障碍研究中,以提高微血管测量实验数据的准确性和可靠性。
(致谢: 本实验在新疆地方与民族高发病教育部重点实验室完成,感谢课题组成员的帮助与支持。)

