双亚苄基哌啶与蛋白酶体抑制剂对舌癌细胞毒性作用及机制
陈静坤,叶展超,郑晓辉,张锦雀
(1. 厦门大学附属中山医院口腔科,福建 厦门 361000;2. 厦门医学院机能与临床转化福建省高校重点实验室,福建 厦门 361023;3. 福建医科大学附属口腔医院,福建 福州 351004)
黏附调节分子1(adhesion regulating molecule 1,ADRM1)亦被称为 hRpnl3(human Rpn13),是26S蛋白酶体亚单位19S调节颗粒上的主要泛素受体之一,决定26S蛋白酶体结构不对称性。ADRM1介导的蛋白酶体泛素化路径介导NF-κB、TGF-βI型受体、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等底物蛋白降解[1]。研究表明[2-5],ADRM1在结肠癌、肺癌、肾癌、肝癌等多种实体瘤和急性白血病中均处于过表达状态,下调 ADRM1蛋白表达可明显促进癌细胞凋亡。 因此,ADRM1可能成为肿瘤治疗靶点。有研究表明[2, 6-11],双亚苄基哌啶RA190可与ADRM1的半胱氨酸88共价结合,快速触发多泛素蛋白累积,诱导对硼替佐米耐药的多发性骨髓瘤细胞凋亡,也抑制卵巢癌、肝癌、肝内胆管癌等多种肿瘤细胞增殖;也有大量研究报道蛋白酶体抑制剂MG132通过抑制泛素蛋白酶体途径活性,诱导肺癌[12]、Burkitt淋巴瘤[13]、急性髓系白血病[4]、肝癌、结直肠癌[14]等癌细胞凋亡;协同全反式维甲酸诱导GTF2I-RARA融合基因阳性的HL60细胞分化[15]。
那么,RA190与MG132在舌癌细胞中作用效果如何呢?本实验拟通过观察舌癌细胞株CAL27和TCA8113在RA190或MG132药物作用下存活率变化及周期与凋亡情况,比较这两种药物对舌癌细胞的毒性作用及作用机制,为临床治疗舌癌药物选择提供参考。
1 材料与方法
1.1 材料
1.1.1细胞株 舌癌细胞株CAL27、TCA8113为福建医科大学口腔医学院馈赠。
1.1.2试剂 MG132(Cat. No. HY-13259)结构见Fig 1、RA190(Cat. No. HY-100739)结构见Fig 2、CCK8(Cat. No. MA0218)(MCE,中国),ADRM1(Cat. No.12019)、Cyclin B1(Cat. No.12231)、Bak(Cat. No.6947)、Bax(Cat. No. 5023)蛋白Western blot用一抗体(CST,美国),DMEM、D-hanks、PBS(Corning,美国),胰酶(Gibigo,美国),胎牛血清(Cat. No.900-108,Gemini,南美),PI(KeyGEN Biotech,中国);Annexin V FLUOS Staining Kit(Cat. No. 11858777001,Roche,德国)。
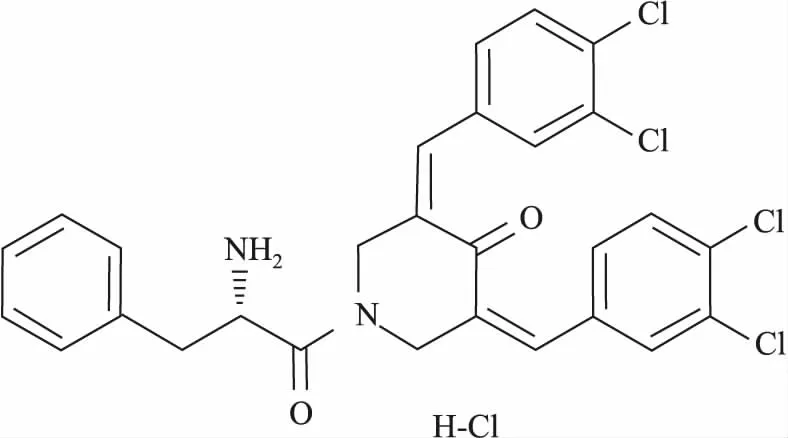
Fig 1 Chemical structure of RA190
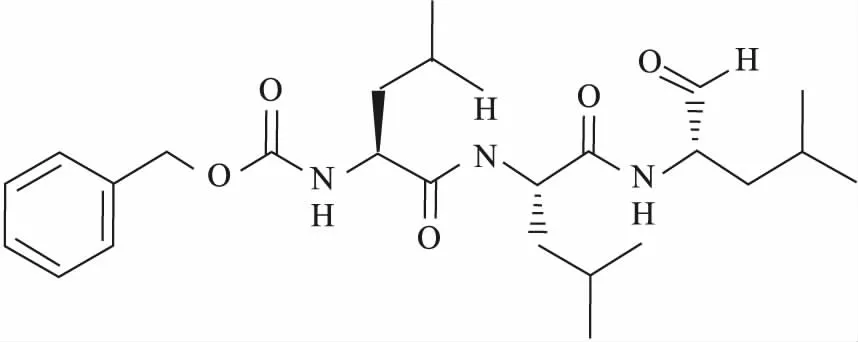
Fig 2 Chemical structure of MG132
1.1.3仪器 二氧化碳细胞培养箱2323-2(SHELLAB公司);倒置显微镜37XA(上海光学仪器厂);酶标仪(Bio-rad公司);流式细胞仪EPICSXL(贝克曼库尔特公司);电泳仪PowerPac HC(Bio-Rad公司);快速Western blot仪器MA01821(Millipore);垂直电泳槽VE-180(上海天能科技有限公司)。
1.2 方法
1.2.1细胞增殖/毒性实验 设(0.1、0.2、0.4、0.8、1.6、3.2、6.4 μmol·L-1)不同浓度RA190或MG132实验组、对照组(无药)和空白组(不含细胞)。在96孔板中接种100 μL细胞悬液(细胞浓度2×108·L-1),于37℃、5% CO2培养箱预培养24 h;吸弃培养基,向每孔加入100 μL含不同浓度RA190或MG132的完全培养基,孵育24h;每孔加入10 μL CCK-8 ,在培养箱内孵育3 h;用酶标仪测定在450/630 nm处的吸光度。绘制曲线。
1.2.2流式细胞术检测细胞周期 6孔板中接种2 mL细胞悬液(细胞浓度5×108·L-1),于37℃、5% CO2培养箱预培养24 h;吸弃培养基,向每孔加入2 mL含不同浓度RA190或MG132的完全培养基,孵育24h后,收集细胞于5 mL PBS中,800 r·min-1离心5 min, 弃上清,预冷的PBS洗2次,300 μL预冷的PBS重悬沉淀后,吸取700 μL预冷的无水乙醇逐滴滴入重悬液中,置-20℃固定过夜,之后按PI说明书操作。
1.2.3Annexin V FLUOS Staining Kit流式细胞术检测细胞凋亡 用Annexin V FLUOS Staining Kit检测细胞凋亡率。细胞加药及收集步骤同“1.2.2”,之后按说明书操作。
1.2.4Western blot检测细胞内蛋白表达 细胞加药培养步骤同“1.2.2”,收集各组细胞,PBS洗2次,加入RIPA细胞裂解液(含1 mmol·L-1PMSF、1 mmol·L-1正钒酸钠、10 mg·L-1抑肽酶)提取总蛋白,BCA法测定蛋白质浓度,取40 μg总蛋白进行Western blot实验。10% SDS-PAGE电泳后,行转膜印迹,分别用β-actin、ADRM1、Cyclin B1、Bax、Bak一抗体与膜上的抗原结合,然后用HRP偶联的二抗与其反应,用ECL化学发光试剂检测,经压片曝光后,显影和定影。比较各组蛋白表达情况。设2个复孔,不同时间独立重复3次。
2 结果
2.1 RA190或MG132对舌癌细胞存活率的影响以细胞浓度2×108·L-1种板,CCK-8法酶标仪检测RA190或MG132 (0、0.1、0.2、0.4、0.8、1.6、3.2、6.4 μmol·L-1)作用24 h后舌癌细胞CAL27、TCA8113的OD450/630值。设3个复孔,不同时间独立重复3次。如Fig 3所示,随着MG132浓度提高,CAL27、TCA8113细胞活力下降,半抑制浓度IC50分别约为0.1和0.3 μmol·L-1;其中,当MG132浓度在0.2~1.6 μmol·L-1期间TCA8113细胞活力曲线处在平缓阶段,说明这期间MG132对TCA8113细胞毒性作用变化不大。RA190对CAL27、TCA8113细胞的IC50分别约为0.18和1.6 μmol·L-1;RA190浓度在0.2~0.8 μmol·L-1期间CAL27细胞活力曲线平缓,在0.8 μmol·L-1之后活力曲线处于平台阶段,说明部分CAL27细胞对RA190耐药;RA190浓度为0.8 μmol·L-1左右TCA8113细胞活力才开始下降,说明RA190需要在较大的浓度下才对TCA8113细胞产生毒性作用。

Fig 3 Cell viability of CAL27 and TCA8113 cells treated with different RA190 or MG132 concentrations for 24 h
2.2 RA190、MG132对舌癌细胞周期作用细胞以5×108·L-1接种6孔板2 mL,设0.5、1 μmol·L-1RA190或MG132实验组和对照组,各组2个复孔,流式细胞术检测各组细胞周期变化,独立重复实验3次。如Fig 4、Tab 1所示,0.5、1 μmol·L-1RA190(R0.5, R1)均诱导CAL27细胞G1/G0期停滞,对TCA8113周期无影响;1 μmol·L-1RA190也诱导CAL27细胞G2/M期停滞;0.5、1 μmol·L-1MG132(M0.5,M1)均诱导CAL27细胞G2/M期停滞,对TCA8113周期无影响。
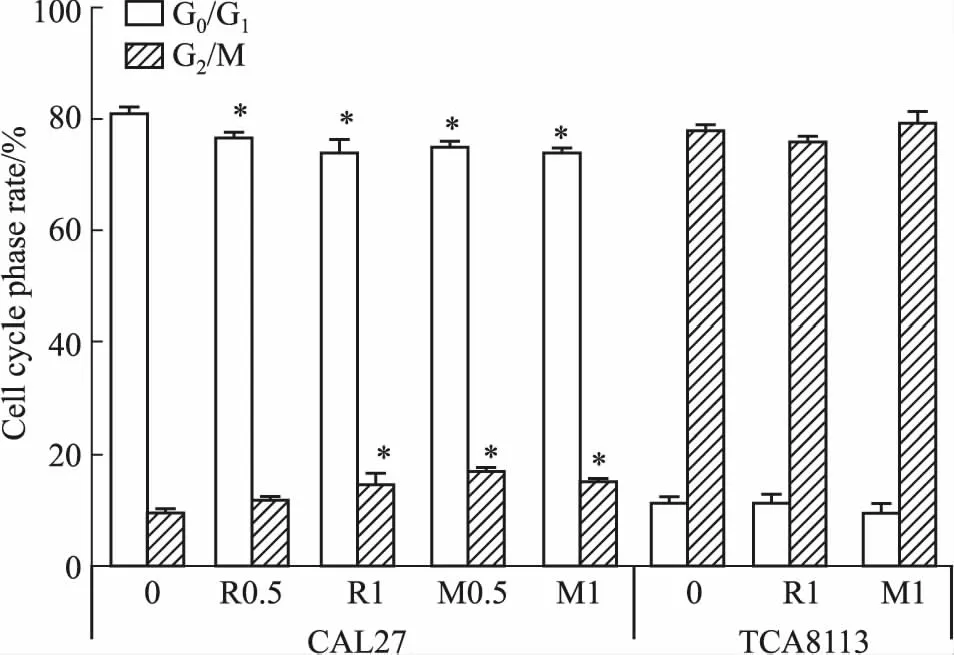
Fig 4 Cycle of CAL27 and TCA8113 cells treated with different concentrations of RA190 or MG132 for 24 h n=3)
2.3 RA190、MG132对舌癌细胞凋亡影响细胞以5×108·L-1接种6孔板2 mL,设0.5、1 μmol·L-1RA190或MG132实验组和对照组,各组2个复孔,流式细胞术检测各组细胞凋亡,独立重复实验2次。如Fig 5、Tab 2所示,在0.3、0.5、1 μmol·L-1MG132作用下,CAL27与TCA8113细胞早期与晚期凋亡率均提高(P<0.05),并与剂量呈线性关系;0.5、1 μmol·L-1RA190均对CAL27凋亡无影响,1 μmol·L-1RA190提高TCA8113细胞早期与晚期凋亡率[(4±1)%,(5.97±0.86)%;P<0.05)]。
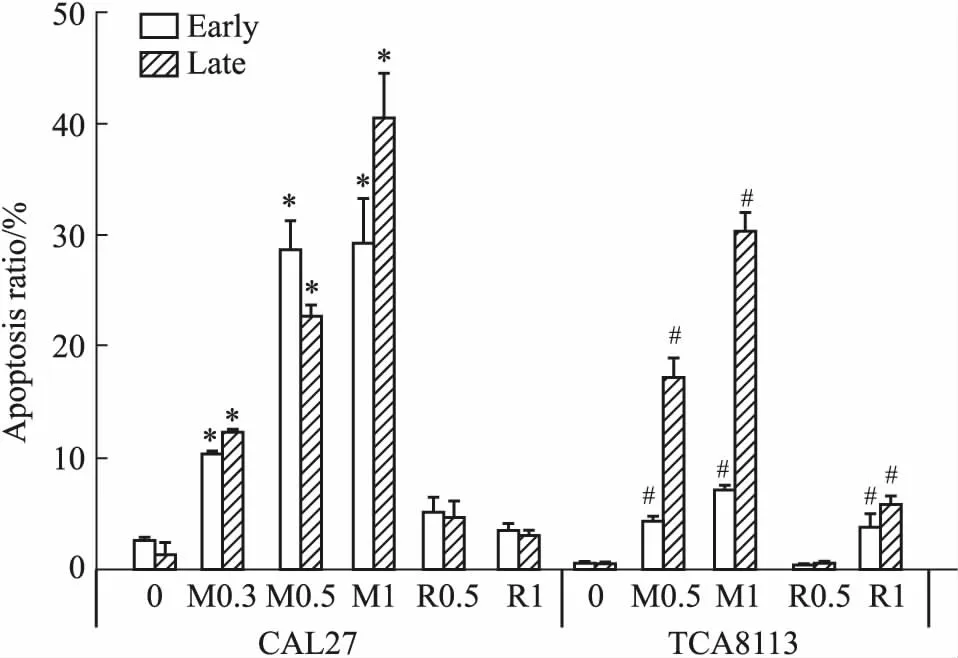
Fig 5 Apoptosis of TCA8113 cells treated with 1 μmol·L-1 RA190 or MG132 for 24 n=3)
2.4 RA190、MG132对舌癌细胞内ADRM1、Cyclin B1、Bax、Bak蛋白表达的影响为探讨RA190与MG132对舌癌细胞的毒性作用与ADRM1的相关性及两药作用机制差异性,本实验采用Western blot检测 0.5、1 、2 μmol·L-1RA190或MG132(R0.5,R1,R2;M0.5,M1,M2)作用24 h后,舌癌细胞内ADRM1、Cyclin B1、Bax、Bak蛋白表达变化。如Fig 6所示,TCA8113细胞内ADRM1蛋白水平显著低于CAL27细胞(P<0.05);随着RA190或MG132药物浓度提高,Cyclin B1蛋白表达上调(P<0.05),ADRM1、Bax、Bak蛋白表达下调(P<0.05);TCA8113细胞在1 μmol·L-1RA190作用下ADRM1、Bak、Cyclin B1蛋白表达差异不大,而在相同浓度MG132作用下,Bax表达下调、Cyclin B1表达上调。
Tab 1 Cycle of CAL27 and TCA8113 cells treated with different concentrations of RA190 or MG132 for 24 h n=3)
Tab 2 Apoptosis of CAL27 and TCA8113 cells treated with different concentrations of RA190 or MG132 for 24 h n=3)
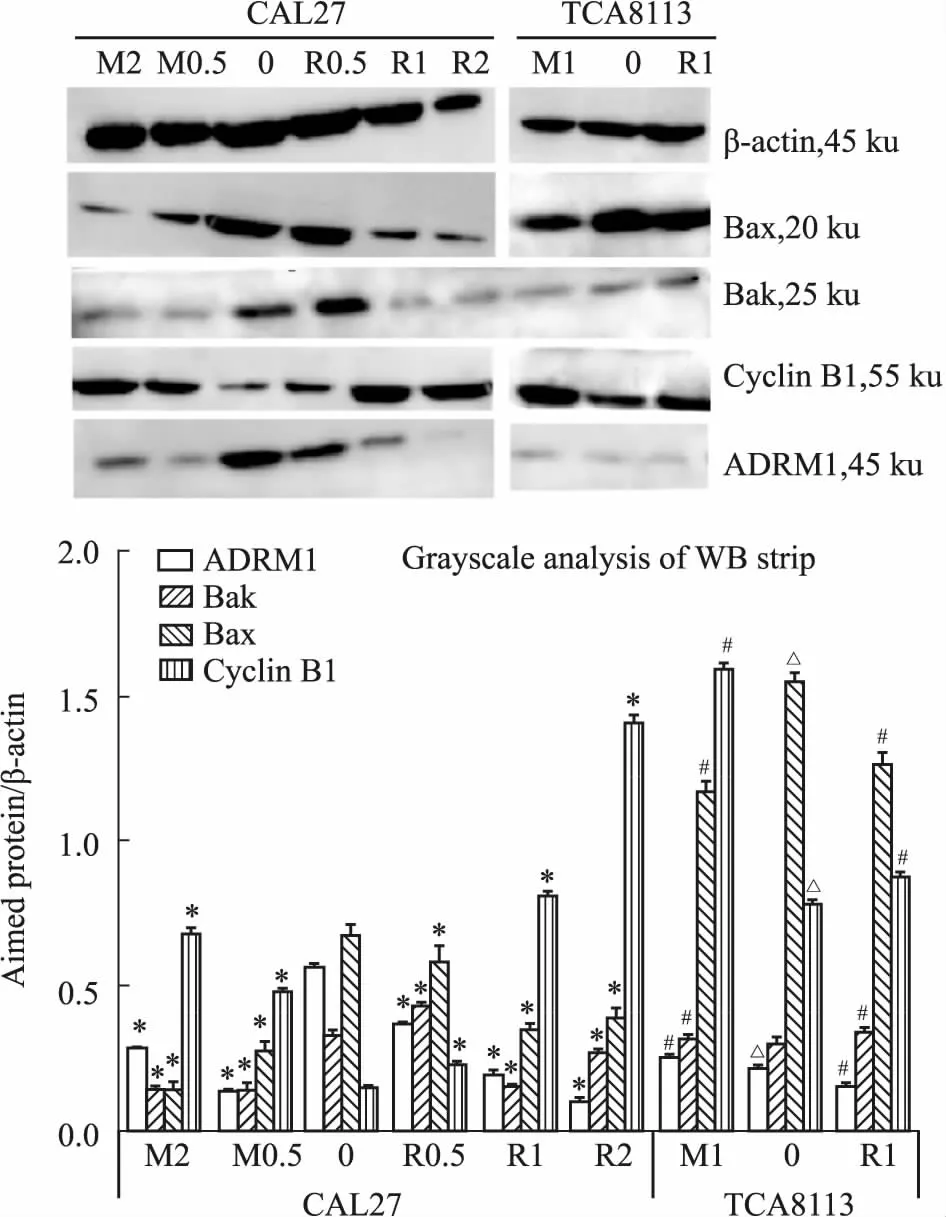
Fig 6 Expression of ADRM1, Cyclin B1, Bax and Bak protein in CAL27 and TCA8113 cells treated with different concentrations of RA190 or MG132 for 24 h n=3)
3 讨论
实验中,本课题组发现,TCA8113细胞种板24 h后,有大量悬浮细胞,这些细胞经台盼蓝染色观察,活率达75%;吸取悬浮细胞种板,大量细胞仍可贴壁。因此,药物对舌癌细胞的毒性观察应包含这部分悬浮细胞。综合Fig3~5结果:①RA190组:RA190引起CAL27细胞活力下降,对CAL27细胞凋亡无作用,提示RA190可能主要通过阻滞CAL27细胞于G0/G1或G2/M期引起细胞活力下降;相反,RA190对TCA8113周期无显著影响,但在0.8 μmol·L-1之后通过促凋亡作用对TCA8113细胞产生毒性作用;RA190作用下舌癌细胞活力曲线中间部分较为平缓,可能是贴壁细胞对RA190较不敏感。这提示RA190在舌癌中作用具有很大的选择性和局限性。② MG132组: MG132诱导CAL27细胞G2/M期停滞,对TCA8113细胞无影响;MG132明显提高CAL27与TCA8113细胞早期与晚期凋亡率,说明MG132主要通过促进细胞凋亡引起舌癌细胞活力下降;MG132可影响CAL27周期和凋亡,这导致MG132对CAL27细胞毒性作用强于TCA8113细胞。
在哺乳动物细胞中,Cyclin B从G1期晚期开始表达并逐渐积累,到G2期后期阶段达到最大值并一直维持到M期的中期阶段,然后迅速降解。CAL27细胞在RA190或MG132作用下G2期阻滞,此时细胞内Cyclin B1蛋白表达上调,两者结果一致。
Bak、Bax是人体重要促凋亡分子,下调Bax、Bak蛋白表达,可能抑制细胞凋亡,从而提高细胞存活率。但本实验中MG132明显促进CAL27细胞凋亡,此时Bax、Bak蛋白表达减少,两者存在矛盾。这可能是MG132促CAL27细胞凋亡时,细胞内存在负反馈调节;也可能提示MG132对CAL27细胞促凋亡作用存在其他机制,具体有待进一步研究。这为后续实验提供新思考。
MG132与RA190明显下调CAL27内ADRM1蛋白表达,但RA190对该细胞凋亡无明显作用,提示ADRM1不是影响舌癌发生发展的癌基因。同时,RA190下调CAL27内ADRM1蛋白表达,与其浓度呈线性关系,而MG132则不存在这种线性关系,这说明ADRM1介导的蛋白酶体泛素化路径不是MG132在舌癌细胞中的主要作用途径;MG132在舌癌中存在其他重要作用通路,具体有待进一步研究。另外,MG132明显促进CAL27细胞凋亡,具有明显毒性作用,可能用于舌癌治疗,但由于其作用靶点不单一,因此可能存在较多的副作用。
综上,本研究认为靶向ADRM1药物RA190仅适用于ADRM1高表达舌癌治疗,但其IC50浓度相对MG132较高,用于舌癌治疗可能并不理想;本研究同时也为舌癌临床采用蛋白酶体抑制剂策略奠定基础。

