磁共振成像在肝硬化背景下肝癌诊断中的应用价值
杨明
周口市中心医院影像科,河南 周口466000
肝硬化是许多终末期肝病的病理过程,随着肝硬化的不断发展,后期会出现肝癌的迹象[1]。肝硬化结节通常具有恶变趋势,或者某些结节已发生恶变。在临床实践中,许多肝硬化患者在发现肝癌病变时已发生进展或转移,无法通过手术治疗[2]。相关研究指出,70%的肝癌细胞是基于肝硬化产生的[3]。肝硬化结节的准确诊断对其治疗具有重要意义。计算机断层扫描(CT)等常规检查方法难以诊断出非典型生长或直径小于2 cm 的肝癌结节,并且容易漏诊或误诊,延误早期治疗[4]。磁共振成像(MRI)具有多参数和多切面成像的特点,并且具有良好的组织分辨率[5]。动态增强MRI 有利于提高肝癌的检出率,为患者的治疗和预后提供帮助。本研究探讨了MRI 在肝硬化背景下肝癌诊断中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2017 年1 月至2018 年12 月于周口市中心医院就诊的肝硬化患者。纳入标准:①经腹部彩超检查发现有直径≤2 cm 的可疑小结节;②经手术或穿刺活检病理确诊;③接受MRI 检查。排除标准:①既往有肝脏手术史;②影像学检查前有放化疗等抗肿瘤治疗史;③合并其他恶性肿瘤。依据纳入和排除标准,本研究共纳入80 例肝硬化患者,共97 个病灶。80 例患者中,男45 例,女35 例;年龄为41~78 岁,平均年龄为(53.36±9.22)岁;体重指数为19.00~23.80 kg/m2,平 均 体 重 指 数 为(21.50±2.20)kg/m2;有吸烟史41 例;有饮酒史52 例;均伴有乙型肝炎病毒感染;肝硬化病程为2~6 年,平均病程为(3.65±1.00)年;病灶直径为0.5~2.0 cm,平均直径为(1.20±0.33)cm;病灶部位:肝左叶35 个,肝右叶40 个,左右叶交界处22 个。
1.2 MRI 检查
采用GE3.0HDXT 超导型核磁共振扫描仪进行检查,扫描范围为膈顶至肝下缘,首先执行常规T1WI 双回波和T2WI 压脂扫描,然后进行动态对比增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)和磁共振弥散加权成像(magnetic resonance-diffusion weighted imaging,MR-DWI)。DCE-MRI:采用T1WI 脂肪抑制序列,重复时间(repetition time,TR)为420 ms,回波时间(echo time,TE)为14 ms,层厚为5 mm,层间距为2.0 mm,视野为400 mm×300 mm。静脉内注射造影剂钆喷酸葡胺0.1 mmol/kg,2 ml/s,延迟15 s 用于动脉相扫描,70 s 后进行静脉相扫描,3~5 min 后进行延迟相扫描;扫描时屏住呼吸,分别进行冠状面、矢状面和横截面的图像重建。MRDWI:单次屏气扫描,上下设置预饱和带,在层面选择、相位编码和频率编码方向上施加弥散敏感梯度,b=0、500、1000 s/mm2,TR 为3600~5000 ms,TE 为1.8~2.5 ms,矩阵为256×256,视野为380 mm×440 mm,层厚为5 mm,层间距为1.2 mm。比较病变与周围正常肝实质之间的表观扩散系数(appar‐ent diffusion coefficient,ADC)。
体素内不相干运动(intravoxel incoherent mo‐tion,IVIM)序列:12 个b 值(b=0、20、100、150、200、300、400、500、600、800、1000、1200 s/mm2),TR 为4400 ms,TE 为45 ms,视野为380 mm×440 mm,层厚为5 mm,扫描时间为6 min 49 s。扩散峰度成像序列:3 个b 值(b=0、1000、2000 s/mm2),30 个扩散方向,TR 为4300 ms,TE 为54 ms,视野为380 mm×440 mm,层厚为5.5 mm,扫描时间为15 min 29 s。
1.3 观察指标
选择两名具有5 年以上影像诊断经验的影像医师阅片并进行讨论达成共识。通过阅读胶片,检测和记录常规MRI 表现、ADC 值、真实扩散系数(D 值)、假性扩散系数(D*值)及灌注分数(f 值)。以病理结果为金标准,分析MRI 对肝癌的诊断价值。灵敏度=真阳性例数/(真阳性+假阴性)例数×100%,特异度=真阴性例数/(真阴性+假阳性)例数×100%,准确度=(真阳性+真阴性)例数/总例数×100%,阳性预测值=真阳性例数/(真阳性+假阳性)例数×100%,阴性预测值=真阴性例数/(真阴性+假阴性)例数×100%。
1.4 统计学方法
采用SPSS 22.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。采用受试者工作特征(receiver operat‐ing characteristic,ROC)曲线分析ADC 值、D 值、D*值对肝癌的诊断价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 MRI 诊断结果和病理结果
经手术或穿刺活检病理检查,97个病灶中65个病灶为肝癌,32 个病灶为肝硬化结节。MRI 诊断肝癌的灵敏度、特异度、准确度、阳性预测值和阴性预测值分别为86.15%(56/65)、81.25%(26/32)、84.54%(82/97)、90.32%(56/62)和74.29%(26/35)(表1)。共有55 例患者诊断为肝癌,其中Ⅰ期19 例,Ⅱ期28 例,Ⅲ期8 例。

表1 MRI 诊断肝癌的结果与病理结果的对照
2.2 肝癌和肝硬化结节常规MRI 表现的比较
常规MRI 表现中,肝癌病灶中T1WI 呈稍低或低信号、T2WI 呈稍高信号、动脉期呈高信号、门静脉期呈低信号和延迟期呈低信号的比例均明显高于肝硬化结节病灶,差异均有统计学意义(P<0.01)。(表2)
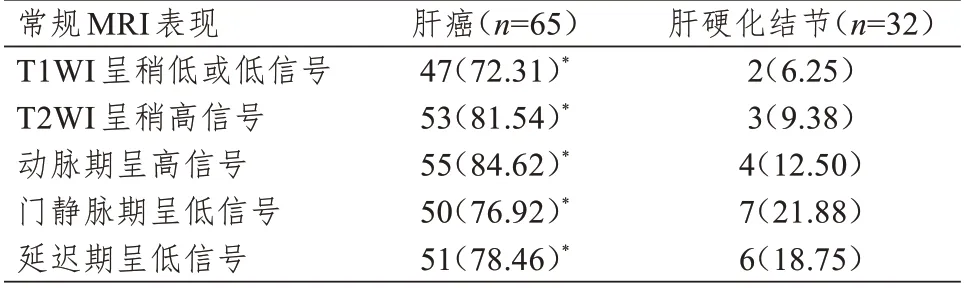
表2 肝癌和肝硬化结节常规MRI 表现的比较[n(%)]
2.3 肝癌和肝硬化结节ADC 值、D 值、D*值、f 值的比较
肝癌病灶的ADC 值、D 值和D*值均明显低于肝硬化结节病灶,差异均有统计学意义(P<0.01);肝癌和肝硬化结节病灶的f 值比较,差异无统计学意义(P>0.05)。(表3)
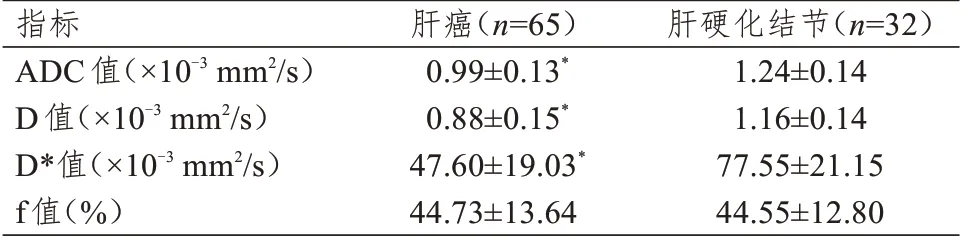
表3 肝癌和肝硬化结节ADC 值、D 值、D*值、f 值的比较
2.4 ADC 值、D 值和D*值单独及三者联合诊断肝癌的价值
ADC 值、D 值、D*值单独及三者联合诊断肝癌的ROC 曲线下面积分别为0.819、0.780、0.830 和0.920,P<0.05,截断值分别为1.10×10-3、1.02×10-3、60.60×10-3mm2/s 和0.70,灵敏度分别为75.50%、70.20%、78.00%和82.50%,特异度分别为70.00%、68.50%、75.50%和80.00%。(图1)
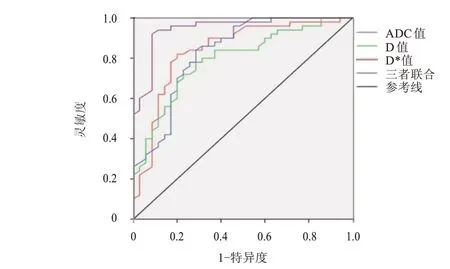
图1 ADC值、D值和D*值单独及三者联合诊断肝癌的ROC曲线
3 讨论
肝硬化是一种慢性进行性疾病,病理表现为肝细胞坏死、结节再生、纤维化和假小叶形成等弥漫性肝损害[6]。流行病学和实验研究数据表明,肝硬化是导致肝癌发生的高危因素,临床上肝硬化患者很容易发展为肝癌[7]。肝癌的早期诊断对于有效治疗和患者预后非常重要。目前,肝硬化的临床诊断主要依靠病理检查,病理活检是一项侵入性检查,但有些患者不符合活检指征,不能进行及时的诊断和治疗,导致疾病发展和病灶发生转移[8]。影像学检查具有非侵入性和直观性的特点,在临床诊断中具有重要价值[9]。
目前,MRI 的软组织分辨率较高,并且在肝硬化背景下肝结节的发现和表征方面优于其他影像学检查[10]。在MRI 检查过程中,可以通过T1WI、T2WI、动态增强扫描和弥散加权成像(diffusion weighted imaging,DWI)对肝癌患者细胞密度增加、动静脉失衡等病理特征进行评估[11]。普通T1WI 和T2WI 可以区分正常肝实质和肝脏背景中结节性病变的不同组织成分,包括纤维化变化、水和脂质成分等[12]。动态增强MRI 可以评估由动脉新血管形成增加和静脉血流量减少引起的动静脉失衡。肝癌的MRI 信号强度与肝癌组织的分化程度、组织中微量金属元素的沉积、细胞坏死和脂肪变性等密切相关[13]。本研究结果显示,肝癌病灶中T1WI 呈稍低或低信号、T2WI 呈稍高信号、动脉期呈高信号、门静脉期呈低信号和延迟期呈低信号的比例均明显高于肝硬化结节病灶,差异均有统计学意义(P<0.01)。其中T1WI 低信号与局灶性液化坏死和纤维化有关,T2WI 高信号与血管窦数量和细胞密度增加以及脂肪沉积和结缔组织减少有关[14]。ADC 值可以反映水分子扩散的整体情况。DWI 扫描完成后,可以计算图像的每个体素以自动生成ADC 图,DWI 图像可以直观地显示组织信号及其变化,并且可以在ADC 图上定量测量ADC 值[15]。低ADC 值表示组织水分子扩散受到限制,组织细胞密度高。但ADC 忽略了组织内灌注对扩散的影响。为了更真实地反映水分子在组织中的扩散和微循环灌注,有研究者提出了IVIM,该模型使用多个b 值,优于单指数DWI 对病变的评价[16]。D 值是真扩散系数或慢扩散系数,代表纯水分子在体素中的扩散;D*是假扩散系数或快扩散系数,代表体素中的毛细血管微循环灌注。这项技术可以同时测量组织中水分子的随机运动和毛细血管网络中的血流,反映了组织扩散的特征,还可以提供有关微循环灌注的信息[17]。本研究结果显示,肝癌病灶的ADC 值、D 值和D*值均明显低于肝硬化结节病灶(P<0.01),分析原因是小型肝癌组织中的肿瘤细胞密度较高,细胞外空间较小,细胞异型性的出现会限制水分子在细胞内外的扩散,导致肝癌的ADC 值和D 值明显降低。本研究中,肝癌病灶和肝硬化结节病灶的D 值均低于ADC 值,原因是ADC 值同时受扩散和微循环灌注的影响。D*值和f 值均可以反映组织中的灌注情况,D*值与平均血流量和平均毛细血管长度有关,f 值与毛细血管血流量的体积分数有关。肝癌的D*值较低可能是由于肝癌中新生血管形成的基底膜不完整和缓慢的血液流动削弱了灌注效果。肝癌的f 值稍高可能是因为新生血管相对丰富,毛细血管血流量较高。但肝癌和肝硬化结节病灶的f值比较,差异无统计学意义(P>0.05),可能是因为肝硬化结节中保留了更多的正常血管。
有研究显示,IVIM 的相应参数诊断良性和恶性肝脏病变的灵敏度和准确度均较差[18]。因此,在临床诊断中应结合常规影像学检查。本研究结果显示,ADC 值、D 值、D*值三者联合诊断肝癌的ROC 曲线下面积及灵敏度和特异度均高于任一指标单独诊断的结果。说明DWI 和IVIM 在区分肝癌病灶和肝硬化结节病灶中均具有重要意义。两者结合可以提高诊断价值,是常规MRI 诊断病变的补充方法。
目前DWI已用于常规MRI检查中,DWI在鉴别良性和恶性病变、预测恶性病变的发生和进展以及评估治疗反应方面具有巨大潜力[19-20]。本研究发现DWI 对肝癌的早期诊断具有重要意义。本研究还结合了最新的成像技术IVIM 来表征器官和病变的潜在复杂性,从而扩大了DWI 的应用潜力,极大地丰富了扩散图像的应用价值。引起肝硬化的原因很多,肝硬化可分为病毒性肝炎肝硬化、酒精性肝硬化、代谢性肝硬化、胆汁淤积性肝硬化、肝静脉回流受阻性肝硬化、自身免疫性肝硬化、毒物和药物性肝硬化、营养不良性肝硬化、隐源性肝硬化等。然而,本研究的样本量较少,并且未对肝硬化结节的不同类型和阶段进行分组和分析,仍需进一步研究。
综上所述,MRI 在肝硬化背景下肝癌的诊断中具有较好的应用价值,可提供客观诊断指标。

