微小RNA-205 对鼻咽癌细胞增殖、侵袭及迁移能力的影响
徐光,千建峰,刘涛
郑州人民医院耳鼻咽喉头颈外科,郑州4500000
鼻咽癌是一种恶性程度较高的头颈部恶性肿瘤,中国南方地区鼻咽癌的发病率明显高于北方,存在一定的地域差异[1]。鼻咽癌的发病较为隐匿,且恶性程度较高,因此,预后较差[2]。目前,尚不清楚鼻咽癌发生的确切机制,普遍认为鼻咽癌的发生可能与基因突变、基因易感性、外界环境、饮食习惯等因素有关,是多因素综合作用所致[3-4]。微小RNA(microRNA,miRNA)是 一 类 非 编 码 小RNA,其参与靶基因的转录调控,与机体的生理、病理过程密切相关,尤其在肿瘤发生、发展过程中发挥关键作用[5-6]。近年来,研究发现,miRNA-205在头颈部恶性肿瘤、消化系统恶性肿瘤、妇科恶性肿瘤等多种恶性肿瘤中发挥重要作用[7-9]。研究显示,miRNA-205 在鼻咽癌组织中异常表达[10]。本研究对miRNA-205 对鼻咽癌细胞增殖、侵袭和迁移能力的影响进行探讨,现报道如下。
1 材料与方法
1.1 细胞株与主要试剂
鼻咽癌细胞SUNE-1、HONE1、CNE2、C666-1、6-10B 均购自中国科学院上海生命科学研究院细胞资源中心。DMEM 培养基购自上海源培生物科技股份有限公司,胎牛血清购自天津康源生物技术有限公司,miRNA-205 引物、miRNA-205 minics、miRNA-205 inhibitor 和阴性对照质粒均由上海生工生物工程有限公司合成,逆转录试剂盒、SYBR Green Ⅱ实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒均购自大连宝生物工程有限公司,LipofectamineTM2000 转染试剂盒购自美国Invitrogen 公司。
1.2 方法
1.2.1 细胞培养与转染 鼻咽癌细胞SUNE-1、HONE1、CNE2、C666-1、6-10B 均采用含10%胎牛血清的DMEM 培养基于37 ℃、5%CO2及饱和湿度的培养箱中培养。待细胞生长至80%融合度时进行传代,取对数生长期的细胞用于转染实验。于转染前1 天将细胞接种于培养瓶中,不加抗生素。选取miRNA-205 相对表达量最高和最低的细胞进行转染实验,严格按照LipofectamineTM2000 转染试剂盒说明书的操作步骤将miRNA-205 minics、miR‐NA-205 inhibitor 和阴性对照质粒NC 转染至细胞。转染48 h 后,收集细胞进行后续的生物学功能检测实验。
1.2.2 实时荧光定量PCR 法检测miRNA-205 的相对表达量 收集正常培养的SUNE-1、HONE1、CNE2、C666-1、6-10B 细胞,采用Trizol 试剂从各细胞中提取总RNA,DEPC 水溶解,使用紫外分光光度计测定RNA 质量和浓度。按照逆转录试剂盒操作说明书进行逆转录反应,cDNA 产物于4 ℃保存备用。然后,按照SYBR GreenⅡ实时荧光定量PCR 试剂盒操作说明书的步骤进行实时定量PCR检测。PCR 的反应条件:95 ℃2 min 预变性(1 个循环);92 ℃15 s,60 ℃30 s,72 ℃30 s,共35 个循环。以GAPDH为内参,采用2-△△Ct法分析各细胞中miRNA-205 的相对表达量。实验重复3 次。
1.2.3 噻唑蓝(MTT)法检测细胞增殖能力 转染48 h 后收集细胞,以5000/孔细胞接种于96 孔培养板中,每组设5 个复孔,继续培养24、48、72、96 h后,采用MTT 法检测细胞的增殖能力,即每孔加入5 mg/ml 的MTT 溶液20 μl,于细胞培养箱中继续培养4 h,取出96 孔培养板,弃去培养液,每孔加入100 μl二甲基亚砜,振荡混匀,采用酶标仪于490 nm波长处分别检测转染24、48、72、96 h 后的细胞的吸光度(absorbance,A)值。实验重复3 次。
1.2.4 克隆形成实验检测细胞集落形成能力 转染48 h 后收集细胞,将800 个细胞接种于10 ml 培养皿中,在正常培养条件下培养细胞2 周后,弃去培养基,磷酸盐缓冲液轻柔冲洗3 次,加入4%多聚甲醛,室温固定20 min,弃去固定液,用去离子水缓慢冲洗干净,加入1 ml 结晶紫染液,染色3 min 后,再用去离子水缓慢洗去染色液,于显微镜下观察各细胞的集落形成能力。实验重复3 次。
1.2.5 Transwell 小室实验检测细胞迁移和侵袭能力 转染48 h 后收集细胞,以无血清培养基稀释成细胞悬液,在进行细胞迁移实验时,上室加入200 μl 含20 000 个细胞的悬液,下室加入600 μl 含血清的完全培养基,于培养箱中培养24 h 后,吸去上室培养液,用棉签擦去上室膜的细胞后,使用磷酸盐缓冲液洗涤渗透膜下层,于4%多聚甲醛溶液中室温固定20 min,用吉姆萨染液染色10 min,于显微镜下计数迁移细胞数目。在进行细胞侵袭实验时,需先将matrigel 加入Transwell 上室,置于37 ℃培养箱中孵育4 h,其余操作步骤同迁移实验。实验重复3 次。
1.3 统计学分析
采用SPSS 20.0 软件对数据进行统计分析。计数资料以例数和率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用t检验或单因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 miRNA-205 在鼻咽癌细胞中的表达情况
实时荧光定量PCR 检测结果显示,SUNE-1、HONE1、CNE2、C666-1、6-10B 细胞中miRNA-205的相对表达量分别为(0.89±0.10)、(0.08±0.02)、(1.12±0.24)、(0.04±0.02)、(0.43±0.07)。CNE2 细胞中miRNA-205 的相对表达量最高,C666-1 细胞中miRNA-205 的相对表达量最低,选取CNE2 和C666-1 细胞进行转染实验。CNE2 细胞转染miR‐NA-205 inhibitor 后,miRNA-205 的 相 对 表 达 量 为(0.19±0.03),低于阴性对照细胞的(1.37±0.24),差异有统计学意义(t=8.450,P<0.05);C666-1 细胞转染miRNA-205 minics 后,miRNA-205 的 相 对 表 达量为(1.96±0.29),高于阴性对照细胞的(0.11±0.01),差异有统计学意义(t=11.043,P<0.05)。
2.2 miRNA-205 对细胞增殖能力的影响
MTT 检测结果显示,转染miRNA-205 inhibi‐tor 96 h 时,CNE2 细胞的A 值为(3.76±0.79),低于阴性对照细胞的(5.81±0.83),差异有统计学意义(t=4.221,P<0.05);转染miRNA-205 minics 96 h时,C666-1 细胞的A 值为(6.29±0.87),高于阴性对照细胞的(4.94±0.68),差异有统计学意义(t=3.546,P<0.05)。(图1)
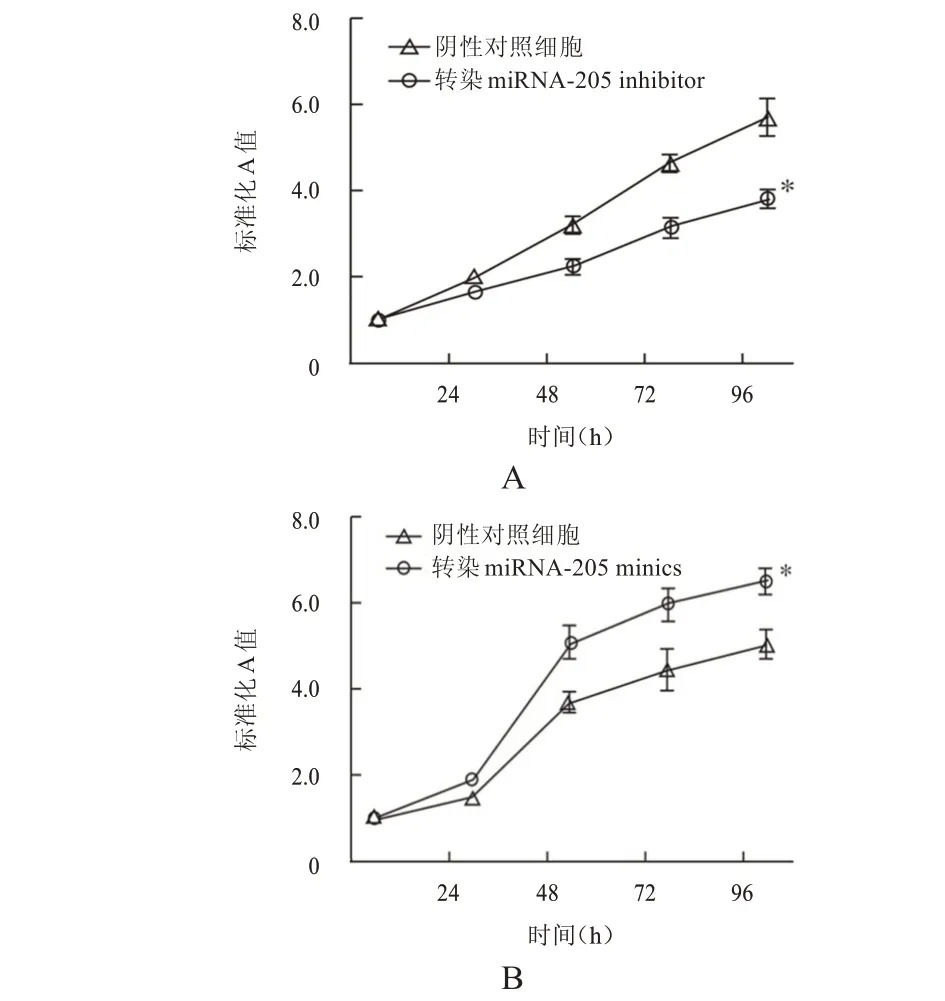
图1 miRNA-205对鼻咽癌细胞增殖能力的影响
2.3 miRNA-205 对细胞集落形成能力的影响
克隆形成实验结果显示,转染miRNA-205 in‐hibitor 的CNE2 细胞形成的细胞集落数目为(182.09±26.43)个,少于阴性对照细胞的(371.25±34.18)个,差异有统计学意义(t=7.583,P<0.05);转染miRNA-205 minics 的C666-1 细胞形成的细胞集落数目为(561.63±73.28)个,多于阴性对照细胞的(329.55±42.70)个,差异有统计学意义(t=4.740,P<0.05)。
2.4 miRNA-205 对细胞迁移和侵袭能力的影响
迁移实验结果显示,转染miRNA-205 inhibitor的CNE2 细胞的迁移细胞数目为(8.93±1.42)个,少于阴性对照细胞的(17.26±2.11)个,差异有统计学意义(t=5.673,P<0.05);转染miRNA-205 minics 的C666-1 细胞的迁移数目为(25.17±2.45)个,多于阴性对照细胞的(14.92±1.33)个,差异有统计学意义(t=6.368,P<0.05)。侵袭实验结果显示,转染miR‐NA-205 inhibitor 的CNE2 细胞的侵袭细胞数目为(7.36±1.02)个,少于阴性对照细胞的(14.83±1.74)个,差异有统计学意义(t=6.415,P<0.05);转染miRNA-205 minics的C666-1细胞的侵袭细胞数目为(23.80±2.07)个,多于阴性对照细胞的(14.26±1.37)个,差异有统计学意义(t=9.674,P<0.05)。(图2)

图2 miRNA-205对鼻咽癌细胞迁移和侵袭能力的影响
3 讨论
鼻咽癌是一种恶性程度较高的头颈部恶性肿瘤,其病因复杂多样,可能与个体自身的饮食习惯、生存环境、基因易感性等有关[11-12]。目前,鼻咽癌的临床治疗效果并不十分理想,尤其是中晚期患者的5 年生存率仅为50%左右[13]。因此,探寻准确、有效的早期诊断标志物及治疗靶点对于改善鼻咽癌患者的预后具有重要意义。
miRNA是一类小分子非编码RNA,在转录后水平调控靶基因的表达,与机体的生理及病理过程密切相关,并参与了肿瘤的发生、发展过程[14-15]。研究显示,miRNA 与鼻咽癌的发生、发展有密切关联[16-17]。Zhen 等[18]研 究 发 现,miRNA-3188 可 通 过 介 导FOXO1 从而抑制鼻咽癌细胞的恶性表型。Petrosi‐no 等[19]研究发现,miRNA-143 的异位表达能够抑制鼻咽癌细胞的活力,并抑制体内异种移植肿瘤的生长。miRNA-205是miRNA家族的成员之一,研究发现,miRNA-205 在包括鼻咽癌在内的多种恶性肿瘤中异常表达[20],但其在肿瘤发生、发展中的作用却存在争议,有研究认为,其可作为抑癌基因抑制肿瘤的发生,亦可作为促癌基因促进肿瘤的发生[21-22]。
本研究选择了SUNE-1、HONE1、CNE2、C666-1、6-10B 这5 种 鼻 咽 癌 细 胞 系,发 现miRNA-205 在CNE2 细胞中的相对表达量最高,在C666-1 细胞中的相对表达量最低,因此,选取CNE2和C666-1细胞进行转染实验,并通过实时荧光定量PCR 确认了CNE2、C666-1 细胞分别敲低或过表达miRNA-205。本研究首次研究了敲低或过表达miRNA-205 对鼻咽癌细胞增殖、侵袭及迁移能力的影响,结果显示,敲低miRNA-205 后,CNE2 细胞的增殖能力降低,集落数目减少,而过表达miRNA-205 后,C666-1细胞的增殖能力提高,集落数目增多,这与高英和谢丽[23]的研究结果相一致,表明下调miRNA-205的表达可抑制鼻咽癌细胞的增殖能力,反之,上调miRNA-205 的表达可促进鼻咽癌细胞的增殖能力。分析原因可能与miRNA-205 可通过调控P21、cyclin D1基因的表达,从而参与调控肿瘤细胞的增殖有关[24]。本研究进一步探究了miRNA-205 表达情况对细胞侵袭和迁移能力的影响,结果显示,敲低miRNA-205 后,CNE2 细胞的迁移和侵袭细胞数目均减少,而过表达miRNA-205 后,C666-1 细胞的迁移和侵袭细胞数目均增多,表明下调miRNA-205 的表达可抑制鼻咽癌细胞的侵袭和迁移能力,反之,上调miRNA-205 的表达可促进鼻咽癌细胞的侵袭和迁移能力。
综上所述,miRNA-205 可作为促癌基因在鼻咽癌的发生、发展过程中发挥促进作用,下调miR‐NA-205 的表达可抑制鼻咽癌细胞的增殖、侵袭和迁移能力,miRNA-205 有可能成为鼻咽癌基因治疗的潜在作用靶点。

