恶性肿瘤相关脑梗死的临床特征分析
谭蕾蕾 贾 燕 李鹏辉 秦亚辉 黄 月
1)郑州大学人民医院,河南 郑州 450003 2)河南省人民医院,河南 郑州 450003
脑梗死和恶性肿瘤是影响居民生活质量的两大问题,对患者个人和家庭来说均是巨大打击,在人群中的发病率和病死率均较高,尤其是对老年人。恶性肿瘤可直接或间接导致脑梗死,称为恶性肿瘤相关性脑梗死,研究表明恶性肿瘤患者脑梗死的发生率是一般人群的1.5倍[1]。随着医疗技术的发展,肿瘤患者的生存率不断提高,恶性肿瘤患者脑梗死的发病率在未来呈上升趋势。众所周知,恶性肿瘤在其发病过程中使机体处于高凝状态,引起血栓形成,我们称之为Trousseau综合征[2],高凝状态是引起脑梗死的一个重要因素,除此之外,肿瘤直接压迫或肿瘤细胞侵犯血管、引起非细菌性血栓性心内膜炎都可增加脑梗死的风险,研究表明,恶性肿瘤的治疗,如手术、放疗和化疗等,也会导致凝血酶生成、栓塞和诱发血管病变,从而增加脑梗死的风险[3-5]。目前,恶性肿瘤与脑梗死之间的许多联系仍不是非常明确,恶性肿瘤是否像高血压和糖尿病等传统危险因素一样是脑梗死的独立危险因素,目前还无达成统一认识,此外,恶性肿瘤患者在脑梗死急性期的治疗和最佳预防策略尚未确定[6]。本文分析恶性肿瘤后发生脑梗死患者的临床特征,探讨其特点及可能的发病机制,旨在加深临床对本病的认识。
1 对象与方法
1.1研究对象回顾性分析2018-06—2019-02河南省人民医院神经内科收治的急性脑梗死患者,并从中筛选出既往患有恶性肿瘤的患者9例。纳入标准:(1)既往患有恶性肿瘤,且有病理学诊断证实者;(2)符合《中国急性缺血性脑卒中诊疗指南2018》的诊断标准确诊为脑梗死者。排除标准:颅内肿瘤(包括原发肿瘤和继发转移瘤)患者。
1.2研究方法收集9例患者的资料,包括性别、年龄等一般资料;恶性肿瘤相关资料包括肿瘤类型、确诊时间、是否转移、治疗方案(手术、放疗、化疗)。脑梗死相关资料包括首发、传统危险因素、脑梗死病因学分型,实验室检验指标(凝血功能、D-二聚体、红细胞沉降率、CRP),以及心电图、心脏彩超、头颅CT、MRI、MRA/CT血管成像等影像学表现。其中传统危险因素包括高血压、糖尿病、冠心病、房颤、烟酒嗜好、既往脑梗死病史。
2 结果
2.1临床特征9例患者中男7例,女2例;发病年龄37~75岁,平均64.4岁,确诊恶性肿瘤到发生脑梗死时间1~72个月;肺癌5例,胰腺癌2例,直肠癌1例,阴茎癌1例,9例患者中除例4外,其余均接受恶性肿瘤相关治疗过程中出现急性脑梗死,其中采用化疗方案7例,放疗方案1例;首发症状言语不利4例,一侧肢体活动障碍4例,反应迟钝4例,发生恶性肿瘤转移6例;急性脑梗死发生在确诊恶性肿瘤后6个月内7例;无传统脑梗死危险因素4例。
2.2辅助检查9例患者中3例行红细胞沉降率检验,结果均显著升高;8例行CRP检测,其中显著升高7例,1例正常;8例患者检测纤维蛋白原,其中6例有所升高;7例进行D-二聚体检查,均升高。9例患者均行头颅磁共振检查,影像学显示梗死灶均≥2个。9例患者中例6脑梗死治疗半月后复发,例8患者2个月后脑梗死复发,例2患者共发生3次急性脑梗死,分别在确诊肺癌前1个月、前2个月及确诊肺癌后进行治疗过程的第5月。

表1 9例脑梗死合并恶性肿瘤患者的临床特征
注:+:有;-:无
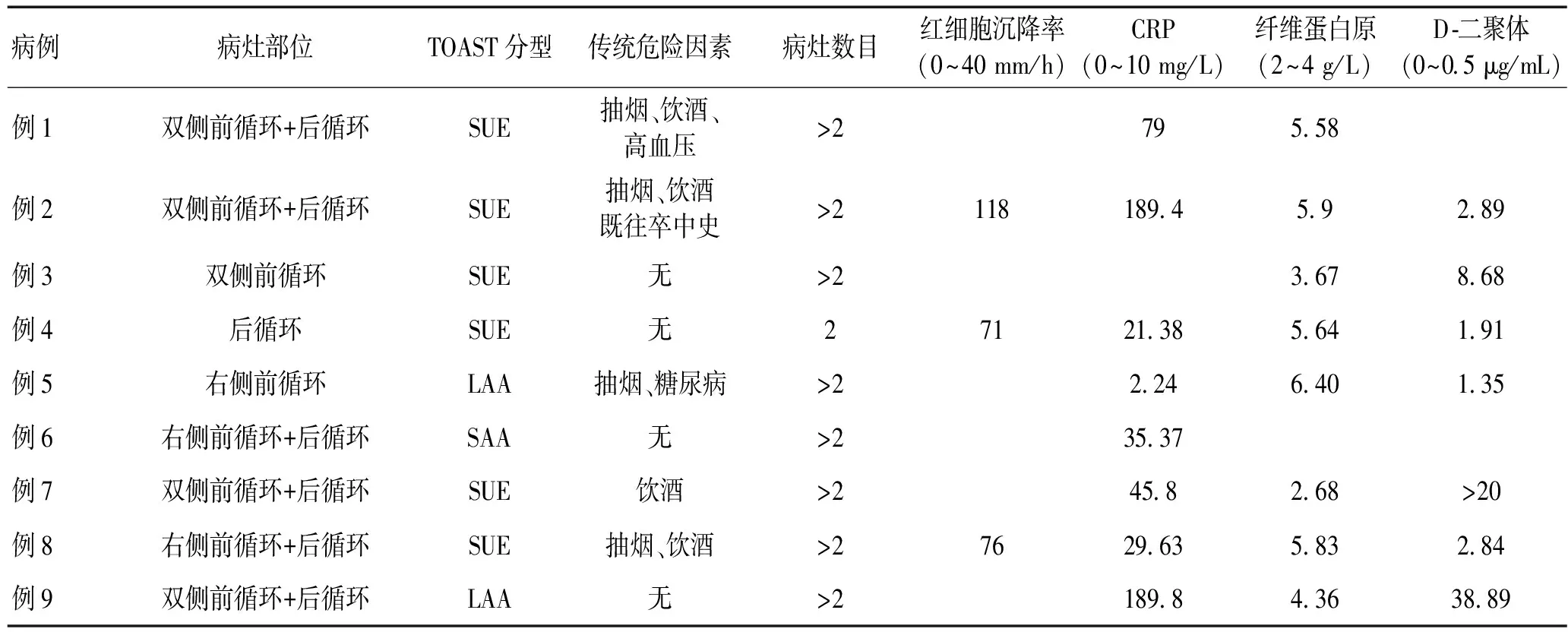
表2 9例脑梗死合并恶性肿瘤患者临床资料
注:部分患者检验不完整,空白处即未行此检验。LAA:大动脉粥样硬化性,SAA:小动脉闭塞性;SUE:不明原因
3 讨论
在过去的几十年里恶性肿瘤的诊断和治疗取得了飞跃进展,同时恶性肿瘤患者的长期生活质量也变得尤为重要,这就意味着对影响功能的相关疾病的预防及治疗变得至关重要,其中脑梗死是造成残疾和死亡的主要原因。恶性肿瘤特别是新诊断的恶性肿瘤与随后出现脑梗死的风险增加之间存在联系。BENGT等[6]所做的一项关于瑞典全国恶性肿瘤患者脑梗死风险的随访研究中显示,在确诊恶性肿瘤后的6个月内,脑梗死发病率是1.6%,本文7例患者在确诊恶性肿瘤后的6个月内出现多发急性脑梗死,且6例患者出现躯体恶性肿瘤转移。脑梗死发生的风险与恶性肿瘤分期直接相关,其中4期恶性肿瘤风险最高,包括在恶性肿瘤确诊后第1个月的风险增加了10倍以上[7]。
恶性肿瘤患者发生脑梗死的危险因素一直存在争议,高凝状态和D-二聚体水平升高是目前普遍被大家接受的一项重要因素,动脉粥样硬化和凝血变化可能是恶性肿瘤患者发生脑梗死的因素,然而在其发病机制中占据主导作用的原因究尚无明确定论,但恶性肿瘤相关脑梗死患者确有其独特的改变,主要是由于恶性肿瘤及其治疗过程中引起的高凝状态[8]。恶性肿瘤介导的高凝机制是多重的,肿瘤细胞分泌促凝剂、免疫反应引起的血管损伤、化疗药物、放疗和留置管引起的医源性损伤以及其他机制都有可能造成恶性肿瘤的高凝状态[9]。根据TOAST分型,恶性肿瘤患者脑梗死的病因包括大动脉粥样硬化性(15%),心源性(22%),小动脉闭塞性(8%),其他原因所致(5%),不明原因(50%)[10]。本文9例患者,平均年龄64.4岁,5例患者有传统危险因素,按照TOAST分型,2例患者属于大动脉粥样硬化型脑梗死,1例属于小动脉闭塞型,其余均为原因不明型,故认为即使这些患者有传统脑梗死危险因素,肿瘤相关原因仍然在脑梗死的发生中占据重要地位,且癌症可通过增强全身炎症反应促进动脉粥样硬化斑块的形成和破裂。本文9例患者所检测到的红细胞沉降率、D-二聚体、CRP、纤维蛋白原等炎症反应因子均不同程度的升高,且大部分升高较为显著,这也侧面表明即便是动脉粥样硬化型的脑梗死,也有癌症引起的炎症反应的参与。研究提示,脑梗死患者的一些生物学标志物,如红细胞沉降率、CRP、纤维蛋白原和D-二聚体水平在恶性肿瘤患者中明显高于非恶性肿瘤患者[11-12],更有人把D-二聚体当作是恶性肿瘤患者隐源性卒中的早期神经功能恶化的预测因子[13]。常规动脉硬化型脑梗死病灶常局限于一个单一的血管领域,而恶性肿瘤相关的脑梗死更常发生在多个血管区域,近60%的患者表现为多灶性梗死[7],本研究中所有患者脑梗死病灶都在2个以上,且除例4、例5外均同时分布在两侧前循环、前循环和后循环,这也是肿瘤相关脑梗死与传统脑梗死区别较大的一点。此前也有人认为出现多发双半球梗死时必须考虑隐匿性癌症的存在[14]。
本文7例病人有化疗史,1例有放疗史,在 HUANG等[15]研究中,化疗与脑梗死风险的增加紧密相关,尤其是应用顺铂化疗,其主要机制在于顺铂等化疗药物容易造成电解质失衡,从而引起血管痉挛、内皮细胞功能障碍、血小板过度聚集等血管相关不良反应。而放射治疗同样可以加速动脉粥样硬化、造成血管损伤。头颈部恶性肿瘤患者,特别是年龄<55岁,接受放疗、化疗或放化疗,患脑梗死的风险更高,2014年一项对肺癌患者的比较也发现,术后放疗患者脑梗死发生率是单独手术患者的2倍[16]。不同类型、不同部位恶性肿瘤的脑梗死发生风险可能存在不同的原因,而我们缺乏大数据的支持,目前无法确定涉及的机制。
既往研究显示,恶性肿瘤会增加静脉血栓栓塞的风险,究其原因,除了癌症患者高凝状态易形成血栓外,恶性肿瘤患者的运动耐受力和疲劳感较健康人有所下降,甚至卧床不起,均是静脉血栓形成的危险因素。近来越来越多研究关注恶性肿瘤是否也增加了动脉血栓栓塞的风险,TUZOVIC 等[17]研究发现恶性肿瘤患者6个月的动脉血栓栓塞事件发生率为4.7%,这可能是由于恶性肿瘤相关的促凝状态以及某些化疗药物的不良反应引起的,几个大规模队列分析研究也证实癌症增加了动脉血栓栓塞的短期风险[18-20],也有个案报道把动脉血栓形成当成是隐匿性恶性肿瘤或早期恶性肿瘤进展的第一个征象[21-22],从而认为恶性肿瘤是动脉血栓形成的独立危险因素,但缺乏大数据对此结论的支持,也缺乏关于恶性肿瘤患者卒中预防和急性治疗最佳策略的高质量证据。本研究中例2患者在确诊肺癌前1个月及前2个月出现过2次急性脑梗死,但未筛查肿瘤,后因胸闷、咳嗽就诊时发现肺癌,且已出现躯体转移,由此可提醒神经科医师,在临床遇到脑梗死病人,尤其是传统危险因素相对缺乏的病人时,可对患者进行全面评估,包括红细胞沉降率、D-二聚体、CRP、纤维蛋白原、全身肿瘤标记物等,必要时可结合全身影像学检查以期早期发现肿瘤,在之前的一些研究中也表明脑梗死可能是肿瘤的第一个表现[23-24]。
本研究结果表明,肿瘤相关脑梗死患者D-二聚体、炎症因子等指标变化明显,颅内通常可见多发病灶,致病机制除与常见的高凝状态相关外,还与肿瘤的治疗方式、肿瘤本身引起的炎症反应相关,我们临床在遇到脑梗死患者时也应根据这些相关特点进行肿瘤筛查。本研究为回顾性研究,样本量较少,部分患者检查缺失,未筛选同年龄、同性别的动脉粥样硬化型脑梗死患者与之对照。在今后的研究中,我们将纳入更多患者,进行系统详细的病史追询、实验室检查、经食管超声心动图检查,以便更加清晰地阐明其发病机制,明确脑梗死与恶性肿瘤间相关联系。

