脑梗死合并阻塞性睡眠呼吸暂停低通气综合征患者颅内血管狭窄临床分析
张燕平 罗瑞琦 焦永光 李运恒
河南中医药大学第一附属医院,河南 郑州 450000
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是指睡眠过程中反复出现部分性或完全性的上呼吸道阻塞,导致间断性呼吸暂停和低通气的疾病[1]。据估计[2],OSAHS在普通人群中的患病率女性为2%,男性为4%。研究显示[3],OSAHS可以明显增加脑梗死的风险,即使在排除其他疾病等影响因素后,是脑梗死独立危险因素和卒中结局的独立因素[4-8]。TIA患者OSAHS的发生率也明显高于无血管诊断的患者[9],颈动脉内膜增厚是全身动脉粥样硬化的标志,并且与心肌梗死和卒中的高风险相关[10]。研究表明[11],氧饱和度降低与动脉壁退行性改变有直接关系,OSAHS与脑血管病变之间的联系可能至少部分归因于颈动脉粥样硬化过程的进展。腔隙性无症状脑梗死患者中重度阻塞性睡眠呼吸暂停综合征的发生率明显高于无腔隙性脑梗死患者,在高血压患者中更明显[12]。
OSAHS引起的血流动力学紊乱、炎症、血液高凝、氧化应激等情况与心脑血管疾病的发病机制和预后密切相关[13-15],过度氧化应激是OSAHS慢性炎症的一个简单机制。研究表明,OSAHS诱导的炎症反应是全身性的,炎症因子可以抑制红细胞的分化和成熟,从而增加红细胞分布宽度,炎症因子IL-6、TNF-α、C反应蛋白和IL-8与红细胞分布宽度升高显著相关[16-18]。目前,OSAHS引起脑梗死的机制尚不明确,研究认为其主要机制之一是OSAHS患者血清的多种炎性因子水平增高,影响动脉硬化的形成[19]。但OSAHS与颅内动脉硬化的研究较少,本研究主要评估OSAHS是否增加颅内动脉血管狭窄的风险,以期对临床预防和治疗提供依据。
1 资料与方法
1.1研究对象选择2017-07—2019-10河南中医药大学第一附属医院的70例急性脑梗死患者,行多导睡眠图(polysomnography,PSG)监测,依据呼吸暂停指数(apnea and hypophea index,AHI)≥5次/h结果,将诊断为OSAHS合并脑梗死患者35例纳入实验组,无OSAHS的脑梗死患者为对照组。实验组组中男26例(74.3%),女9例(25.7%),年龄(58.97±12.17)岁;对照组男21例(60.0%),女14例(40.0%);年龄(59.97±13.72)岁。2组患者性别、年龄差异无统计学意义(P>0.05)。虽实验组高血压、糖尿病、冠心病、高脂血症史比例高于对照组,但差异均无统计学意义(P>0.05)。见表1。

表1 2组既往病史比较
入选标准:(1)符合我国《第四届脑血管病会议的脑血管疾病诊断要点》的脑梗死诊断标准,(2)符合(2011年修订版)阻塞性睡眠呼吸暂停低通气综合征诊治指南的诊断标准,即每夜7 h发作30次以上呼吸暂停及低通气或AHI≥5次/h。
排除标准:(1)严重的心、肝、肺、肾疾病;(2)病情重不能配合检查者;(3)佩戴呼吸机、严重颌面畸形及OSAHS患者已行手术治疗者。
1.2研究方法
1.2.1 一般情况:记录患者体重指数(BMI)、性别、年龄及病史等。所有入选对象抽取空腹静脉血,分别测定同型半胱氨酸、C反应蛋白的含量,各组均行头颅MRA检查评估颅内动脉狭窄的程度和数量,并行PSG检查了解睡眠呼吸暂停情况。
1.2.2 炎性指标:①同型半胱氨酸(Hcy):采血后尽快分离血浆,制成无蛋白滤液,采用自动生化仪的循环酶法技术检测同型半胱氨酸,采用酶联免疫检测试剂盒(上海西唐生物科技有限公司)。②C反应蛋白(CRP):取空腹血,采用全自动生化仪的免疫比浊法进行测定CRP值。
1.2.3 评定颅内血管狭窄:采用美国GE公司双梯度1.5T磁共振仪对所有入选患者行头颅MRA检查,按狭窄程度将血管分为无狭窄、狭窄<50%、狭窄≥50%或闭塞3组。
1.2.4 睡眠呼吸监测:所有参与实验的患者接受多导睡眠图记录仪监测,记录时长>7 h,根据睡眠呼吸暂停低通气指数(AHI)分为正常,AHI<5次/h;轻度OSAHS,5~15次/h;中度OSAHS,15~30 次/h;重度OSAHS,AHI>30次/h。
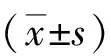
2 结果
2.12组BMI、CRP、Hcy水平比较实验组BMI、CRP、Hcy水平高于对照组,差异均有统计学意义(P<0.05)。见表2。
2.22组颅内动脉狭窄程度、数量及分布比较2组血管狭窄程度比较差异有统计学意义(P=0.016,表3)。在血管狭窄的数量上,2组比较差异有统计学意义(P=0.041,表4)。在颅内血管分布上,2组比较差异无统计学意义(P>0.05,表5)。

表2 2组BMI、CRP、Hcy水平比较

表3 2组脑动脉狭窄程度比较 [n(%)]

表4 2组脑动脉狭窄数量比较 [n(%)]

表5 2组脑动脉狭窄分布情况比较
3 讨论
近年来,研究显示[20-22],在住院卒中患者中50%~72%的患者有OSAHS,OSAHS合并卒中患者的病死率、致残率明显增加,且增加住院时间,神经功能缺损评分也高。因此,研究OSAHS与颅内血管狭窄的关系并早期干预治疗,对预防脑梗死有重要意义。
OSAHS引起脑梗死的机制复杂,可能与患者慢性间歇性缺氧、CO2潴留、反复觉醒引起的交感神经活性增加、全身炎症反应以及氧化应激反应有关,内皮功能损伤导致的动脉粥样硬化、胸内负压变化引起的血流动力学变化、胰岛素抵抗、代谢异常等变化是OSAHS导致脑梗死的可能机制。目前国内关于OSAHS与颅内血管狭窄关系的研究较少,研究显示[23],在颅内大动脉粥样硬化性狭窄中,46%为急性脑梗死患者,因此,作为高危因素OSAHS患者导致卒中的重要原因可能是颅内大动脉狭窄。
陈莹等[24]的研究表明,OSAHS可以显著加大动脉硬化发生率,而且还会增加动脉硬化严重程度。老年OSAHS患者的颈动脉粥样硬化情况是非常明显的,若老年患者伴高血压疾病,这个趋势更加突出。另外,血清CRP或其他炎症标记物(IL-6、TNF-α等)水平升高,与动脉粥样硬化的发展有关[24-25]。
hs-CRP是炎性反应的标志物之一,可反映动脉内膜慢性炎症的活动程度,能够更敏感地提示炎性反应。研究显示,OSAHS患者血清hs-CRP等炎症因子明显升高,经多元回归分析得出hs-CRP水平与AHI呈正相关[26-27]。睡眠障碍使OSAHS患者炎症因子水平和活性增加,免疫和内分泌系统紊乱,使下游促炎性细胞因子、趋化因子和黏附分子表达增加,进入粥样硬化斑块的hs-CRP可调理巨噬细胞,促使胆固醇附着于血管壁,使动脉粥样硬化斑块的形成加速。本次研究也显示,实验组CRP的含量明显高于对照组(P<0.05),说明OSAHS患者机体经受的炎症反应加重了动脉粥样硬化,并导致程度更重的缺血性脑卒中。
YAVUZ等[28]证实OSAHS是高同型半胱氨酸血症的独立危险因素,内皮功能受损是动脉内膜增厚和动脉粥样硬化形成的重要病理学基础,高同型半胱氨酸可聚集及激活血小板,刺激平滑肌细胞(血管壁)增生而导致内皮损伤。有研究认为,Hcy与OSAHS患者病情严重程度相关[29]。本次研究也显示,实验组中Hcy含量明显高于对照组,提示OSAHS是高同型半胱氨酸血症的危险因素之一。
国内外针对OSAHS与年龄之间的关系展开了较多研究,而且也获得显著的成效。OSAHS患病率呈逐年上升趋势,患病高峰集中在40~69岁,男性居多,同时还随年龄增加而增加。但本次研究中其与年龄无相关性,考虑可能与样本少有关。随着经济的发展,肥胖人口剧增,流行病学统计显示,肥胖人群中>60%存在不同程度、不同类型的睡眠呼吸障碍(sleep disordered breathing,SDB)。本次试验显示,2组BMI比较差异有统计学意义,证实了既往研究的观点,肥胖与OSAHS的发生密切相关,考虑BMI也是OSAHS的一项危险因素。
本研究显示,OSAHS合并脑梗死患者狭窄程度、狭窄数量均较对照组患者明显,OSAHS可能与血管狭窄发生、发展有关,不仅如此,其和肥胖、高血糖等很多影响因素产生协同效应,从而加速动脉硬化的进程。OSHAS导致血管狭窄的可能机制:(1)长期低氧血症使氧自由基产生增多,导致胆固醇沉积于血管壁;(2)缺氧使一氧化氮增多导致内皮损伤,尤其在重度缺氧时更明显;(3)高同型半胱氨酸血症、肥胖都与OSAHS、脑卒中有紧密联系;(4)炎性级联反应加速了动脉粥样硬化的进程、速度。
OSAHS增加了颅内动脉血管狭窄的风险及动脉硬化形成相关的炎性指标,是脑梗死的危险因素。因此,常规对脑梗死患者进行睡眠呼吸监测,及早发现和治疗OSAHS是防治颅内动脉血管狭窄的重要途径。

