14-冠-4冠醚衍生物与Li(I)的络合过程理论研究
侯 雪 ,熊延杭 ,程衔锟 ,田勇攀 ,徐 亮,2 ,赵 卓*
(1.安徽工业大学 冶金工程学院, 安徽 马鞍山 243000; 2. 省部共建高品质特殊钢冶金与制备国家重点实验室, 上海 200444)
1967年,美国化学家PEDERSON发现了一种分子结构形似皇冠的大环聚醚化合物,他称之为“冠醚(crown ether)”[1],从此开启了这种环状化合物的辉煌之路.随着20世纪80年代超分子化学概念的提出及快速发展,冠醚成为了超分子材料的第一代主体化合物,从而引起研究者的极大兴趣,冠醚及其衍生物的研究成为超分子化学领域一个热点方向[2].冠醚具有疏水的外部骨架,其内部环中氧原子由于形成很强的负电势,对金属离子具有较强的配位能力.近年来,冠醚的特异性质愈来愈受到人们的关注,特别是其优异的选择性络合能力,已在分子识别[3]、同位素分离[4]、离子选择电极[5]、膜运输[6]等方面得到了广泛应用[7-8].
通常认为,冠醚对金属离子的配位作用主要利用孔径效应,即当冠醚的空腔尺寸与金属离子直径相匹配时,能以离子-偶极静电作用形成稳定配合物[9].随着研究的深入,研究者发现除了孔径效应外,冠醚环上引入侧臂基团对其与金属离子的络合能力也具有重要影响,这是由于侧臂基团的引入可以不同程度改变冠醚的供电子能力、环的灵活性、亲水性等,从而使其与金属离子的络合性能发生变化[10].如TSUKUBE等[11]研究了单、双侧臂对二氮杂18-冠-6(Diaza-18-crown-6)对金属阳离子络合的影响,在氮杂18-冠-6两侧引入侧臂吡啶后,由于侧臂体系较大,刚性较强,空间位阻增大,对金属离子的络合能力反而下降.而在冠醚另一侧引入侧臂后,由于冠醚侧臂与金属阳离子形成了稳定的三维空间,对Li(I)、Na(I)、K(I)等离子表现出了优越的结合能力.
密度泛函理论(DFT)模拟计算是研究冠醚及其衍生物与金属离子络合过程的重要方法,可以借助其对冠醚与金属离子络合的过程进行模拟,从而深入研究冠醚与金属离子的络合机理.如BODA等[12]研究了12-冠-4冠醚(简称12C4,下同)、15C5、18C6、21C7等冠醚对金属离子锶(Sr2+)、铯(Cs+)的络合能力,研究结果表明铯离子(Cs+) (0.338 nm)、与空腔尺寸较配的21C7 (0.384 nm)络合效果最好.刁开盛等[15]研究了12C4、Aza(氮杂)-12C4对Li(I)、Na(I)、Be(II)金属离子的结合能力,研究结果表明Triza(三氮杂)-12C4、Tetra(四氮杂)-12C4对Be2+的络合结果均比Li(I)、Na(I)效果好,经过结构优化后的构象图表明Be(II)位于冠醚环中心且在同一平面内,热力学参数也证明冠醚与Be(II)表现出优越的结合能力.对于Li(I)来说,虽然其直径(0.12 nm)与12C4空腔尺寸(0.12 nm)相同,但是有研究表明,金属阳离子的直径与冠醚腔穴直径的比值为0.75~0.90时,更利于形成稳定的络合物,因此非对称性冠醚14C4(0.12~0.15 nm)可能是与Li(I)的尺寸更相配的冠醚,并且如果同时引入侧臂基团,可能会进一步增强与Li(I)的络合能力.
基于上述分析,以二苯并14-冠-4(DB14C4)为基础,选取羟基(-OH)、氨基(-NH2)、羟甲基(-CH2OH)、氨甲基(-CH2NH2)、羧基(-COOH)五种侧臂基团,基于密度泛函理论,研究了六种冠醚衍生物与Li(I)的络合机理及侧臂基团对络合过程的影响.
1 计算模型和方法
所有计算过程均在Gaussian16[16]软件上完成.在具有较好精度的M06-2X/def2SVP[17-19]基组和SMD溶剂模型水平下[20-21],所有结构均进行了优化和频率计算验证.
Multiwfn 3.7[22]是一个多功能波函数分析程序,DB14C4-R的波函数文件从Gaussian 16获得后,用作波函数分析器软件序的输入文件,再通过VDW 1.9.3软件进行作图[23].诸如静电势[24],HOMO及LUMO的完成及对范德华表面上的静电势进行定量分析[25].
首先利用Gauss View6.0[26]建立DB14C4-R(R=OH、NH2、CH2OH、CH2NH2)的结构模型以及DB14C4-R分别与Li(I)的配合物结构模型,采用Hybrid-meta GGA[27-28]泛函,在M06-2X/def2SVP水平下,获得优化好的结构及相关结构参数.
热力学计算同样采用Hybrid-meta GGA 泛函,在M06-2X/def2SVP水平下,主要计算了298.15 K时水相条件下DB14C4-R与不同金属离子络合过程的吉布斯自由能变(ΔG)、焓变(ΔH)、熵变(ΔS)和内能(ΔU).冠醚(crown ether)与Li(I)的络合反应[29]如下:
Li++ether=Li+-ether(1)
其热力学内能变(ΔU)为:
ΔU=ULi+-ether-(ULi++Uether)(2)
式中ULi+-ether、ULi+、Uether分别代表金属离子-冠醚络合物、金属离子、冠醚的内能.
其吉布斯自由能变(ΔG)为:
ΔG=GLi+-ether-(GLi++Gether)(3)
式中GLi+-ether、GLi+、Gether分别代表金属离子-冠醚络合物、金属离子、冠醚的吉布斯自由能.
ΔH=HLi+-ether-(HLi++Hether)(4)
式中HLi+-ether、HLi+、Hether分别代表金属离子-冠醚络合物、金属离子、冠醚的焓.
冠醚与金属离子配位过程熵变(ΔS)由下面的标准热力学公式计算:
ΔG=ΔH-TΔS(5)
静电势是一种实空间函数,对于分子体系定义如下[30]:
Vtot(r)=Vnur+Veler=

Vnu代表核/原子电荷产生的静电势;Vele代表电子贡献的静电势;RA和ZA分别表示原子A的位置向量和核电荷代表核电荷数;ρ为电子密度[31-35].δginter [36]在Multiwfn 3.7程序中定义如下:


δginterr=gIGM,interr-ginterr(9)
2 结果与讨论
2.1 结构分析
2.1.1 DB14C4 及DB14C4-R的结构及参数
图1为水相下DB14C4 及DB14C4-R 最优构象图.从图1可以看出,DB14C4-R(-OH、-NH2) 与DB14C4 经过结构优化后变化不大,冠醚环中原子排布较为整齐.DB14C4加上-CH2OH、-CH2NH2侧臂后,变化较为明显,两侧苯环均向内扭曲,且连接侧臂的上半部分冠醚氧环变形扭曲程度高,当侧臂基团为-CH2OH时,可以看出上半部分连接侧臂的冠醚氧环中氧原子撑开了冠醚环,从而导致扭曲程度较大,而未连接侧臂的冠醚氧环下半部分的氧原子基本没有变化;当侧臂为-CH2NH2时,冠醚氧环两侧的苯环向内弯曲较明显,可知氧原子并不在同一平面上,-CH2NH2中-NH2偏向右侧,导致苯环及右侧的氧原子略低于左半部分,由表1可知二面角D(45, 42, 20, 40)、D(20, 42, 45, 47)分别为61.40°、172.92°,两者相差111.52°左右,从而导致出现了左高右低不对称构型.冠醚环中由于N、O自身孤对电子对电子密度的影响,导致其分布不均匀,可能也是原因之一.

图1 结构优化后的DB14C4及其衍生物冠醚结构 (298.15 K, 水相)Fig.1 Optimized structures for complexes with DB14C4-R(298.15 K, aqueous phase)

表1 DB14C4及其衍生物的二面角的结构参数 (298.15 K, 水相)
表2为DB14C4及DB14C4-R相关结构参数.从表2可以看出,DB14C4环上加上侧链-OH、-NH2后C-C和C′-O′键长均增大,表明取代基附近的冠醚环变大,而C-O和C′-C′键长均减小,则是冠醚氧环被拉长.侧臂为-CH2OH、-CH2NH2时C-C、C-O及C′-O′键长增大,O-O间距明显增大,尤其取代基为-CH2OH时,O-O间距增大了0.06 nm左右,唯有C′-C′键长减小.由此可见,取代基-CH2OH、-CH2NH2对冠醚环结构影响较大,结构参数变化更加明显.

表2 DB14C4及其衍生物的结构参数 (298.15 K, 水相)
*C-C is the average of the C-C bond length in -CH2-CH2- on the crown ether ring. C′-C′ is the bond length of the C-C bond shared by the crown ether ring and the benzene ring. C-O is the average value of the C-O bond length in -CH2-O- on the crown ether ring. C′-O′ is the bond length of the C-O of the C shared by the crown ether ring and the benzene ring. O-O is the distance between two O atoms’ diagonally distributed on the crown ether ring.
2.1.2 DB14C4 及DB14C4-R与Li(I)优化后的结构及参数
图2为水相下DB14C4及DB14C4-R与Li(I)的最优构象图.由图可知,DB14C4及DB14C4-R与Li(I)经过结构优化后,Li(I)位于冠醚环中心,较之前未络合的冠醚,氧原子均向Li(I)靠拢,并且最终使得冠醚与Li(I)排布整齐均匀,这可能是由于Li(I)与DB14C4-R冠醚环的腔体尺寸大小较为吻合,从而使得Li(I)与DB14C4-R进行配位.
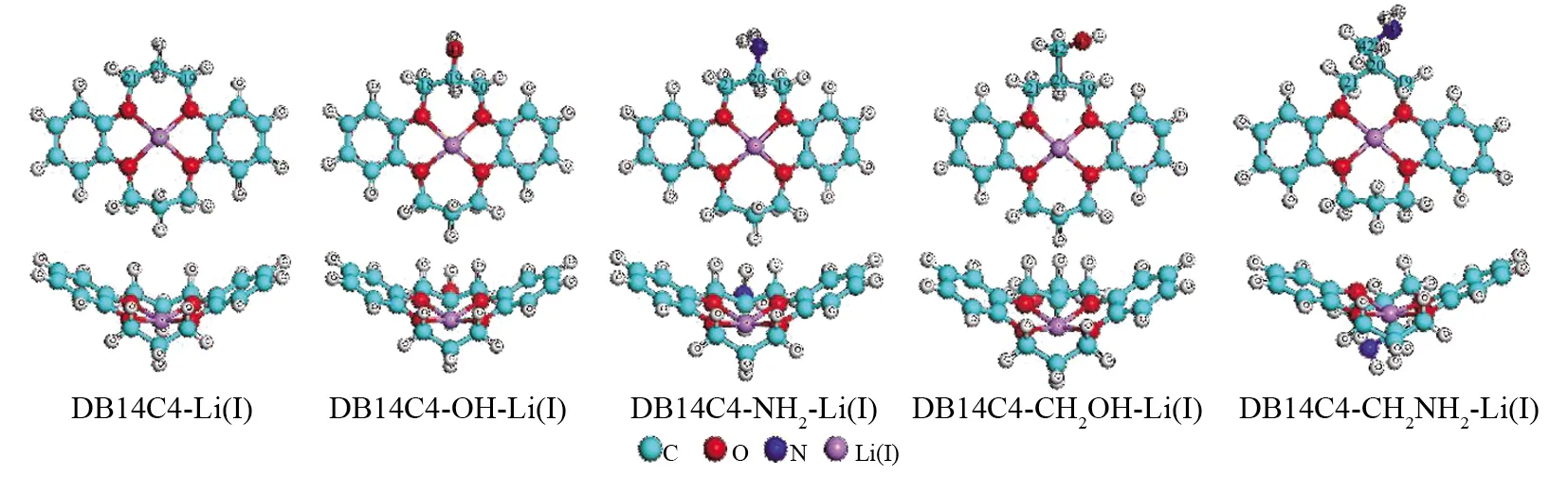
图2 DB14C4及其衍生物与Li(I)络合后的冠醚结构 (298.15 K, 水相)Fig.2 Optimized structures for Li(I) complexes with DB14C4-R(298.15 K, aqueous phase)
表3列出了DB14C4-R 与Li(I)配位后的结构参数.DB14C4及DB14C4-R与Li(I)配位后C-O、C′-C′、C-O及C′-O′键长增加及减小幅度明显接近,表明络合Li(I)后不同基团对络合物结构影响不大.由图2也可看出,冠醚与Li(I)配位后排布整齐,变化较小,与之前五种取代基对比下可知,O-O间距缩小较多,达到0.002 nm,这与结构优化后的结果一致.
表4中列出了DB14C4-R与Li(I)中五种侧臂与冠醚氧环相连的二面角,图1、2中侧臂为-OH、-NH2的冠醚与Li(I)络合前后从构型上来看变化不大,且从二面角角度来看,络合前后变化较小;侧臂分别为-CH2OH的D(21, 20, 42, 45)二面角变化最为明显,但也仅有15°左右,由图2可知冠醚与Li(I)络合后变化较小,且通过二面角数据可知变化幅度差别不大.

表3 DB14C4及其衍生物与Li(I)络合后的结构参数 (298.15 K, 水相)

表4 DB14C4及其衍生物与Li(I)络合后的二面角结构参数 (298.15 K, 水相)
2.2 前线轨道分析
前线轨道中,最高占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)是参与化学稳定性的主要轨道[57],并且确定分子间的间隙能,从而体现分子间相互作用的方式,进一步表征化学物质反应性以及分子的动力学稳定性[58].HOMO到LUMO的能隙越小,则表明分子越不稳定.HOMO表示供体供电子的能力,LUMO作为电子受体表示获取电子的能力.HOMO和LUMO之间的能隙是决定分子电输运性质的关键参数[59].
图3是在M06-2X/def2SVP水平下,利用Multiwfn3.7程序从Gaussian16输出文件中生成的DB14C4及DB14C4-R与Li(I)络合前后的HOMO与LUMO的3D图,其中图中绿色和蓝色分别代表轨道正、负相位部分.由表5可知,DB14C4-R与Li(I)络合后,能隙值均下降,从而稳定性有所降低.

图3 DB14C4与Li(I)络合后的前线轨道分析Fig.3 Frontier molecular orbitals of the DB14C4 its complexes with Li(I)

表5 DB14C4及其衍生物与Li(I)络合前后的前线轨道分析数据 (298.15 K, 水相)
2.3 静电势分析
图4 DB14C4 (左)分别是从静电势(ESP)分析得到的极大值与极小值点,蓝点和红点分别代表极小值和极大值的位置.图4 DB14C4 (右)与DB14C4-Li(I) (右)是针对DB14C4及DB14C4-R与Li(I)络合前后不同ESP范围绘制的表面积.从图中我们可以看出,由于冠醚未络合时环外围基本呈现为正值,这主要体现了氢原子所带的正电荷对静电势的贡献,冠醚环中出现了极小值(最小值)点,主要是因为氧的孤对电子的影响;同时,在两侧苯环上邻位碳正上方也出现了极小值点,这体现π电子对静电势的贡献.由图可知,当冠醚与Li(I)络合后,由于Li(I)为一价正电荷,从而导致ESP呈现出来的均为正值,且极大值均出现在Li(I)的位置.
从ESP范围表面积图可以看出,当冠醚与Li(I)络合后,DB14C4及带有侧臂为-OH、-NH2、-CH2OH的络合物最大区域ESP值范围在80~90 kcal/mol,区域面积都大于8 nm2,且最大区域部分大于ESP值在70~80 kcal/mol范围内3 nm2以上,这表明冠醚与Li(I)络合时反应位点集中.侧臂为-CH2NH2的冠醚与Li(I)络合后,ESP范围值变化较小,相对于前几种冠醚ESP值分散较为均匀.
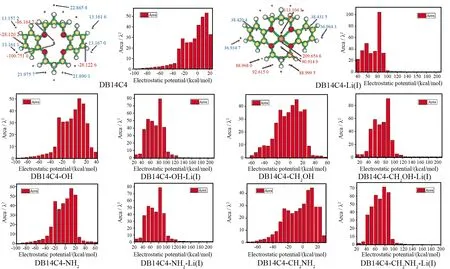
图4 DB14C4及其衍生物与Li(I)络合后的静电势值及区域分布Fig.4 Surface area in each ESP(kcal/mol) range on the vdW surface of the DB14C4-R and its complexes with Li(I)
2.4 独立梯度模型(IGM)
图5中是基于IGM及VDW 1.9.3[62]软件导出的DB14C4-CH2OH与Li(I)络合后的电子密度等值面图,由图可知,Li(I)被蓝绿片段包围,清晰表明了Li(I)-O之间的静电作用.通过评估不同的原子或原子对的δg指数,IGM方法可以对每个原子或原子对对两个分子之间的总相互作用的影响进行粗略的定量分析.获得的原子贡献评估指数越高,原子或原子对做出的贡献越大[63].从表6中可以看出,未加侧臂时,DB14C4与Li(I)络合后Li(I)-O之间的贡献指数几乎相等;由于侧臂-OH、-NH2为供电子基团,可以发现相比于DB14C4 本身,距离侧臂较近的氧原子与金属离子相互作用较弱,带-CH2OH、-CH2NH2的冠醚,后者贡献指数变化较为明显,距离侧臂较远的氧原子与金属离子相互作用相对较强,可能是由于侧臂上-CH2-的加入影响了电子密度分布.

图5 DB14C4-OH与Li(I)络合后的δginter等值面Fig.5 Isosurface of DB14C4-OH with Li(I) and its δginter

表6 DB14C4及其衍生物与Li(I)络合前后原子对中的δginter贡献指数.
2.5 热力学参数
表7是水溶液溶剂模型下,DB14C4及DB14C4-R六种冠醚与Li(I)络合过程的热力学计算结果.
从表7可以看出,DB14C4及五种含侧臂的冠醚衍生物在水相条件下与Li(I)的络合过程ΔU、ΔG、ΔH、ΔS均为负值,表明络合反应可自发进行且为放热反应.DB14C4及DB14C4-R与Li(I)配位的能力的大小顺序为:DB14C4-CH2OH>DB14C4-OH>DB14C4-NH2> DB14C4> DB14C4-CH2NH2.侧臂为-OH、-NH2、-CH2OH的DB14C4与Li(I)的配位能力大于DB14C4.-OH、-NH2为两种强供电子基团,可提高冠醚环的电子密度,从而增强对Li(I)的静电引力,使之与Li(I)的络合能力增强.CH3本身为供电子基团,缺失一个氢原子变为-CH2-分别加上强供电子基团-OH、-NH2后得到-CH2OH、-CH2NH2,DB14C4-CH2OH与Li(I)络合后优于后者,主要是因为-OH中的氧原子供电子能力更强,降低了冠醚环上的的电子云密度.

表7 DB14C4及其衍生物与Li(I)络合后的热力学参数 (298.15 K, 水相)
3 结论
基于DFT理论,进行了隐式水溶剂模型下DB14C4及DB14C4-R(R=OH、NH2、CH2OH、CH2NH2)衍生物与Li(I)络合前后的结构优化.通过结构优化构象、键长、二面角结构参数,可知DB14C4-R(R=CH2OH、CH2NH2)通过结构优化扭曲程度较高,与Li(I)络合后呈对称状态,DB14C4-R(R=OH、NH2)络合前后均变化不大,键长、二面角数据均与结构优化结果一致.
通过前线轨道、ESP及IGM分析,可知加上侧臂后能隙值均降低,表明冠醚与Li(I)络合后稳定性均下降;DB14C4及DB14C4-R(R=OH、NH2、CH2OH)ESP范围值波动较大,而侧臂为-CH2NH2的冠醚与Li(I)络合后,ESP范围值变化较小,且分布较为均匀;DB14C4及DB14C4-R(R=OH、NH2、CH2OH、CH2NH2)与Li(I)络合的主要原因为静电作用,且侧臂-CH2OH、-CH2NH2由于-CH2-的加入,从Li(I)-O之间的贡献指数分析得知距离侧臂较近的氧原子与金属离子相互作用较弱,反之相反.
热力学数据结果表明,DB14C4加上侧臂-OH、-NH2、-CH2OH后,与Li(I)的配位能力均比其本身大,由于-OH、-NH2均为供电子基团,而-CH2-的加入使得DB14C4-CH2OH络合效果增强.
由于含锂资源的分离提取主要在水相条件下进行,因此以侧臂为-CH2OH的DB14C4衍生物为基础,有望开发高效的锂分离提取技术.

