铁蛋白与法氏囊病毒核衣壳蛋白重组蛋白的原核表达及纳米颗粒胞外自组装
杜梦潭, 张伟业, 刘兴健, 李轶女, 张志芳, 胡小元
中国农业科学院生物技术研究所, 北京 100081
鸡传染性法氏囊病(IBD)是由传染性法氏囊病毒(IBDV)引起的,于1957年在美国的甘布罗地区首次被发现。20世纪80年代,IBDV超强毒株首先在英国东安格利亚爆发[1],随后迅速在全世界不同地区和国家蔓延。IBD使全球的家禽养殖业受到了重大损失,是危害家禽健康的三大传染病之一[2]。IBDV无囊膜包裹,属于双RNA病毒科中的禽双RNA病毒属[3],易感染3~6周龄的雏鸡,使鸡的免疫器官产生严重的损伤,最终死于免疫抑制。IBDV的基因组是由A和B两条双链RNA和核衣壳两部分组成[4],编码5种结构蛋白[3],即VP1、VP2、VP3、VP4和VP5。其中,VP2作为IBDV的主要保护性抗原,能够使机体产生中和性抗体,多用于研制亚单位疫苗。VP2蛋白由441个氨基酸构成,形成基底结构域、凸起结构域和壳体结构域的三聚体,构成其衣壳。其中,凸起结构域的氨基酸多变,其余两种比较保守,由可变区构成的凸起结构域有两个疏水基团,正是这两个疏水基团的存在使得IBDV的构象具有高度疏水性,与病毒毒性相关[5-6]。近年来,研究人员非常重视研制基因工程疫苗和DNA疫苗,为更有效地防控IBD带来了希望。国内外研究人员利用多种表达系统,对IBDV的多聚蛋白和VP2等衣壳蛋白进行了亚单位疫苗的研制。
铁蛋白(ferritin protein, Fe)首次发现于马体内,并分离自脾脏组织,接着又发现于各种动植物和微生物体内[7-11]。自然合成的铁蛋白多呈现空心的球形纳米笼状结构,其外径12 nm、内径8 nm,其球形结构由一个内核和外壳组成,内核主要是矿物质成分,外壳由24个相同的每3个铁蛋白亚基构成的三聚体亚单位组装形成[12-13]。铁蛋白用作纳米载体时,可以在笼状结构内部包裹目标分子,实现缓释或靶向释放的功能,也可以在笼状结构外表面固定目标分子,实现稳定结构和抗原暴露等功能。抗原蛋白连接到铁蛋白单体亚基的N端进行融合表达,这样目标抗原蛋白就会锚定在自组装铁蛋白纳米笼的外表面,且由于铁蛋白亚基独特的组装方式,使得其对于天然构象为三聚体的抗原表达优势显著,随着铁蛋白单体亚基自组装成为三聚体,N端融合表达的抗原空间位置很近,易于形成天然三聚体结构,这样的三聚体最大程度地还原了抗原蛋白的天然构象,同时又比较稳定,免疫原性较单独表达会有大幅增强。并且铁蛋白由于其稳定性而耐受高温和多种变性剂,不影响其天然结构[14-15]。将纳米颗粒作为免疫原载体一直是研究的热点,铁蛋白的单体亚基可以组装成稳定的多聚体,已被应用于很多疾病的免疫原载体[16-18]。目前,市场上多用减毒活疫苗对疾病进行控制,包括天然减毒株和基因重组弱毒株,其缺陷在于有回复毒力的风险,并可能激活机体潜伏的病毒,引起相应的并发症等副作用,而铁蛋白纳米粒子由24个亚基自组装而成,可以制备安全、高效且廉价的亚单位疫苗,是一个较为理想的抗原呈递和疫苗开发平台。
本研究将结合IBDV-VP2的免疫原性和铁蛋白纳米颗粒的自组装特性,在大肠杆菌表达系统中制备IBDV-VP2的铁蛋白纳米颗粒,并对IBDV-VP2-Fe的表达和自组装情况进行验证,以期为探究铁蛋白自组装对提高IBDV疫苗的免疫保护广谱性、高效性的作用提供支持,也为进一步研究其作为药物和抗原载体的应用机制奠定基础。
1 材料与方法
1.1 材料
大肠杆菌菌株:BL21(DE3)、DH5α由本实验室保存。
DNA聚合酶、DNA marker购自南京诺唯赞生物科技股份有限公司;T4 DNA连接酶和抗His鼠源单克隆抗体购自北京全式金生物技术有限公司;质粒提取试剂盒和凝胶回收试剂盒购自天根生化科技有限公司;限制性内切酶、SDS-Marker购自Thermo Scientific公司;辣根过氧化物酶标记山羊抗小鼠IgG购自Beyotome公司;层析分离介质Ni预装柱购自北京康为世纪生物科技有限公司;IPTG购自北京索莱宝科技有限公司;透析袋购自Millipore公司;其他试剂均为国产分析纯。
包涵体蛋白纯化所用试剂:裂解缓冲液(pH 8.0):50 mmol·L-1Tris-HCl (pH 8.0),0.2 mol·L-1NaCl,调pH至8.0;包涵体洗涤液Ⅰ(pH 8.0):20 mmol·L-1Tris-HCl,0.2 mol·L-1NaCl,1%TritonX-100(体积分数比),调pH至8.0。包涵体洗涤液Ⅱ(pH 8.0):20 mmol·L-1Tris,0.2 mol·L-1NaCl,2 mol·L-1尿素调 pH 8.0。NTA-0 Buffer (pH 8.0):20 mmol·L-1Tris,0.2 mol·L-1NaCl,5%甘油(体积分数比),8 mol·L-1尿素调 pH 8.0。NTA-500 Buffer (pH 8.0):20 mmol·L-1Tris,0.2 mol·L-1NaCl,5%甘油(体积分数比),8 mol·L-1尿素,500 mmol·L-1咪唑调 pH至8.0。其他咪唑浓度的洗液 NTA-0 Buffer 和 NTA-500 Buffer 按一定比例混合。
1.2 目的片段的扩增
我们分析了近些年流行的24条IBDV毒株的多聚蛋白序列,包括8株超强毒株(GenBank登录号为JF907702.1、X92760、AY444873.3、AF322444.1、ABI52866.1、JQ403646.1、JF907703.1、AF092943.1)、8株变异毒株(GenBank 登录号为 D00867.1、EF418033.1、AY368653.1、JQ411012.1、AF321055.1、AF051837.1、EU595671.1、EU595672.1)、5 株经典毒株(GenBank 登录号为 D00869、X16107、X84034、D00499、AY319768.2) 和3株疫苗毒株 (GenBank登录号为 DQ906921.1、DQ403248.1、AF499929.1),得到了流行强毒株病毒多聚蛋白的同感序列,Fe蛋白序列选用幽门螺旋杆菌来源(GenBank登录号为WP_000949190.1),送至南京金斯瑞生物科技有限公司根据大肠杆菌密码子偏好性,对两条序列进行优化,合成了IBDV多聚蛋白基因序列和Fe蛋白的基因序列,插入pUC57-simple载体中,形成pUCS-IBDV-VP2/4/3和pUC57-Fe,分别以此为模板,设计特异性引物,扩增大小分别为1 362 bp的IBDV-VP2和504bp的Fe的核苷酸片段,在引物的上下游分别加入BamHⅠ和EcoRⅠ限制性酶切位点,以F1和R1(表1)作为上下游引物进行PCR扩增,扩增大小为1 362 bp的IBDV-VP2的目的片段;再分别以F2、R2和F3、R3(表1)作为上下游引物,利用融合PCR扩增大小为1 866 bp的IBDV-VP2-Fe的片段,具体步骤为首先分别以F2和R2、F3和R3为上下游引物进行PCR的扩增,之后通过核酸凝胶电泳进行胶回收,将回收的两条目的片段混合后作为模板,以F2和R3为引物进行Overlap PCR,得到的目的产物进行琼脂糖凝胶电泳,回收后即得IBDV-VP2-Fe的融合片段。

表1 本研究所用引物列表Table1 List of primers used in this research
1.3 原核表达载体的构建及诱导表达
将pET28a质粒载体和上述胶回收目的片段用BamHⅠ和EcoRⅠ限制性内切酶进行双酶切,酶切后产物纯化,将IBDV-VP2和IBDV-VP2-Fe目的片段和线性化后的载体以2∶1的比例配置10 μL连接体系,在 25℃连接3 h。
连接反应完成之后,吸取以上连接产物全部加入100 μL从-80℃保存条件下取出并迅速升温至0℃左右的DH5α感受态细胞中,冰上放置30 min后,转移至42℃水浴锅中热激,精确计时90 s,冰上放置2 min降温后,加入1 mL 新鲜配置的LB培养基,在37℃摇床中震荡培养1 h以复苏菌体,随后取200 μL在含卡那霉素抗性的平板培养基上涂布,置于37℃培养箱中培养12 h左右,待有肉眼可见的单菌落后取出。
在上述平板中挑取单克隆菌株至新鲜配置的LB培养基中进行培养,提取质粒后以pET28a载体的上下游引物进行测序,将测序正确无突变的质粒,分别命名为pET28a-IBDV-VP2和pET28a-IBDV-VP2-Fe,分别转化BL21表达菌株。用接种环从中挑取7个单克隆菌株接种至含 LB液体培养基的试管中过夜培养,此时,该含菌液的培养基OD600约为0.6,之后以1%的体积比例转接,在37 ℃摇床中培养4 h,加入终浓度为0.5 mmol·L-1的IPTG,在37℃摇床中诱导培养4 h,收集菌体,进行超声破碎,4℃ 12 000 r·min-1离心5 min以分离上清液和沉淀,分别在等量的上清和沉淀中加入适量的SDS-PAGE Loading Buffer,100℃水浴10 min,4℃ 12 000 r·min-1离心10 min后,分别取上清进行SDS-PAGE鉴定表达结果,其中,IBDV-VP2蛋白和IBDV-VP2-Fe融合蛋白的理论分子量大小分别为48 kD和68 kD,挑选表达量最高的菌株以便于保存,并鉴定蛋白的表达位置,若为可溶性蛋白,则目的蛋白存在于细胞上清液中,若为包涵体表达,则存在于细胞沉淀中。
1.4 阳性克隆菌的摇瓶发酵及IBDV-VP2和IBDV-VP2-Fe蛋白的纯化
将上述保存的菌种划线,挑取单克隆至液体LB培养基中,37 ℃过夜培养,然后以1%的比例接种至200 mL的液体培养基中,37℃培养4 h后,加入终浓度为0.5 mmol·L-1的IPTG,于37 ℃诱导4 h。
收集菌体,加入裂解液,并利用超声破碎5次之后,通过离心分离出沉淀,分别利用包涵体洗涤液Ⅰ、包涵体洗涤液Ⅱ对其进行洗涤,随后,通过镍柱进行纯化,分别用咪唑浓度为25、50、100、250和500 mmol·L-1的NTA-脲进行洗脱,通过SDS-PAGE进行鉴定,选择洗脱效果最好的咪唑浓度,进行大量地纯化。
1.5 通过质谱进行鉴定
将纯化后的IBDV-VP2-Fe蛋白样品经过SDS-PAGE后,通过考马斯亮蓝染色,将其目的条带处的聚丙烯酰胺凝胶用消毒的刀片切下来,送至上海欧易生物医学科技有限公司,通过胰酶降解、肽段除盐,挥干后用Easy-nLC1200超高效液相串联Q Exactive-HF高分辨质谱仪组成的液质联用系统进行质谱和色谱操作,随后利用ProteomeDiscover2.4软件通过物种理论数据库进行数据检索,对凝胶中的蛋白质样品进行鉴定。
1.6 通过Western blotting进行鉴定
将纯化后的IBDV-VP2和IBDV-VP2-Fe蛋白经SDS-PAGE、再经过转膜转移至硝酸纤维素膜上,用抗His的鼠源单克隆抗体为一抗,羊抗鼠IgG-HRP为二抗,进行抗原-抗体反应,经DAB显色后,在凝胶成像仪中显示目的条带,拍照保存。
1.7 融合蛋白纳米结构电镜观察
将表达的蛋白沉淀采用缓冲液重悬,采用3 500 Da的透析袋以50 mmol·L-1Tris-HCl透析3次,每6 h换一次透析液,用0.45 μm滤膜过滤。接着将复性后的融合蛋白进行电镜观察,首先将普通滤纸剪成2 cm×3 cm大小备用,对碳膜铜网做亲水处理后,将过滤后的样品滴在铜网上,1 min后用滤纸吸走铜网上的样品液滴,用ddH2O滴洗载样品的铜网后,在铜网上滴加醋酸双氧铀进行负染,孵育1 min,随后吸走液滴状的醋酸双氧铀,待铜网晾干后,将铜网搁置在TEM菱形样品盒中待观察。接着使用透射电镜仪在100 nm比例尺下拍摄IBDV-VP2-Fe、IBDV-VP2蛋白和作为阴性对照的pET28a空载表达的蛋白质的负染结构成像,成像经过了至少3次独立的平行观测且每次均在5个以上的区域进行观察。
2 结果与分析
2.1 pET28a-IBDV-VP2和pET28a-IBDV-VP2-Fe原核表达载体的构建
构建原核表达载体时,分别通过PCR扩增得到目的片段,长度大小为1 362、504 bp的IBDV-VP2和Fe,将该产物进行Overlap PCR,得到了总长约为1 866 bp的IBDV-VP2-Fe,将上述片段连接至pET28a载体上,转化克隆菌株后涂布于抗生素筛选平板培养基上培养,进行下一步的纯化,挑取单菌落,提取质粒进行测序,测序结果显示,与预期完全相符,即pET28a-IBDV-VP2和pET28a-IBDV-VP2-Fe。
2.2 融合蛋白诱导表达及表达形式
实验表明,该大肠杆菌BL21表达菌株在37 ℃下用IPTG诱导表达4 h后,经过超声破碎处理后离心进行分离,取上清和沉淀分别进行SDS-PAGE,如图1、2所示,分别在目的蛋白大小的位置,约48、68 kD处出现明显的条带,这与预期一致,该结果表明目的蛋白在沉淀中含量更高,多以包涵体的形式存在,之后将IBDV-VP2-Fe蛋白通过镍柱亲和层析进行纯化,SDS-PAGE结果显示, NTA250、NTA500(咪唑浓度为250 mmol·L-1、500 mmol·L-1的NTA-脲)洗脱的纯化产物在68 kD处有较明显的蛋白条带出现,如图3所示,其中NTA250(用咪唑浓度是250 mmol·L-1的NTA-脲洗脱)的目的蛋白含有的杂蛋白量更少,如图3中NTA250所示,表明其可用于目的蛋白的进一步纯化。

图1 IBDV-VP2-Fe蛋白的原核表达Fig.1 Prokaryotic expression of IBDV-VP2-Fe
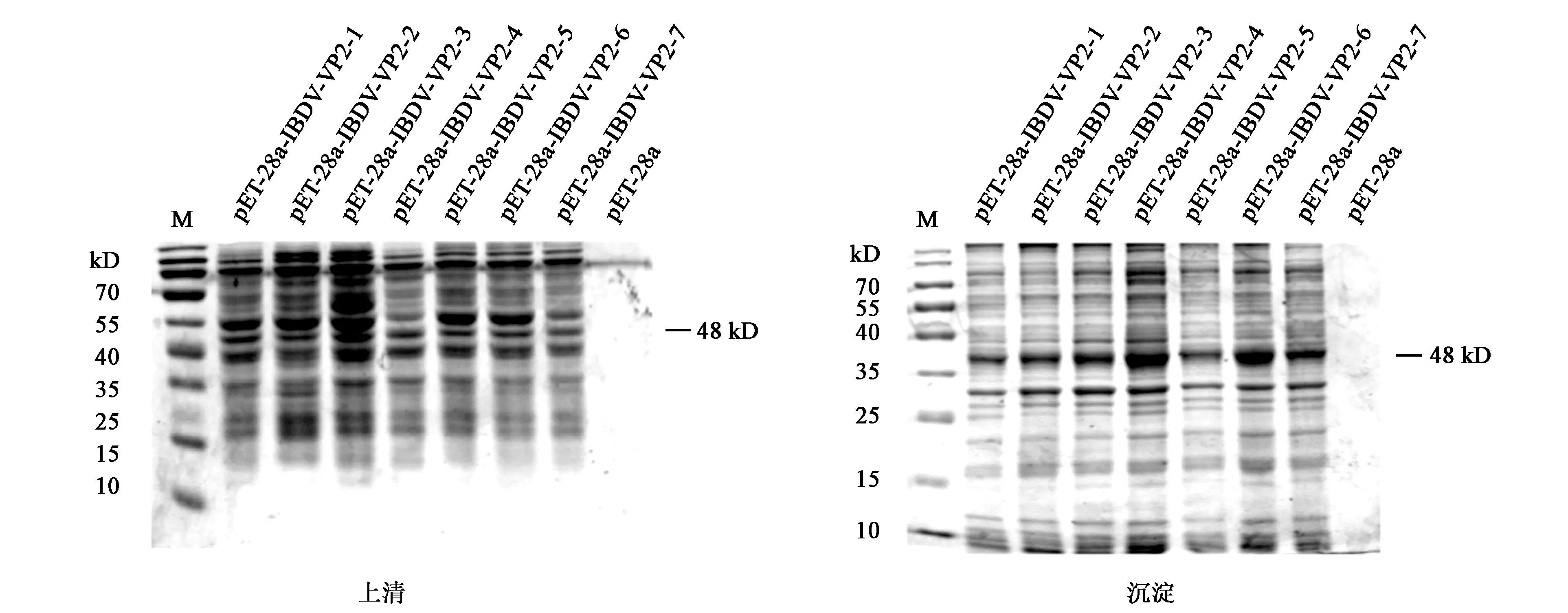
图2 IBDV-VP2蛋白的原核表达Fig.2 Prokaryotic expression of IBDV-VP2

注:M—蛋白marker。NTA0~NTA500—IBDV-VP2-Fe蛋白在不同浓度咪唑洗脱样品。
2.4 Western blotting鉴定结果
2.3 质谱鉴定结果
纯化的IBDV-VP2-Fe蛋白样品经SDS-PAGE后,将蛋白胶上的目的条带切下来,进行质谱鉴定,样品总离子流图如图4所示,质谱结果显示,肽段匹配到二级图谱的数目为391,特异肽段数为42,且蛋白分子量和等电点与预测值相符,Sequset程序打分达到916.8,可信度较高,因此质谱分析结果表明该条带为IBDV-VP2-Fe蛋白。

图4 IBDV-VP2-Fe融合蛋白的总离子流图Fig.4 Total ion current diagram of IBDV-VP2-Fe fusion protein
将IBDV-VP2、IBDV-VP2-Fe的蛋白经过SDS-PAGE后,转膜后进行抗原抗体反应,结果显示,在48、68 kD处有明显的条带,与阴性对照pET-28a有明显的差距。说明已经成功地通过大肠杆菌表达系统表达了IBDV-VP2、IBDV-VP2-Fe的蛋白。
2.5 重组蛋白的复性及胞外自组装
将纯化得到的IBDV-VP2、IBDV-VP2-Fe蛋白产物分别进行复性和自组装后,透射电子显微镜观察,发现在IBDV-VP2-Fe蛋白质样品中可观察到大小均匀的纳米级粒子,粒径约长12~20 nm,这与预期的纳米颗粒大小相符,而IBDV-VP2蛋白样品和阴性对照蛋白样品中均没有相应大小的纳米级颗粒,如图6所示,表明通过大肠杆菌原核表达载体表达的IBDV-VP2-Fe蛋白已成功组装。

注:M—蛋白质marker;pET-28a-IBDV—IBDV的VP2蛋白;pET-28a-IBDV-VP2-Fe—IBDV-VP2与Fe的融合蛋白;pET-28a—pET-28a的阴性对照蛋白。

注:IBDV-VP2-Fe—IBDV-VP2-Fe蛋白经变性复性后的电镜图;IBDV-VP2—IBDV-VP2蛋白经变形复性后的电镜图;CK—pET28a空载体蛋白经变性复性后的电镜图。
3 讨论
目前,IBDV主要用疫苗进行预防,但其作为一种损伤中枢免疫器官为特征的免疫抑制病毒,且容易变异,给疫苗的研发带来了较大的困难。在变异株和超强毒株出现之前,弱毒苗和灭活苗等传统疫苗可以有效防治IBD,为了更有效和更安全的预防变异株和超强毒株,国内外研究人员利用多种表达系统对IBDV的多聚蛋白和VP2等衣壳蛋白开展了亚单位疫苗的研发。Azad等[19]用大肠杆菌和酵母系统对天然的和重组的VP2蛋白进行了表达,于涟等[20]在大肠杆菌中表达了传染性法氏囊病病毒的VP2的cDNA,Macreadie等[21]用酵母表达的 IBDV-VP2 免疫鸡体,均产生了良好的免疫保护效果。
采用IBDV-VP2蛋白与铁蛋白亚基融合表达,相较于IBDV-VP2的化学修饰而言,大大提高了其检测的灵敏度,并且IBDV-VP2蛋白可以随着铁蛋白亚基的自组装展示于蛋白质的外表面,再者,由于铁蛋白可以通过蛋白亚基组装形成,人们可以通过已构建的成熟表达系统来大量表达重组铁蛋白,而铁蛋白可耐高温这一特点使得其不仅可以通过升温操作就能够达到分离纯化的效果,同时改变铁蛋白溶液的pH就可以向其外壳内部填充目的药物来实现其作为纳米载体的作用[21]。2013年,美国国立卫生研究院的疫苗研究中心将流感病毒的血凝素蛋白与来源于幽门螺旋杆菌的铁蛋白亚基形成融合蛋白,将其免疫雪貂之后,成功地在其体内检测到了中和抗体,作为对照,单独使用铁蛋白免疫并不能达到这一效果,同时发现通过这种方法形成的铁蛋白疫苗与佐剂联合使用可以大大提高疫苗的广谱性和免疫原性,而且利用动物来源的铁蛋白,在注射人体时不会产生免疫反应,将该种疫苗接种雪貂之后,对其体内的免疫相关因子进行检测,发现机体已成功拥有自主免疫能力[23]。韩国蔚山国家科学技术研究所在研究铁蛋白作为抗原呈递纳米平台时,发现铁蛋白可以将卵清蛋白的OT-1和OT-2肽段呈递给树突状细胞,能够诱导CD4+T细胞和CD8+T细胞产生更多的特异性细胞因子,成功地开发了树突状细胞疫苗[24]。
本研究成功利用大肠杆菌原核表达系统表达IBDV-VP2蛋白及其与铁蛋白的融合蛋白,将表达的目的蛋白纯化之后,通过质谱鉴定,其氨基酸序列与预期一致,且Western blotting结果显示表达的目的蛋白处出现一条特异性条带,而空载对照则没有,进一步研究表明表达的目的蛋白为IBDV-VP2、IBDV-VP2-Fe蛋白,并且表达的融合蛋白通过透射电镜可以看到大小均匀的颗粒,而单独的IBDV-VP2蛋白则没有,表明其融合蛋白已成功组装。但纳米自组装的效率还有待提高,后期也将对自组装纳米粒子的免疫效果进一步验证,改进自组装方法,提高纳米粒子自组装的效率,本研究不仅为研究法氏囊VP2蛋白的免疫原性奠定了基础,而且为铁蛋白自组装增强法氏囊病毒疫苗的免疫原性,为研制更为广谱、高效的疫苗提供了技术支持。

