氯化高铁血红素诱导K562细胞红系分化对其细胞周期的影响
马艺戈, 王冰蕊, 高洁, 刘金花, 佟静媛, 刘丽君, 石莉红*
1.北京协和医学院, 中国医学科学院血液病医院(中国医学科学院血液学研究所), 实验血液学国家重点实验室, 国家血液病临床医学研究中心, 天津 300020;2.东北大学生命科学与健康学院, 沈阳 110169
细胞周期是精细有序的生物学过程,间期和分裂期两个阶段分工明确地合作,完成一次完整的细胞周期。细胞周期的正确连续进行不仅在细胞生物学层面对于生长发育意义重大,而且在病理生理状态下对于癌症的发病机制和治疗机理的研究至关重要[1]。细胞周期在正常的造血进程中对造血干细胞的自我更新和造血祖细胞的谱系定向分化进行严格调控[2]。在血液系统疾病如骨髓增生异常综合征中,细胞周期紊乱造成的细胞非正常增殖是它的重要生物学特征[3]。在一个完整的细胞周期过程中,DNA合成前期(G1期)至DNA合成期S期、DNA合成后期(G2期)至分裂期(M期)这两个阶段由于DNA含量的变化致使细胞周期呈高活跃状态,受到细胞内检测点调控[4]。因此这两个阶段的长度及比例,对于研究正常及异常的细胞周期状态都有重要意义。
细胞周期的比例为所处细胞周期阶段的细胞数量占总细胞量的比例。而细胞周期的总倍增时间及各期的时间长度为完成一次完整细胞周期所需的总时间和在各期所用的时间长短。因此,各期所占细胞周期的比例为细胞周期变化的相对值,细胞周期的倍增时间及各期长度为细胞周期变化的绝对值。
人慢性髓系白血病K562细胞是从慢性粒细胞白血病患者中提取的细胞系,它是研究谱系定向分化的细胞模型,与未分化的早期多潜能的造血祖细胞相近,具有多向分化的潜能,可由血红素氧化后的产物Hemin诱导红系分化[5-8]。本研究首先利用BrdU与7-AAD双染的方法检测了Hemin诱导的K562细胞对其细胞周期相对值的影响,结果发现诱导红系分化的K562细胞并未改变细胞周期的相对值。因此,利用BrdU间隔染色结合流式细胞术的方法,通过分析BrdU阳性(标记BrdU染料)的细胞随着时间间隔增加(0、1、2、…、12 h)的变化情况,检测Hemin诱导的K562红系分化细胞对其细胞倍增时间及各期时长的影响,从而在细胞周期变化的相对值和绝对值两方面,研究K562细胞红系分化后对细胞周期的影响。
1 材料和方法
1.1 仪器与试剂
流式细胞仪LSR-II(BD);Shandon Cytospin4 细胞离心涂片机(Thermo Scientific);K562细胞株购自美国ATCC细胞库;Hemin粉末、o-Dianisidine粉末购自Sigma公司;甲醇、无水乙醇购自天津市船化学试剂科技有限公司;PBS缓冲液购自Hyclone公司;BrdU-FITC检测试剂盒购自BD公司;细胞培养及冻存试剂:胎牛血清、L-谷氨酰胺、RPMI 1640基础培养基、青霉素-链霉素抗生素等细胞培养试剂购自Gibco公司; 二甲基亚砜(DMSO)购自Sigma公司。
1.2 细胞培养
K562细胞培养使用RPMI1640基础培养基,配方为:10%胎牛血清、青霉素(100 U·mL-1)-链霉素抗生素(100 μg·mL-1)、L-谷氨酰胺(2 mmol·L-1)。K562细胞红系分化由30 μmmol·L-1Hemin诱导; K562细胞及诱导红系分化的K562细胞置于恒温37 ℃ 5% CO2培养箱; K562细胞培养密度为2×105个·mL-1。
1.3 计数法统计细胞存活率
10 μL细胞与10 μL台盼蓝于EP管中混匀,显微镜下记录活细胞数(台盼蓝未染色细胞)。细胞存活率=活细胞数/细胞总数×100%。
1.4 联苯胺染色及观察
细胞甩片:收集4×104个细胞,70 μL PBS缓冲液重悬细胞,细胞离心涂片机甩片;联苯胺染色:玻片浸入甲醇染缸固定4 min,转移至联苯胺染液避光染色2 min(联苯胺染液:50 mL甲醇+0.5 g o-Dianisidine粉末;4 ℃避光保存),转移至过氧化氢溶液避光染色1.5 min(过氧化氢溶液:25 mL无水乙醇+25 mL去离子水+1.5 mL过氧化氢;现用现配),转移至去离子水,洗涤30 s。
利用显微镜观察,对照组K562细胞与30 μmol·L-1Hemin诱导第3天的K562细胞联苯胺染色后的形态及颜色。
1.5 BrdU间隔染色方法
试剂准备及稀释:Staining Buffer由无菌PBS缓冲液、0.2%牛血清白蛋白、0.08%葡萄糖配制。无菌PBS缓冲液将BrdU-FITC试剂盒中10×Perm Wash Buffer稀释至1×工作液。
标记染料及冻存:将1份K562细胞分成13组,分别加入75 μmol·L-1BrdU染料,37℃培养箱孵育1 h,收集细胞,离心,弃上清,并用无菌PBS缓冲液洗涤染料,更换新鲜培养基,置于培养箱中,分别间隔0、1、2、3、4、5、6、7、8、9、10、11、12 h,收集各组时间间隔细胞,离心,弃上清并用无菌PBS缓冲液洗涤细胞,200 μL Cytofix/Cytoperm Buffer(BrdU-FITC试剂盒)固定细胞,避光置于冰上孵育15 min,1×Perm Wash Buffer洗,90%胎牛血清+10%DMSO制成冻存液,将细胞冻存于-80℃。
复苏及标记抗体:复苏细胞,1 mL Staining Buffer洗涤细胞,离心,弃上清,100 μL Cytofix/Cytoperm Buffer固定细胞,避光置于冰上孵育10 min,1×Perm Wash Buffer和PBS缓冲液依次洗涤细胞,加入100 μL由300 μg·mL-1DNase I、1 μmol·L-1CaCl2和5 μmol·L-1MgCl2制成的混合液,37 ℃孵育1 h,PBS缓冲液洗涤3遍,室温避光标记BrdU-FITC抗体30 min,1 mL Staining Buffer洗涤抗体,标记7-AAD,室温避光10 min,LSR-II流式细胞仪检测,Flowjo 7.6.1软件分析。
1.6 BrdU间隔染色的分析方法
通过分析细胞于各组不同时间间隔的流式结果,可见随着时间增加,BrdU+与7-AAD+细胞群呈动态变化,从而依次判断G2/M、S、G0/G1期时长。DNA含量由7-AAD分成2N、2N-4N及4N三部分,DNA含量为2N的细胞属于G0/G1期,2N-4N的细胞属于S期,4N的细胞属于G2/M期。BrdU染料孵育1 h,BrdU染料掺入细胞周期S期,此时直接收集细胞进行后续操作,即为间隔0 h。若更换培养基并放入孵箱培养,间隔数小时后收集细胞。间隔时间段内,此群BrdU+细胞继续参与细胞周期。随间隔时间的延长,依次进入G2/M期、分裂后的子代细胞G0/G1期及子代细胞S期。
间隔Xh后,流式图中出现子代细胞G0/G1期细胞,即表示BrdU染料孵育结束时,有部分细胞即将结束S期并随即进入G2/M期,经过Xh间隔,这部分细胞完成了G2/M期,开始进入子代G0/G1期,那么Xh即为细胞经历G2/M期所用时间长度。
间隔Yh后,流式图中2N-4N细胞完全消失,只剩2 N和4 N的细胞,即表示BrdU染料孵育结束时,有部分细胞即将进入S期。经过Yh间隔后,这部分细胞完成了S期,开始全部进入G2/M期甚至子代G0/G1期,那么Yh即为细胞经历S期所用时间长度。
间隔Zh后,子代G0/G1期细胞从2N向2N-4N迁移,即表示子代细胞完成G0/G1期,开始进入S期。因已知细胞进入子代G0/G1期的时间间隔约为Xh,那么(Z-X)即为细胞经历G0/G1期所用时间长度。
由此,根据间隔0~12 h的流式图,可计算出G0/G1、S、G2/M期及细胞周期倍增时长[9-11]。
1.7 BrdU与7-AAD双染检测细胞
将通过无菌的PBS缓冲液稀释的BrdU稀释液加入细胞,于培养箱内孵育4~6 h。PBS洗涤细胞后,100 μL Cytofix/Cytoperm Buffer重悬细胞,室温放置15 min。1×Perm Wash Buffer洗涤细胞后,100 μL Cytoperm/Permeabilization Buffer(BrdU-FITC试剂盒)重悬细胞,置于冰上10 min。1×Perm Wash Buffer洗涤细胞,100 μL Cytofix/Cytoperm Buffer重悬细胞,置于冰上5 min。1×Perm Wash Buffer洗涤细胞,弃上清,加入100 μL 300 μg·mL-1DNase I重悬细胞,37 ℃孵育1 h。1×Perm Wash Buffer洗涤细胞,弃上清加入2 μL BrdU抗体,室温孵育40 min。1×Perm Wash Buffer洗涤细胞,弃上清加入10 μL 7-AAD染料,室温放置10 min。LSR-II流式细胞仪检测,Flowjo 7.6.1软件分析。
1.8 生长曲线法计算倍增时间
利用生长曲线公式法推测K562细胞倍增时间,公式为Td=T0×lg2/(lgNt-lgN0)。其中Td为倍增时间,T0为间隔时间,Nt为对数生长期任意时间点的观察值,N0为对数生长期任意时间点的初始值[12]。
1.9 统计学分析方法
本实验数据采用GraphPad Prism 6制作图表和统计学分析,每组实验均重复大于3次。配对t检验进行统计学分析,P<0.05具有统计学意义。
2 结果与分析
2.1 Hemin诱导K562细胞红系分化
利用30 μmol·L-1Hemin诱导K562细胞红系分化72 h后,在显微镜下可见联苯胺染色结果(图1A-B),联苯胺染色阳性的细胞比例约为30%(图1C)。Hemin 是血红素氧化产物,其分子结构与血红素相似,含有高价铁卟啉能够诱导血红蛋白表达,因此联苯胺染色为阳性[13]。由此,Hemin成功诱导K562细胞向红系分化。

A:对照组(×40);B:Hemin处理组(×40);C:Hemin诱导的K562红系分化的细胞联苯胺染色阳性比例。**表示数据与对照相比在P<0.01差异具有统计学意义。
2.2 BrdU-7AAD双染检测Hemin诱导的K562细胞周期相对值变化
通过BrdU-7AAD双染色法检测细胞周期各时期比例,判断其相对值的变化情况。如图2所示,K562细胞周期中S期占细胞周期的比例约为49.7%,G0/G1期占细胞周期的比例约为45.6%,G2/M期占细胞周期的比例约为4.6%(图2A)。Hemin诱导的K562红系分化细胞的细胞周期中S期占细胞周期的比例约为53.9%,G0/G1期占细胞周期的比例约为40.6%,G2/M期占细胞周期的比例约为4.62%(图2B)。Hemin诱导K562红系分化的细胞周期不具有统计学意义(P>0.05)(图2C)。由此,Hemin诱导的K562细胞未改变其细胞周期相对值。
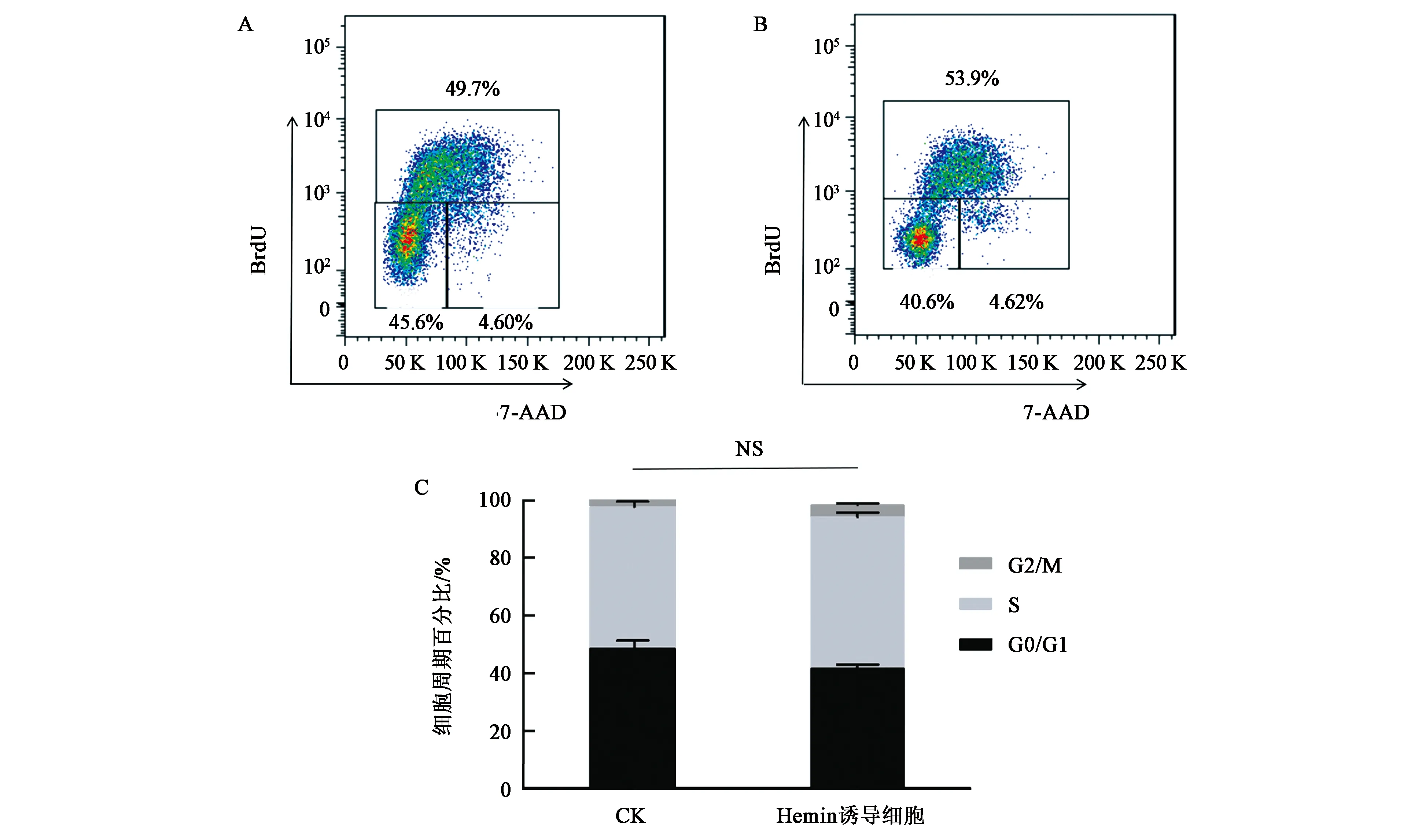
A:未诱导的K562细胞周期各期比例;B:Hemin处理组细胞周期各期比例;C:Hemin诱导K562红系分化对细胞周期各期比例的影响。NS表示差异无统计学意义。
2.3 利用生长曲线法推测K562细胞倍增时间
Hemin诱导的K562细胞对细胞周期各期比例变化没有明显的影响。因此,根据细胞计数统计活细胞数目,绘制K562细胞对数期生长曲线(图3),发现K562细胞呈对数增长。K562细胞对数生长期中,利用台盼蓝染色计算细胞存活率约为99%(图4)。连续5 d在K562的新鲜培养基中种2×105个细胞,观察其经过24 h增殖后的细胞数目,并利用生长曲线公式法Td=T0lg2/(lgNt-lgN0),推测出K562细胞倍增时间约为20.229 h(表1)。由于K562细胞是永生化细胞系,存活率较高,通过多时间点细胞计数绘制生长曲线,计算细胞周期的倍增时间的方法可以降低细胞计数法误差带来的干扰,结果可信度较高。

表1 生长曲线公式法推测K562倍增时间Table1 K562 doubling time by growth curve formula method
图4 K562细胞存活率Fig.4 K562 cells viability

图3 K562细胞生长曲线Fig.3 K562 cells growth curve
2.4 间隔染色检测K562细胞倍增时间及细胞各期时长
利用BrdU间隔染色结合流式分析的方法,检测K562红系分化细胞周期绝对值的变化情况。可见随着间隔时间的增加,未诱导的K562细胞呈阶段式变化。0 h BrdU与7-AAD双染的流式图S期、G0/G1期和G2/M期呈明显的3群。间隔时间增加,BrdU+的细胞群2N处的细胞逐渐向4 N处偏移。4 h时,BrdU+细胞群在2 N处出现一小群细胞,代表BrdU+进入了子代细胞。由此,推算出G2/M期的时长为4 h。接下来,可见BrdU+细胞在2N处的细胞群逐渐积累,直至间隔时间为9 h,2N与4N之间的细胞群消失,此时代表S期结束,即S期的时长为9 h。在11 h时,BrdU+细胞在2 N处的细胞群开始从2 N向2N-4N迁移,即代表进入到新的S期,G0/G1期的结束,那么G0/G1期的时长为11 h减去4 h,即为7 h。综上所述,通过流式图中,BrdU+细胞的动态变化过程,我们推算出了G2/M期约为4 h,S期约为9 h,G0/G1期约为7 h,故倍增时间约为20 h(图5)。BrdU间隔染色测定分析K562倍增时间的方法与利用生长曲线公式法推测倍增时间相符,证明了BrdU间隔染色技术方法的准确性。
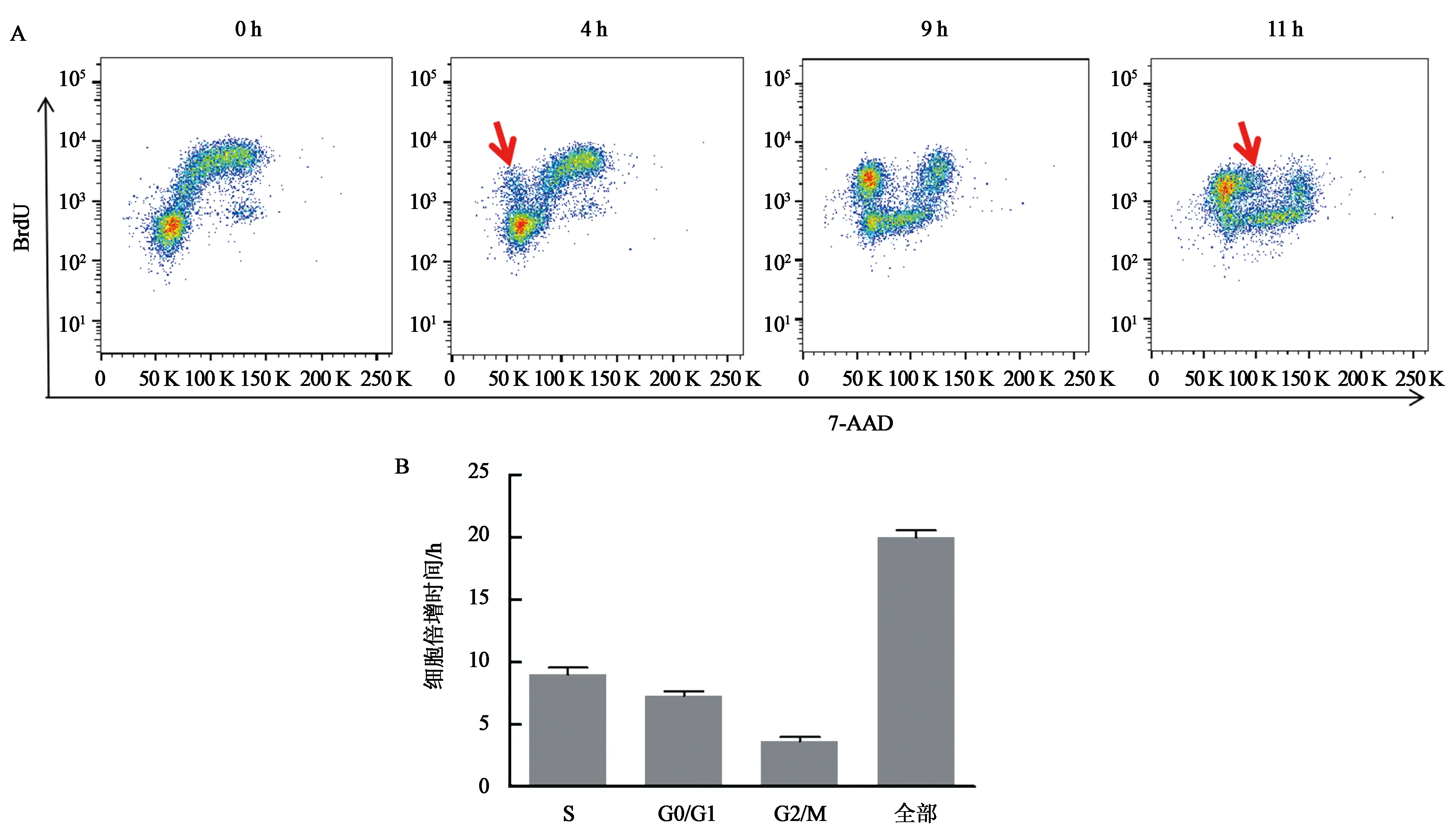
A:K562细胞BrdU 间隔染色流式图;B:K562细胞倍增时间及各期时长
2.5 Hemin诱导的K562细胞的倍增时间及各期时长
利用BrdU间隔染色,对Hemin诱导的K562细胞的倍增时间和各期时长进行了流式分析,可见Hemin诱导的K562细胞随着时间间隔的增加,BrdU+细胞也具有动态的变化规律。当间隔时间为0 h, BrdU与7-AAD双染的流式图呈明显的3群。随着间隔时间增加至5 h,BrdU+细胞群在2N处出现一小群细胞,推算出G2/M期的时长为5 h。当间隔时间为11 h时,BrdU+细胞群2N与4N之间的细胞完全消失,推算出S期的时长为11 h。当间隔时间为12 h时,BrdU+细胞在2N处的细胞群开始从2N向2N-4N迁移,那么G0/G1期的时长为12 h减去5 h,即为7 h(图6)。由此,通过流式图中,我们推算出了Hemin诱导的K562红系分化细胞G2/M期约为5 h,S期约为11 h,G0/G1期约为7 h,故倍增时间约为23 h。
未诱导的K562细胞总倍增时间约为20 h,S期的时长约为9 h;由Hemin诱导的K562细胞总倍增时间约为23 h,S期约为11 h。Hemin诱导的K562细胞倍增时间和各期时长与未诱导的K562细胞周期时长的差异不具有统计学意义(P>0.05)(图6C)。因此,K562细胞诱导红系分化进程不影响其细胞周期总倍增时间和各期时间长短,即不影响细胞周期的绝对值。

A: Hemin诱导的K562分化细胞BrdU间隔染色流式图; B: Hemin诱导的K562分化细胞倍增时间及各期时长; C: Hemin诱导K562分化细胞对细胞周期时间长度的影响(P>0.05)。
3 讨论
利用体外培养的细胞系作为细胞模型,是研究体内生物学发生过程的重要研究手段。人慢性髓系白血病K562细胞是研究红细胞、粒细胞、单核细胞相关疾病和治疗机理的重要体外细胞系模型,可通过特定条件诱导体外分化[14]。Hemin 是血红素氧化产物,诱导 K562 细胞红系分化进程,促进了红系转录因子 GATA-1 和 NF-E2 的表达,并且能够诱导K562细胞中血红蛋白表达[15]。
本研究利用联苯胺染色确定Hemin成功诱导了K562细胞红系分化。在Hemin诱导的K562细胞中,发现红系分化的K562细胞并未改变细胞周期G0/G1期、S期和G2/M期三期的比例,即细胞周期相对值无明显变化。本研究首次将BrdU间隔染色这一技术应用到了K562细胞系的倍增时间和各期时长的测量中,该技术通过普及性较高且操作人性化的流式细胞术,分析不同时间间隔BrdU与7-AAD双染的细胞群的动态变化,从而检测K562细胞的倍增时间和各期时长,其结果同生长曲线法结果一致。这一技术准确性较高,且无需结合其他实验操作即可从图像中直观判断出细胞周期各期时长和细胞周期总倍增时间。同时,应用该方法检测了Hemin诱导红系分化的K562细胞对细胞周期的影响,发现Hemin诱导红系分化的K562细胞对细胞周期倍增时间和各期时长无明显作用。综上,结合细胞周期相对值和绝对值的检测结果,Hemin诱导K562红系分化未对细胞周期造成明显影响。

