融合铁蛋白的猪瘟病毒囊膜蛋白E2的表达及鉴定
魏珍珍, 曾振, 杜梦潭, 刘兴健, 张志芳, 胡小元, 李轶女, 易咏竹*
1.江苏科技大学生物技术学院, 江苏 镇江 212003;
2.中国农业科学院生物技术研究所, 北京 100081
猪瘟(swine fever),也被称为古典猪瘟(classical swine fever,CSF),是一种高度接触性的传染疾病[1],所有猪(包括家猪和野猪)都易感[2],严重危害了养猪业的发展。猪瘟的发病与猪瘟病毒有关[3]。猪瘟病毒的遗传物质为单股正链RNA,长约12.3 kb,只含有1个开放阅读框,编码包括E2在内的12种病毒蛋白[4-5],其中,猪瘟病毒的囊膜蛋白E2是起保护作用的糖抗原,被广泛应用于研制新型猪瘟疫苗[6-9]。我国是世界上的养猪大国,近年来猪瘟的大规模爆发严重制约了我国养猪业的蓬勃发展。20世纪50年代,周泰冲团队选育了猪瘟兔化弱毒株的猪瘟病毒,其不仅无致病性,免疫原性也良好,这个弱毒株使得我国的养猪业得到了良好发展[10]。但是随着我国进出口贸易的不断发展,生态环境被污染和破坏,加上病原体极易变异的特性[11],猪瘟的防控情况变得不容乐观。相对于传统的灭活疫苗[12-13]及弱毒(减毒)猪瘟疫苗[14],蛋白源性亚单位疫苗的免疫效果和安全性更好,不会出现灭活不当、毒力返强等问题[15]。而且在研究中,猪瘟病毒囊膜蛋白E2亚单位疫苗可利用大肠杆菌操作简易、表达量高、培养成本低、生产时效短等优点进行大规模高纯度的制备[16-17]。
近年来,随着交叉学科的快速发展,生物学与纳米材料技术的交叉渗透正在快速发展。其中,铁蛋白自组装纳米颗粒技术引起人们的关注,铁蛋白可自发组装形成均一、稳定、具有良好生物相容性的蛋白颗粒[18],经过基因工程改造后,有些铁蛋白制成的纳米材料对机体无害,可作为机体病灶检测平台[19-21]、靶向药物载体[22]、药物缓释剂[23]、疫苗[24]等发挥潜在的作用。铁蛋白纳米颗粒的优势也较为突出,直径仅约12 nm,是空心笼状且结构高度对称的八面体纳米颗粒,铁蛋白的性质非常稳定,能耐受70~80 ℃的高温而不变性。但是铁蛋白的组装受pH调控,在酸性条件下(pH 2.0)铁蛋白外壳会解体成亚基,当pH回升至生理条件时(pH 7.4),各亚基又重新组装构成完整的铁蛋白[25-26]。铁蛋白球形中空结构有3个接口:内表面、外表面及亚基间接触面,亚基间接触面可通过调节溶液pH完成解聚与重组,开发铁蛋白的新功能。现已能够成功构建大肠杆菌的铁蛋白表达体系,通过IPTG诱导表达后,可得铁蛋白纳米颗粒,通过复性等也可获得天然空间结构,进而作为抗原呈递载体和疫苗开发平台。研究表明,利用大肠杆菌表达的人重组铁蛋白纳米颗粒制成的生物技术药物[27],对机体的毒性大大降低,使得其在生物医药领域具有广泛的应用前景[22,28-30]。
为了获得具有强抗原性的新型猪瘟亚单位疫苗,本研究以猪瘟病毒囊膜蛋白E2基因及纳米颗粒载体铁蛋白基因为材料,构建融合基因E2-Fe,将其克隆到pET28a载体上后,转化至E.coliBL21(DE3)感受态细胞,通过优化诱导条件对其进行高效表达,再将表达的融合蛋白进行镍柱纯化、质谱分析、Western-blotting验证及电镜检测,以期获得高效表达的融合铁蛋白的猪瘟病毒囊膜蛋白E2,为开发猪瘟新型疫苗扩宽研究思路。
1 材料与方法
1.1 材料、试剂与仪器
大肠杆菌感受态细胞E.coilBL21(DE3)由本实验室保存;限制性内切酶BamHⅠ及EcoRⅠ、T4 DNA连接酶购于美国Promega公司;卡那霉素购于美国Sigma公司;Fast pfu高保真酶、DNA Marker、His-tag一抗购于北京全式金生物技术有限公司;酵母提取物及蛋白胨购于德国AppliChem公司;PCR反应相关试剂购于美国Invitrogen公司;研究所用试剂均为分析纯。
Gel Doc XR+凝胶成像仪(美国Bio-Rad公司);DK-8D电热恒温水浴槽(上海一恒科技有限公司);DYY-6D核酸电泳仪(北京六一生物科技有限公司);Tecnai G2 F20电镜(美国FEI公司)。
1.2 融合基因E2-Fe的构建
从GenBank数据库中搜索本研究所需的猪瘟病毒囊膜蛋白E2基因序列,比对后选择GenBank序列号为ART84247.1所示的氨基酸序列作为猪瘟病毒囊膜蛋白E2的原始氨基酸序列,通过SignalP-4.1和TMHMM对猪瘟病毒囊膜蛋白E2基因序列进行分析,本研究截取了其具有抗原免疫原性的胞外域作为猪瘟病毒囊膜蛋白E2的亚单位疫苗来源,基因序列长度为738 bp,同时使用OptimumGeneTM方法,优化E2蛋白基因的密码子适应能力指数(codon adaptation index),再利用密码子的简并性,除去稀有密码子,且在转录时不会生成发夹结构,并通过软件找到其限制性内切酶位点,根据研究需要去除原始序列中一部分酶切位点;从GenBank数据库中搜索本研究所需的铁蛋白基因序列,对比后选择GenBank号为WP_000949190所示的铁蛋白氨基酸序列作为原始氨基酸序列,同时为了保持结构均一性,消除序列上潜在的N-连接糖基化位点(N19Q),为了使猪瘟病毒囊膜蛋白E2和铁蛋白可以融合表达,去掉铁蛋白的前4个氨基酸,换成SGG作为linker,最终基因序列长度为501 bp。设计引物时,在两侧添加不同的常见酶切位点,交至北京擎科新业生物技术有限公司化学合成。
利用重叠PCR进行融合基因E2-Fe的构建,所用引物序列见表1。分别以E2囊膜蛋白的胞外域、铁蛋白Fe为模板,以E2-F/R、Fe-F/R为引物,进行第1轮PCR扩增。反应体系(共50 μL)为:模板DNA 3 μL,上、下游引物各1 μL,Taq酶1 μL,dNTPs 3 μL,10×buffer 10 μL,ddH2O 31 μL。反应程序为:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,共29个循环;72 ℃ 10 min。PCR完成后,利用玻璃奶法分别回收2条目的片段。再以2条目的片段为模板,以E2-F、Fe-R为引物,进行第2轮PCR扩增。反应体系(共50 μL)为:2条目的片段各3 μL,上、下游引物各1 μL,Taq酶1 μL,dNTPs 3 μL,10×buffer 10 μL,ddH2O 28 μL。反应程序同第1轮PCR。利用玻璃奶法回收PCR产物,保存于-20 ℃备用。
表1 本研究所用引物Table1 Primers used in this study
1.3 重组表达质粒pET-28a-E2-Fe及基因工程菌的构建与筛选
本研究选取了2个常用的酶切位点BamH Ⅰ、EcoR Ⅰ,分别对重叠PCR终产物和pET28a质粒进行双酶切处理,在琼脂糖凝胶电泳中鉴定重组体系,用玻璃奶法回收,保存于-20 ℃备用;pET28a空载质粒体系于65 ℃水浴中灭活15 min,保存于-20 ℃备用。
将重叠PCR终产物的双酶切产物连接到同样双酶切后的pET28a空载质粒上,构建表达载体,采用碱裂解法提取pET28a-E2-Fe质粒[31]。将通过初筛鉴定获得的重组质粒由北京睿博兴科生物技术有限公司测序,选择有正确测序结果的pET28a-E2-Fe重组质粒,而后在E.coliBL21(DE3)感受态细胞中进行转化,构建基因工程菌株。
1.4 融合蛋白E2-Fe在大肠杆菌中的表达及纯化
挑取1.3中构建的单菌落于4.5 mL的含卡那霉素50 mg·mL-1的2YT液体培养基中,37 ℃摇床培养,当其OD值约为0.7时,加入适量的IPTG或者一水合乳糖(0.01%、0.05%、0.1%、0.5%、1%、2%、3%)诱导6 h,以期获得高表达条件。目的蛋白大小预测为51 kD左右,收集菌液后进行SDS-PAGE鉴定分析,将菌液重悬于450 μL pH 8.0的裂解缓冲液,进行超声破碎,离心后留取沉淀用脲NTA-0重悬后溶解过夜,在镍柱中用脲NTA-25洗脱,收集目的蛋白。
1.5 质谱分析与Western-blotting验证
将1.4纯化的目的融合蛋白的洗脱液进行SDS-PAGE电泳后,将目的条带切下交由上海欧易生物公司使用Easy-nLC 1200液相系统、高pH分离液相色谱仪等进行了质谱验证。
将1.4纯化的目的融合蛋白的洗脱液进行SDS-PAGE电泳后用湿转法将蛋白转移至硝酸纤维素膜,然后将硝酸纤维素膜封闭在PBS配制的3%BSA中,于4 ℃过夜,用PBS-T洗去表面封闭液,洗3次。随后加入His-tag一抗室温摇床上孵育1.5 h,用PBS-T洗去表面抗体,洗3次,再在室温摇床上用HRP标记的鼠抗山羊IgG孵育2 h后,同样用PBS-T洗去表面抗体,洗涤3次。最后用增强型ECL显色液进行显色拍照。
1.6 透析与超滤复性及电镜观察
将裁剪成适当长度(约15 cm)的3.5 kD透析袋,在1 L的1 mmol·L-1pH 8.0的EDTA和2%(质量分数)NaOH溶液中煮沸10 min,在蒸馏水中进行彻底洗涤后,再在1 mmol·L-1pH 8.0的EDTA溶液中煮沸10 min。再次用蒸馏水进行洗涤后,将1.4中经镍柱纯化后的目的蛋白加入透析袋中,分别使用8、6、4、2、1及0 mol·L-1浓度的尿素溶液进行透析,每4 h更换1次梯度尿素溶液。
取1 mL上述复性后样品加入有2/3体积的30%蔗糖溶液离心管中,补加PBS来配平离心管,在111 000 r·min-1的离心力下,超速离心1.5 h,对样品进行再次纯化。后续根据需要,使用50 K的超滤管对样品进行进一步纯化和浓缩。
将超离纯化后的样品点滴在亲水处理过的碳膜铜网上,1 min后用提前预备好的2 cm×3 cm大小的普通滤纸吸去样品,随后用ddH2O滴洗1次载有样品的铜网,用裁剪成小扇形的滤纸尖角小心地吸去铜网上的水滴。最后滴加醋酸双氧铀负染样品1 min,吸去后,等待铜网晾干后,放置于TEM菱形样品盒中并在电镜中进行观察。
2 结果与分析
2.1 原核表达质粒pET28a-E2-Fe的构建
为了确认融合基因E2-Fe已成功克隆到pET28a载体上,本研究了采用双酶切法来进行鉴定,重叠PCR终产物经EcoRⅠ和BamHⅠ双酶切所释放的片段如图1所示,E2-Fe片段长度约为1 200 bp,PCR扩增得到的产物长度与理论预测结果一致。将上述PCR终产物回收后重组到同样双酶切后的pET28a空载质粒上。将测序正确的重组质粒pET28a-E2-Fe保存于-20 ℃备用。
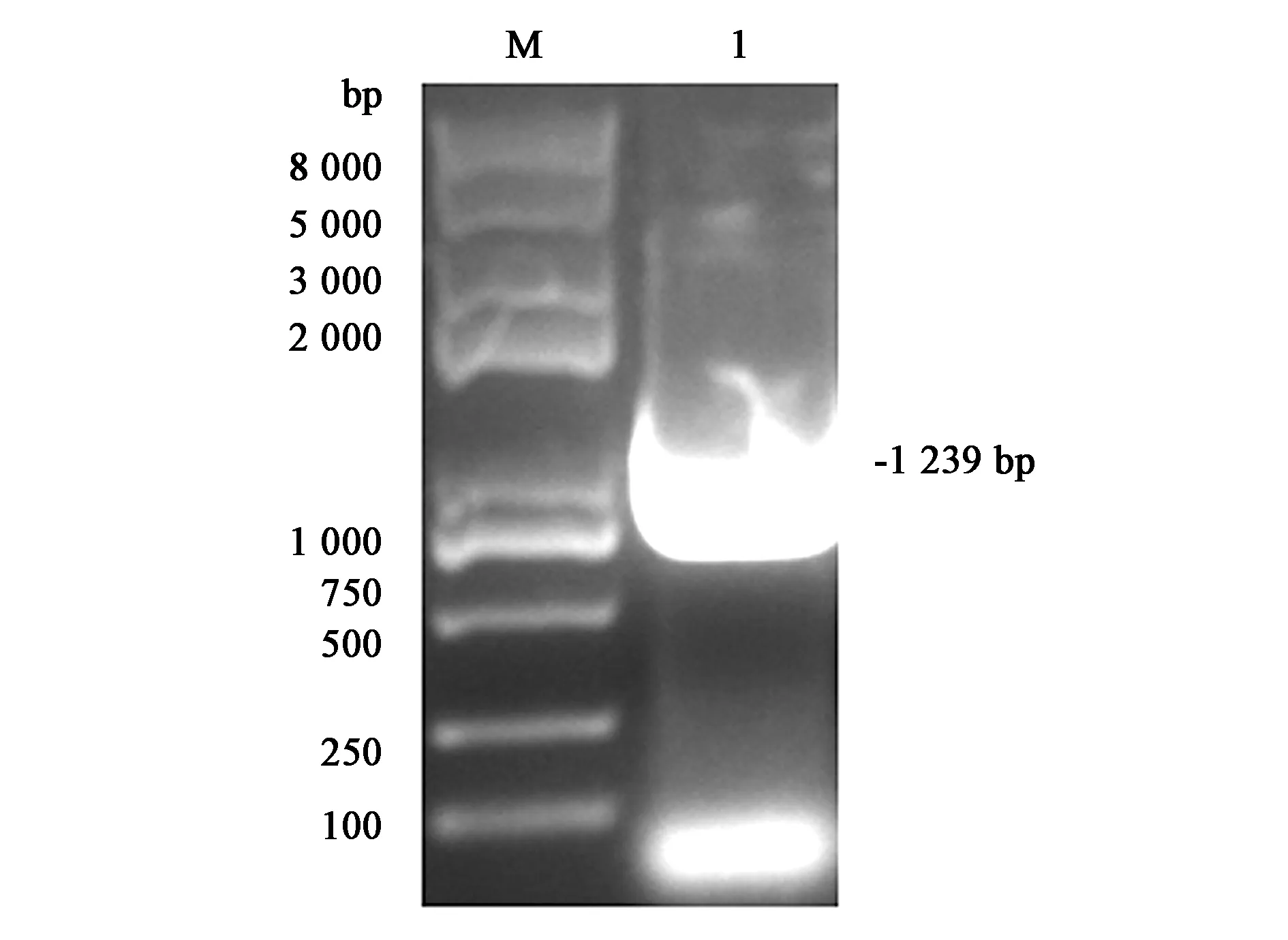
注:M—DNA Marker;1—E2-FePCR扩增片段。
2.2 E2-Fe融合蛋白在E.coliBL21中的诱导表达及其条件优化
在诱导表达融合蛋白E2-Fe前使用在线软件ExPASy预测了其分子量约为51 kD。为了使融合蛋白得到高效表达,本研究首先使用了IPTG来诱导E.coli表达融合蛋白,通过改变IPTG的用量、培养温度及诱导时间后,结果发现融合蛋白在菌液上清及沉淀中的表达量都依然较低,且没有发生明显改变,继而使用乳糖作为诱导物。研究结果(图2)表明,使用0.5%乳糖诱导6 h时,菌液沉淀中融合蛋白的表达量几乎到了高峰,而其他浓度的乳糖诱导6 h时菌液上清的蛋白胶图中均未观察到明显的目的条带。这说明在本研究中,乳糖是比IPTG更适合的诱导物,融合蛋白E2-Fe以包涵体形式存在于菌液沉淀中,诱导表达的最优条件为:0.5%乳糖诱导6 h。

图2 不同浓度乳糖诱导表达的融合蛋白E2-Fe胶图Fig.2 Gel map of fusion protein E2-Fe induced by lactose at different concentrations
2.3 E2-Fe融合蛋白的质谱分析与Western-blotting验证
为了进一步验证上述目的条带确为融合蛋白E2-Fe,而后进行了质谱分析与Western-blotting验证。将目的条带切下后进行了质谱分析,结果如表2所示,对蛋白匹配度的打分为9.16,蛋白的分子量及氨基酸数目也与预测值基本相符,其中分子量大小的微小差异可能与使用的蛋白预测软件不同有关,因此质谱分析结果表明此条带确为E2-Fe融合蛋白。Western-blotting验证结果如图3所示,在51 kD附近出现了明显的条带,与预测结果相符,其他部位出现的不明显条带可能与His-tag一抗与蛋白的结合力较强有关。上述所有结果都已表明本研究成功在E.coliBL21中高效表达了E2-Fe融合蛋白。

表2 E2-Fe融合蛋白相应氨基酸片段质谱分析结果Table2 Mass spectrometric analysis results of corresponding amino acid fragments of E2-Fe fusion protein
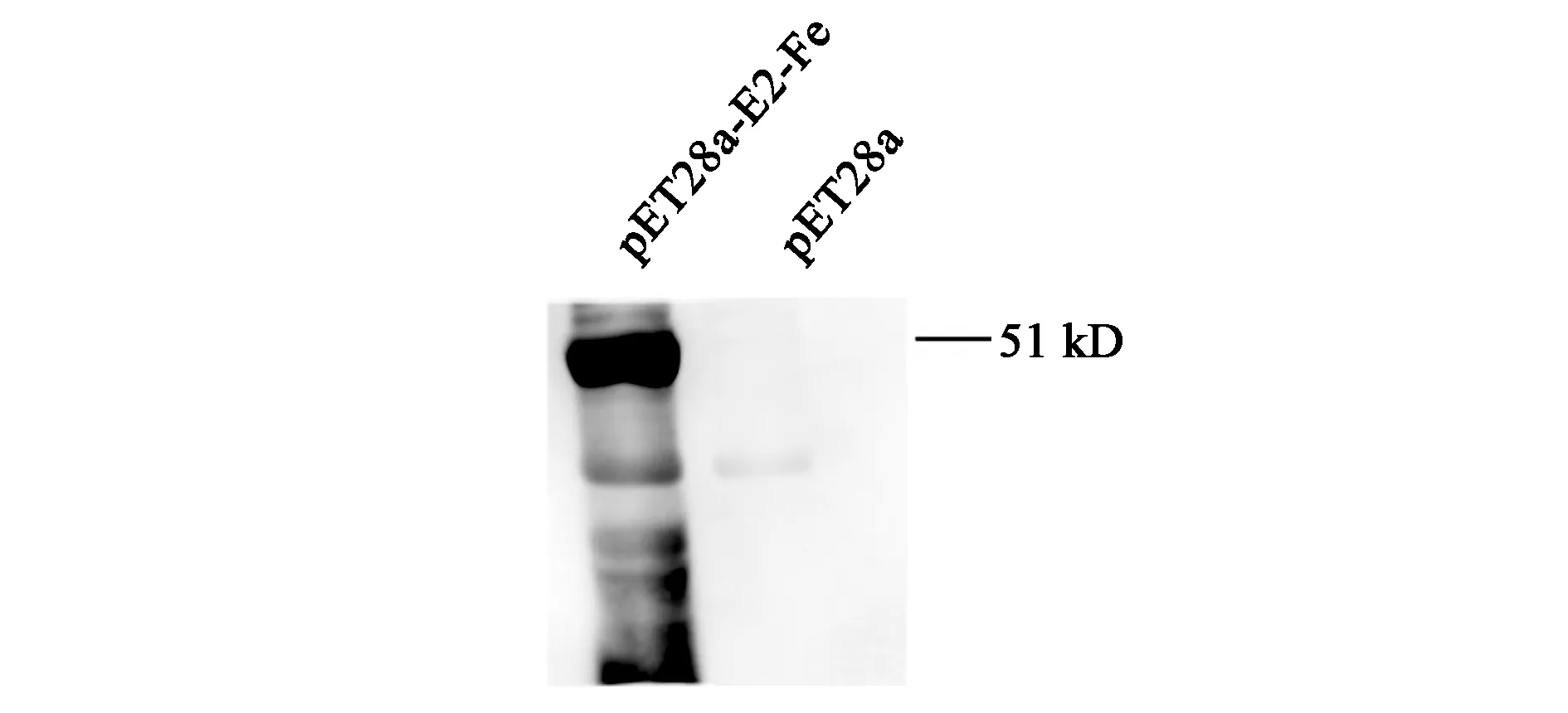
图3 E2-Fe融合蛋白的Western-blotting图Fig.3 Western-blotting of E2-Fe fusion protein
2.4 E2-Fe融合蛋白的电镜观察
铁蛋白纳米颗粒的直径约为12 nm。为了验证融合蛋白E2-Fe是否以纳米颗粒的形式存在于菌液沉淀中,将获得的菌液沉淀超声破碎后充分溶解于脲NTA-0溶液中,使用镍柱纯化后透析复性,将获得的融合蛋白E2-Fe在111 000 r·min-1的离心力下,超速离心1.5 h,放于-80 ℃进行保存留用以待进行电镜观察。图4为融合蛋白E2-Fe的透射电镜观察图,重复试验即图4A、4B、4C中均可见大小较为均一、直径约为20 nm的颗粒。此结果表明,融合蛋白E2-Fe是以纳米颗粒的形式存在于菌液沉淀中的。
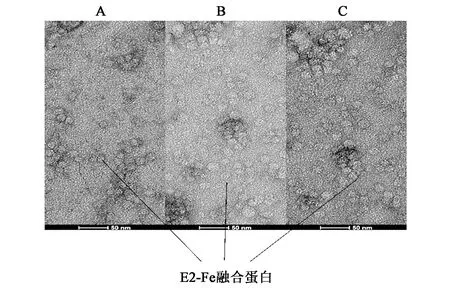
图4 透射电镜结果图Fig.4 Transmission electron microscopy results
3 讨论
对于传统的灭活猪瘟疫苗来说,其免疫期短、保护力低[32],我国猪瘟兔化弱毒株疫苗虽然使得我国的养猪业得到了进一步发展[33],但是,近几年猪瘟不仅发病率明显增高,其流行趋势和流行特点也越发复杂,持续感染的情况在全世界普遍存在,对其防控遇到了新的瓶颈期。同时我国又是养猪大国,近年来猪瘟的大爆发使得我国的养猪业陷入低迷期,猪肉也大幅涨价,所以加快猪瘟疫苗的研制刻不容缓。
2013年,美国国家卫生研究所与过敏与传染病研究所将铁蛋白应用于流感疫苗的研发,将幽门螺杆菌铁蛋白亚基的N端与流感病毒的H血凝素蛋白(hemagglutinin)基因融合,将该融合蛋白纳米颗粒作为抗原进行动物免疫实验,在动物体内成功的发生了免疫反应,生产了中和性抗体,达到了流感病毒疫苗的作用,而且这种新型疫苗的免疫范围更广,产生的中和抗体滴度比传统疫苗要高10倍左右,且能中和绝大多数跨度达70年的同型流行病毒株[34]。研究表明蛋白源性亚单位疫苗可以很好地解决传统灭活疫苗、弱毒(减毒)疫苗存在的问题。猪瘟病毒囊膜蛋白E2不仅具有较高的保守性,还可以在机体中诱导免疫反应发生,生成中和抗体,是主要的保护性抗原蛋白;而1个铁蛋白纳米颗粒表面可展示24个抗原蛋白,其免疫原性有可能会得到进一步提高,是理想的抗原呈递载体和疫苗开发平台。本研究以猪瘟病毒囊膜蛋白E2和铁蛋白纳米颗粒为材料,经过基因工程改造后,在E.coliBL21中成功地表达了融合蛋白E2-Fe,该融合蛋白是以纳米颗粒形式存在于菌液沉淀中的。经本研究发现,在融合蛋白表达过程中,0.5%乳糖诱导6 h可使其高效表达。从SDS-PAGE、Western-blotting结果图以及电镜图中均可看出,蛋白表达量较为可观,其纯化方法也比较简单。上述结果表明,以铁蛋白纳米颗粒为载体在大肠杆菌中高效表达猪瘟病毒囊膜蛋白E2来作为新型猪瘟疫苗是有可行性的。
但是大肠杆菌作为原核表达系统,在表达外源蛋白时会缺乏复杂的磷酸化、糖基化以及形成复杂二硫键等的翻译后修饰过程,对外源蛋白的正确折叠以及生物活性存在一定影响。从本研究结果也可看出融合蛋白E2-Fe是以包涵体的形式存在于菌液沉淀中的,因此在进行后续实验前需要进行蛋白复性实验,增加了后期的实验量,针对大肠杆菌表达系统的缺点,可通过继续优化条件,如mRNA模板、培养基的成分及种类、培养条件、以及培养方式等,而使大肠杆菌更高效地表达外源目的蛋白,以期获得具有自然空间构象的融合蛋白E2-Fe,早日达到疫苗生产的条件,加快新型猪瘟疫苗的研发进程。

