血清SAA与β2-MG水平对急性脑梗死患者预后的预测价值
黄 晋 吴汶芳 禚 娅
鹤壁市人民医院,河南 鹤壁 458000
急性脑梗死(acute cerebral infarct,ACI)是常见的缺血性脑血管疾病,具有发病率高、病死率高、致残率高及复发率高等特征,严重危害人们尤其是中老年身体健康[1-2]。目前临床对ACI的发病机制尚处于探索阶段,通常认为与兴奋性氨基酸细胞毒性作用、能量衰竭、梗死灶周边去极化、炎症反应、氧自由基损伤、细胞凋亡等密切相关[3-5]。ACI以梗死灶中央区脑组织坏死、周围水肿、血管活性物质含量改变及纤溶系统紊乱等为主要病理变化,最终导致不可逆神经功能损害[6]。介入、静脉溶栓、药物保守治疗是临床处理ACI的主要方式,可有效挽救患者生命,减轻其神经功能损伤,但仍有部分患者病情改善效果不佳,预后不良[7]。因此,研究ACI预后影响因素可为临床针对性措施的采取提供依据,从而改善预后。血清淀粉样蛋白A(serum amyloid A protein,SAA)由肝脏合成,是一种多基因编码的多形态载脂蛋白,属急性时相反应蛋白,主要生理功能是在炎性反应中调控高密度脂蛋白(high-density lipoprotein,HDL)代谢,参与ACI斑块形成。既往研究[8-10]显示冠心病、动脉粥样硬化、急性移植排斥反应、肿瘤、细菌感染、病毒感染等患者均可检测到血清SAA水平异常升高。β2-微球蛋白(β2-microglobulin,β2-MG)是1968年首次由瑞典化学家BERGGARD自肾小管病变患者尿液中分离出来、由肾脏排泄的小分子球蛋白,从结构而言与人类组织相容性抗原的亚单位属同种物质,且是细胞膜表面重要组成部分。血清β2-MG主要由有核细胞及淋巴粒细胞分泌而来,当人类组织相容性抗原代谢加快或细胞大量坏死时,β2-MG自游离形式释放入血液中,绝大部分经肾小球胞饮重吸收方式而分解为氨基酸,故仅在机体处于病理状态时血清β2-MG将升高。研究[11]发现ACI发病与血管淀粉样沉积物有关,而β2-MG原纤维是淀粉样沉积物的主要成分,且β2-MG水平与ACI病情严重程度密切相关。目前临床对ACI患者血清SAA、β2-MG水平的报道多集中在病情诊断及疗效判定上[12-13],鲜有关于两者与ACI预后关系的研究。鉴于此,本研究选取120例ACI患者,分析两者联合对ACI预后的预测价值。
1 资料与方法
1.1一般资料选取2018-03—2020-03鹤壁市人民医院收治的120例ACI患者,男71例,女49例,年龄42~78(64.09±7.87)岁。纳入标准:(1)符合ACI诊断标准[14],经颅脑MRI确诊;(2)发病至入院时间<7 d。排除标准:(1)无症状静止性脑梗死;(2)已出现心、肺、肝、肾衰竭,脑疝等严重并发症者;(3)恶性肿瘤患者。本研究经院伦理委员会批准,所有患者知情同意并签署知情同意书。
1.2方法
1.2.1 血清SAA、β2-MG检测:全部受试者入院后抽取5 mL肘部静脉血,3 000 r/min离心10 min(离心半径10 cm)分离出血清,放置于—20 ℃环境中备用。分别采用酶联免疫吸附法(enzyme linked immunoserbent assay,ELISA)、放射性免疫比浊法经DxC 800全自动生化分析仪(美国贝克曼库尔特有限公司)测定血清SAA、β2-MG水平。严格按照试剂盒说明书步骤及实验室标准操作程序操作,并根据标准曲线计算样本浓度。
1.2.2 ACI预后评估方式:发病后30 d,根据改良Rankin量表(modified Rankin Scale,mRS)评价ACI患者预后[15],总分0~6分。0分:完全无症状;1分:有症状,无明显功能障碍;2分:轻度残疾;3分:中度残疾,可独立行走;4分:中重度残疾,生活无法完全自理;5分:重度残疾,生活完全不能自理;6分:死亡。以mRS>2分为预后不良,≤2分为预后良好。将预后不良患者纳入不良组,预后良好患者纳入良好组。所有受试者的mRS评分由同一位经过系统培训的医师收集、记录。
1.2.3 临床资料收集、赋值:收集良好组、不良组临床资料,包括年龄、性别、体重指数(body mass index,BMI)、抽烟、饮酒、高血压史、高血脂、糖尿病史、脑卒中史、贫血、合并房颤、发病至入院时间、治疗前美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)[16]、梗死灶直径≥5 cm、前壁梗死、CT早期缺血改变、牛津郡社区卒中项目(Oxfordshire community stroke project,OCSP)分型[完全前循环梗死(total anterior circulation infarct,TACI)、部分前循环梗死(partial anterior circulation infarct,PACI)、腔隙性梗死(lacunar cerebral infarction,LACI)、后循环梗死(posterior circulation infarction,POCI)]、治疗方式(介入治疗、静脉溶栓治疗、药物保守治疗)、血清SAA、血清β2-MG。对上述可能影响急性脑梗死30 d预后的因素进行赋值,并以之为自变量,以30 d预后(良好=0,不良=1)为因变量行Logistic回归分析。见表1。

表1 Logistic回归分析赋值

2 结果
2.12组血清SAA、β2-MG及其他可能影响ACI预后的因素比较120例ACI患者mRS评分>2分例,预后不良44例,构成比36.67%;预后良好76例,构成比63.33%。2组年龄、性别、BMI、抽烟、饮酒、高血压史、高血脂史、糖尿病史、脑卒中史、贫血、合并房颤、治疗前NIHSS评分、前壁梗死、CT早期缺血改变、OCSP分型、治疗方式比较差异均无统计学意义(P>0.05);不良组发病至入院时间长于良好组,梗死灶直径≥5 cm构成比大于良好组,血清SAA、β2-MG水平高于良好组,差异均有统计学意义(P<0.05)。见表2。
2.2Logistic回归分析ACI预后的影响因素经Logistic回归分析,发病至入院时间、梗死灶直径≥5 cm、血清SAA、血清β2-MG均是ACI预后的影响因素(P<0.05)。见表3。
2.3血清SAA、β2-MG水平对ACI患者预后的预测价值分析ROC结果显示,血清SAA、β2-MG预测ACI预后不良的最佳截断点分别为22.35 mg/L、3.38 mg/L,AUC分别为0.758、0.732;以SAA>10.00 mg/L,β2-MG>3.00 mg/L为阳性标准,两者联合预测ACI预后时以串联方式进行,即两者均为阳性时方可预测预后不良。经Kappa一致性检验,血清SAA联合β2-MG预测ACI预后不良的效能高(Kappa=0.829,P<0.05)。见表4、图1。
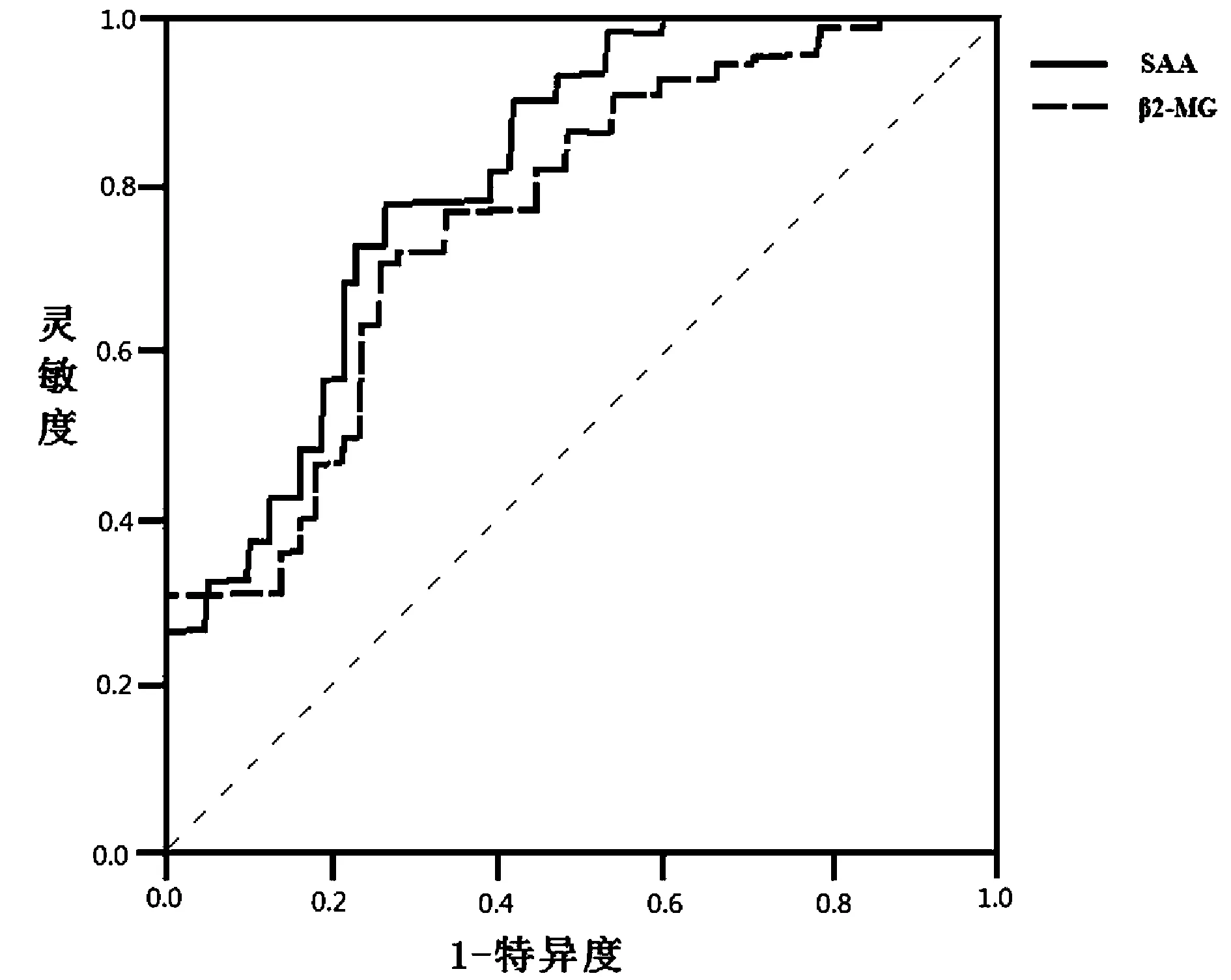
图1 血清SAA、β2-MG水平对ACI患者预后预测价值的ROC曲线Figure 1 ROC curve of the prognostic value of serum SAA and β2-MG levels in ACI patients
3 讨论
ACI又称缺血性脑卒中,是临床常见病、多发病,且随着老龄化的加剧,ACI患者数量呈增加趋势[17]。研究[18-20]认为动脉粥样硬化,血管腔狭窄、痉挛,血液聚集性与黏稠度升高是ACI主要的病理基础,均可导致脑组织血液供应不足,从而引发脑组织缺血、缺氧性病变坏死。ACI治疗原则主要为溶栓、抗凝、改善血液黏稠度及血脂代谢,以减少脑细胞损伤,改善脑部血液供应,恢复神经功能。目前临床针对ACI预后影响因素已有较多报道,但观点不一,仍需进一步明确[21-23]。近年来研究[24-25]表明SAA、β2-MG均与炎症反应及动脉粥样硬化斑块的形成有关,参与ACI疾病进展。因此,了解SAA、β2-MG对ACI预后的预测价值,对指导临床治疗及改善预后具有重要意义。

表 2 2组血清SAA、β2-MG及其他可能影响ACI预后的因素比较

表3 Logistic回归分析ACI预后的影响因素

表4 血清SAA、β2-MG水平对ACI患者预后的预测价值
本研究中不良组发病至入院时间长于良好组,梗死灶直径≥5 cm构成比大于良好组,血清SAA、β2-MG水平高于良好组,提示除发病至入院时间、梗死灶直径等常规因素外,血清SAA、β2-MG也是ACI预后的影响因素。梗死灶直径≥5 cm时可压迫周围毛细血管,血液恢复再灌注时易导致损伤血管破裂,诱发梗死灶点片状出血。梗死直径大可导致严重的脑水肿及占位效应,加重患者神经功能损伤,预后不良。ACI病灶中缺血半暗带存在侧支循环、大量存活神经元。随着缺血时间的延长,缺血半暗带逐渐缩小,存活神经元数量减少,发病至入院时间过长将导致血流再灌注入损伤血管,引发继发性脑出血,影响预后。SAA由肝细胞合成、分泌,在炎性状态下其可置换与HDL结合的载脂蛋白,减少胆固醇外流;与HDL结合形成复合体,将胆固醇酯迅速转运至巨噬细胞中,增加斑块脂质中游离胆固醇、胆固醇酯浓度,降低脂质硬度,提高斑块不稳定性;促进基质金属蛋白酶表达,迅速降解纤维帽中细胞外基质,造成纤维帽破裂,加快粥样硬化斑块破裂[26-27]。TAO等[28]认为SAA参与ACI动脉粥样硬化的发生、发展,通过参与改变ACI斑块稳定性影响患者预后。β2-MG由单核细胞、淋巴细胞、间质细胞等合成,研究认为其可能作为炎症启动因子之一,参与ACI动脉粥样硬化病理过程[29]。ACI动脉粥样硬化形成进程中局部淋巴细胞聚集,激活神经-体液-免疫系统,导致β2-MG分泌量增加,且其水平随免疫激活程度的增加而上升。另有研究指出ACI患者存在肾素-血管紧张素-醛固酮系统激活,造成肾小动脉痉挛及肾小球率过滤降低,β2-MG排出量减少,血液浓度升高[30]。
本研究显示血清SAA、β2-MG预测ACI预后不良的最佳截断点分别为22.35 mg/L、3.38 mg/L,AUC分别为0.758、0.732;经Kappa一致性检验,血清SAA联合β2-MG预测ACI预后不良的效能高,提示血清SAA、β2-MG单独及联合检测在评估ACI预后中有重要作用,可作为ACI近期预后预测的可靠指标。SAA属急性时相蛋白,在评估机体炎症反应程度时灵敏度及特异度均较高,研究显示其在多种炎症相关性疾病中均异常升高[31-35]。尽管β2-MG与ACI病情严重程度相关,但其也是反映患者肾功能的灵敏指标,同样高表达于高血压、肾病等疾病中,在预测ACI预后不良上具有一定局限性。两者联合检测可弥补各自特异性不足的优势,发挥更为重要的ACI预后预测价值。临床实践中需加强对ACI患者治疗前血清SAA、β2-MG水平的关注,尽早采取应对措施,尽可能改善ACI预后[36-40]。

